Содержание
- 2. Границы между исследованием и обычным лечением Медицинская практика – это воздействие, единственной целью которого является улучшение
- 3. Клинические исследования должны проводиться в соответствии с этическими принципами, базирующимися на Хельсинской Декларации, и соответствовать GCP
- 4. Этический комитет Ethics Committee Независимый орган (на уровне данного учреждения, региональном, национальном или наднациональном уровне), состоящий
- 5. Принципы деятельности комитетов по этике Независимость. Компетентность. Открытость. Плюрализм. Объективность Конфиденциальность
- 6. Функции комитетов по этике Осуществляют функции экспертизы, консультирования, рекомендаций, побуждения, оценки, ориентирования в моральных и правовых
- 7. Обязанности ЭК защищать права, безопасность и здоровье испытуемых. Особое внимание должно быть уделено тем исследованиям, в
- 8. ЭК должны осуществлять свои функции согласно письменным рабочим процедурам и должны хранить всю письменную документацию о
- 9. Процедуры ЭК Определение состава (указываются имена и квалификация членов и официальный орган, учредивший данный комитет). Составление
- 10. Состав ЭК Должен состоять из рационального количества участников (членов), и коллективно обладать квалификацией и опытом, достаточными
- 11. Документы для предоставления в ЭК для осуществления им своих функций: Протоколы исследований, поправки к протоколу, Письменные
- 12. По каждому документу, поступившему в ЭК должен быть вынесен вердикт: положительное заключение; для получения положительного заключения
- 13. У субъектов исследований должно быть достаточно информации, на основании которой они могут принять решение об участии
- 14. Информированное согласие Информированное согласие - процесс добровольного подтверждения пациентом его согласия участвовать в том или ином
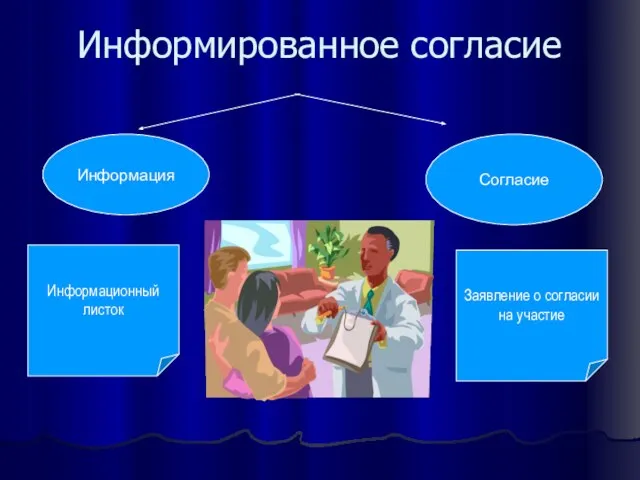
- 15. Информированное согласие Информация Согласие Информационный листок Заявление о согласии на участие
- 16. Основные принципы информированного согласия Испытуемый информирован o целях исследования о методах исследования о лекарственных средствах и
- 17. Информация для испытуемых Информация о цели исследования и его дизайне. Описания предполагаемых риска и неудобств для
- 18. ОСНОВНЫЕ ПРИНЦИПЫ ICH GCP 4.8.11 Испытуемый или его официальный представитель должны получить подписанный и датированный экземпляр
- 19. ИС должно быть получено до любых манипуляции, проводимых для целей исследования! ИС может быть получено только
- 20. Изменения в ИС: Изменения протокола Изменение дозы препарата Изменение количества и вида процедур Новая информация по
- 21. Принятие решения об участии в КИ Пациент должен иметь возможность задать исследователю все интересующие его вопросы,
- 22. Участвуя в клиническом исследовании. Вы, вероятно, сможете: получить доступ к новым видам лечения, которые не доступны
- 23. Клинические исследования имеют следующие неудобства (риски): могут быть побочные эффекты при применении лекарственных средств, лечение может
- 24. Что такое плацебо? Плацебо - это неактивное вещество (таблетка, жидкость, порошок), которое не имеет лечебного эффекта.
- 25. Типичные ошибки, допускаемые при оформлении информированного согласия Отсутствие даты подписания. Не указано время подписания в случае
- 26. Уязвимые категории населения Дети Беременные Люди с психическими отклонениями Экономически или образовательно несостоятельные личности Заключенные Военнослужащие
- 27. FDA Information Sheets. A Guide To Informed Consent. Illiterate English-Speaking Subjects An impartial third party should
- 28. Планирование медицинских исследований с участием детей Не разрешенные к применению, но находящиеся на рассмотрении в установленном
- 29. Исследования на детях Consent form Assent form 6 – 12 13 – 18
- 30. Этические аспекты проведения исследований на женщинах репродуктивного возраста Клинические исследования с участием женщин, которые на момент
- 31. Исследования на людях с нарушением психики В качестве основного правила предполагается, что все взрослые люди, вне
- 32. Бюллетень ВАК министерства образования РФ, М, №3, 2002.-С.73-76. При принятии к рассмотрению и защите диссертаций, тематика
- 34. Скачать презентацию






























 Captain America
Captain America  Семья Яковлевых прдставляет
Семья Яковлевых прдставляет Будущее в прошлом
Будущее в прошлом Силы трения
Силы трения Презентация на тему Храмы Древней Индии
Презентация на тему Храмы Древней Индии  Парламентские и президентские выборы в Азербайджане
Парламентские и президентские выборы в Азербайджане 20180305_geroichekaya_tema_v_muzyke
20180305_geroichekaya_tema_v_muzyke Поль Пуаре
Поль Пуаре Dr. Petra Opitz Joint Implementation als Moglichkeit der Ko-Finanzierung bei der Erschlie?ung von Effizienzpotenzialen in der EnergiewirtschaftDeutsch-russische Konferenz Energieeffizienz, EMBIZ Moskau, 27.-29.11.2007
Dr. Petra Opitz Joint Implementation als Moglichkeit der Ko-Finanzierung bei der Erschlie?ung von Effizienzpotenzialen in der EnergiewirtschaftDeutsch-russische Konferenz Energieeffizienz, EMBIZ Moskau, 27.-29.11.2007 Рекламные и шпионские программы и защита от них
Рекламные и шпионские программы и защита от них ЧЕМ БОЛЬШЕ ДЕТАЛЕЙ, ТЕМ ЯРЧЕ ИСТОРИЯ
ЧЕМ БОЛЬШЕ ДЕТАЛЕЙ, ТЕМ ЯРЧЕ ИСТОРИЯ Оптимізація податкового навантаження на платників податків
Оптимізація податкового навантаження на платників податків Мастер – класс по русскому языку (технология Ю.А.Поташкиной)
Мастер – класс по русскому языку (технология Ю.А.Поташкиной) Агро-парк Бабынино, Калужская область. Бизнес-идея
Агро-парк Бабынино, Калужская область. Бизнес-идея Сеня Букашкин
Сеня Букашкин Школа майбутнього першокласника. Математика 4 (Заняття з використанням мультимедійного проектора) - презентация для начальной шко
Школа майбутнього першокласника. Математика 4 (Заняття з використанням мультимедійного проектора) - презентация для начальной шко Презентация на тему Аминокислоты
Презентация на тему Аминокислоты  Весенняя серия игр Что Где Когда
Весенняя серия игр Что Где Когда Лыжный спорт
Лыжный спорт Система права
Система права 751aac1464554a6f9e64c98bb5ee2b49
751aac1464554a6f9e64c98bb5ee2b49 Из истории физической культуры. Развитие физической культуры в России XVII – XIX веков
Из истории физической культуры. Развитие физической культуры в России XVII – XIX веков Справка ВУ-45 переделка
Справка ВУ-45 переделка Боевое знамя
Боевое знамя Обеспечение эффективного лабораторного контроля
Обеспечение эффективного лабораторного контроля Дисгармоническое развитие личности
Дисгармоническое развитие личности Русский классицизм в архитектуре. История классицизма в России
Русский классицизм в архитектуре. История классицизма в России Презентация на тему Как различать причастия и отглагольные прилагательные
Презентация на тему Как различать причастия и отглагольные прилагательные