Слайд 2Евгений Шварц «Сказка о потерянном времени»:
«… ты помни: человек, который понапрасну теряет

время, сам не замечает, как стареет»
Слайд 3В органической химии известно несколько типов частиц, в которых валентность атома углерода

отлична от четырех
Слайд 4Обычно это короткоживущие частицы, существующие только в виде интермедиатов, которые претерпевают быстрое

превращение в более устойчивые молекулы (некоторые из них отличаются большей устойчивостью, и их удается выделить)
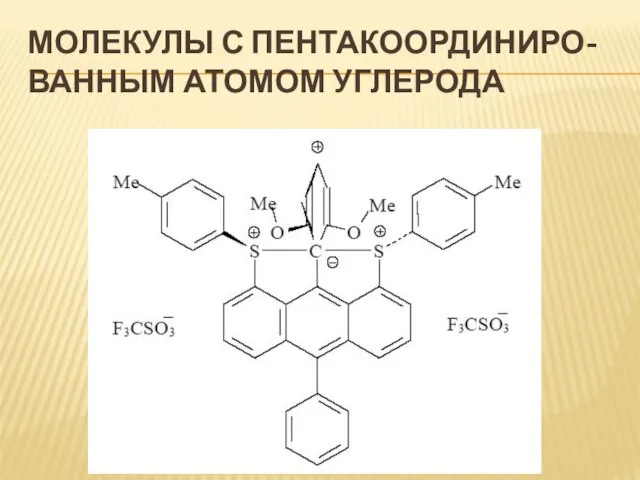
Слайд 5Молекулы с пентакоординиро-
ванным атомом углерода
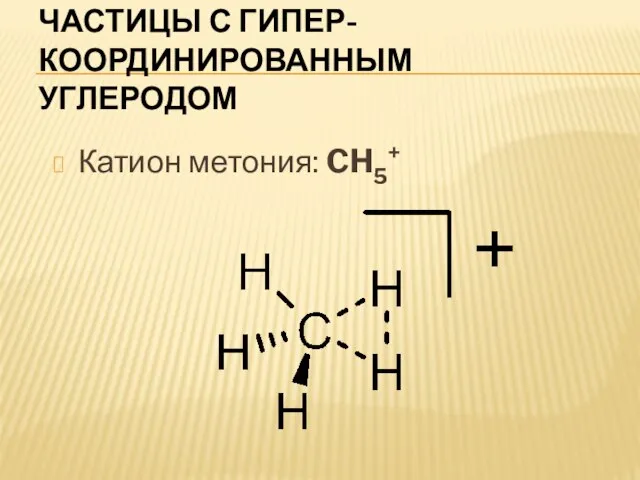
Слайд 6Частицы с гипер-координированным углеродом
Катион метония: CH5+
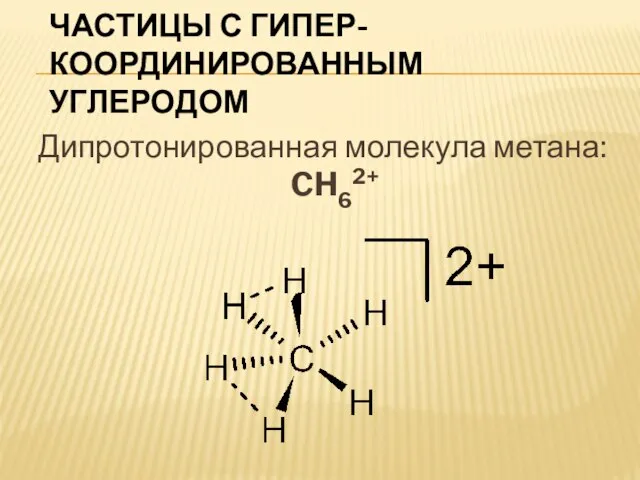
Слайд 7Частицы с гипер-координированным углеродом
Дипротонированная молекула метана: CH62+
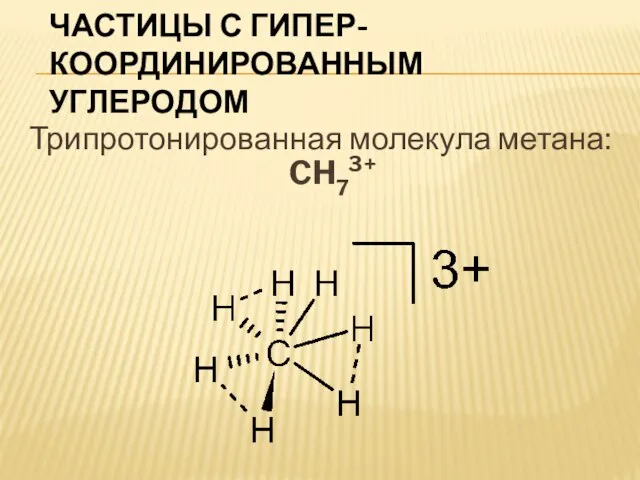
Слайд 8Частицы с гипер-координированным углеродом
Трипротонированная молекула метана: CH73+
Слайд 9Классификация интермедиатов
Радикалы
Карбокатионы
Карбанионы
Карбены
Нитрены
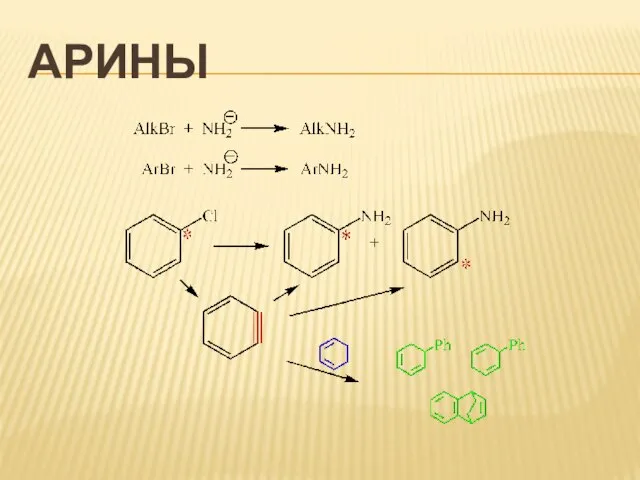
Арины

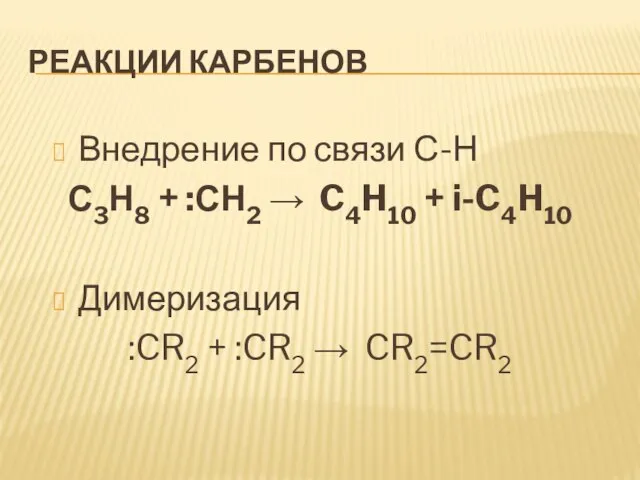
Слайд 10Карбкатионы
Карбкатионы – положительно заряженные частицы,
у которых положительный заряд сосредоточен
на атоме

углерода
R3C+
Слайд 11Устойчивость карбкатионов
Они наиболее устойчивы в растворах (в некоторых случаях их удается выделить

в виде солей)
В полярных растворителях могут быть свободными (сольватированы)
В неполярных растворителях существуют в виде ионных пар, т.е. тесно связанны с отрицательным ионом
Слайд 12Устойчивость карбкатионов
Уменьшается в ряду:
R3C+ > R2HC+ > RH2C+ > H3C+

Известны перегруппировки первичных и вторичных карбкатионов в третичные
Объясняется гиперконъюгацией или эффектом поля
Слайд 14Устойчивость карбкатионов
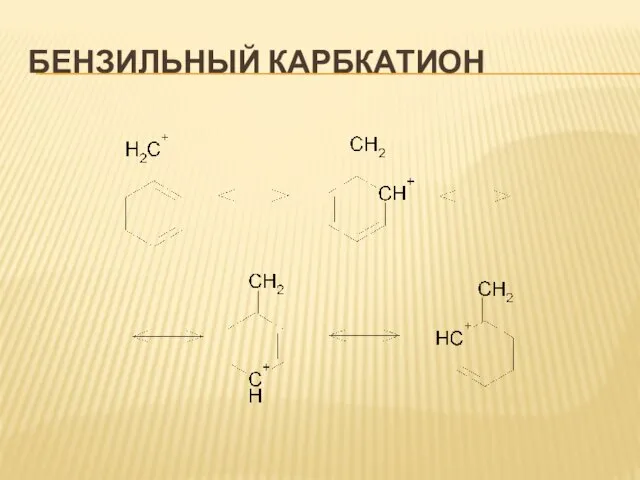
Сопряжение с двойной связью повышает устойчивость системы вследствие увеличения делокализации заряда

Слайд 17Устойчивость карбкатионов
Трифенилметил- и дифенилметил-катионы были выделены в виде твердых солей
Ph3C+BF4- - продажный

реактив
Слайд 18Устойчивость карбкатионов
Наличие в соседнем положении гетероатома повышает устойчивость карбкатионов
МеОСН2+ВF6- - устойчивое твердое

вещество
Слайд 19Пространственная структура карбкатионов
sp2-гибридизация атома углерода
Структура плоская

Слайд 20Способы генерации карбкатионов
Прямая ионизация, при которой группа, связанная с атомом углерода,

уходит вместе с электронной парой (процесс обратимый)
R3CX R3C+ + X-
Слайд 21Способы генерации карбкатионов
Алканы образуют карбкатионы в суперкислотах за счет потери гидрид-иона (легче

всего от третичного, труднее от первичного)
Слайд 22Способы генерации карбкатионов
Растворы фторсульфоновой кислоты (FSO3H) и пентафторида сурьмы (SbF5) в SO2

или SO2ClF являются самыми сильными из известных кислых растворов и называются суперкислотами
Слайд 23Способы генерации карбкатионов
Присоединение протона или другой положительно заряженной частицы к одному из

атомов ненасыщенной системы
R2C=Y + H+ R2C+-YH
Слайд 24Реакции карбкатионов
Комбинация с частицей, имеющей электронную пару:
R3С+ + Y- R3С-Y

R3С+ + :Y R3С-Y+
Слайд 25Реакции карбкатионов
Потеря атомом, соседним с карбкатионным центром, протона или другого положительного иона:
R2C+-Z-H

R2C=Z + H+
Слайд 26Реакции карбкатионов
Перегруппировка
CH3CH2CH2+ CH3CH+CH3
Присоединение по двойной связи
CH2=CH2 + CH3-CH2+
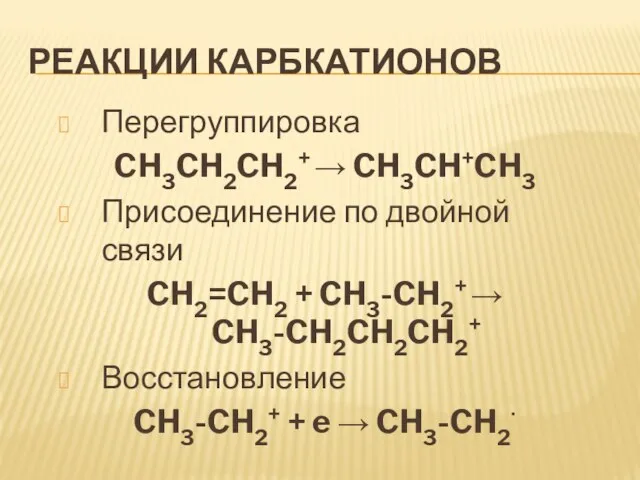
CH3-CH2CH2CH2+
Восстановление
CH3-CH2+ + e CH3-CH2
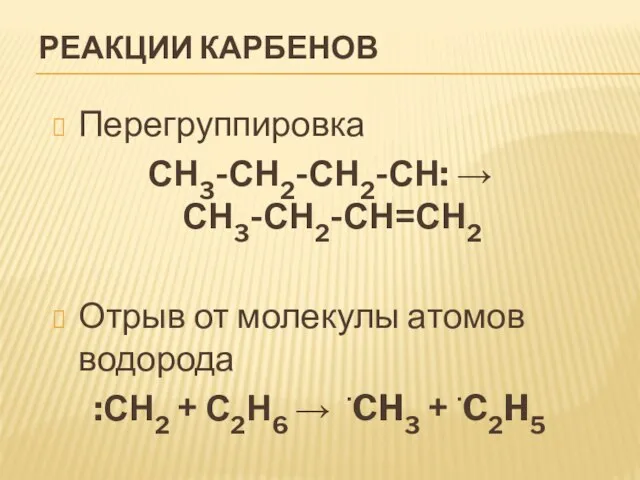
Слайд 27Карбанионы
Карбанионы – отрицательно заряженные частицы,
у которых заряд сосредоточен
на атоме углерода
R3C-

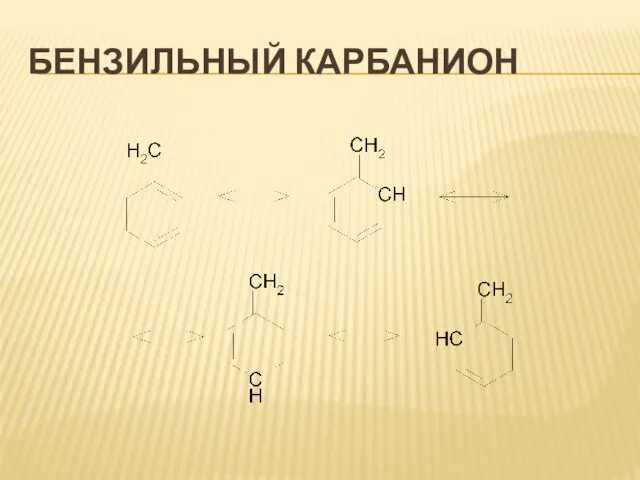
Слайд 28Устойчивость карбанионов
Алкильные карбанионы очень не устойчивы в растворах
Устойчивость уменьшается в ряду:

фенил > винил > циклопропил > метил > > первичный > вторичный > третичный
Слайд 31Устойчивость карбанионов
Еще более устойчивы
дифенилметил- и трифенилметил-анионы, которые сохраняются в растворах

неопределенно долгое время при условии абсолютного отсутствия воды
Слайд 32Устойчивость карбанионов
R2C--C(Y)=O R2C=C(Y)-O-
CH2--NO2 CH2=NO2-
рКа составляет 10.2
CH3-NO2 CH2--NO2 +
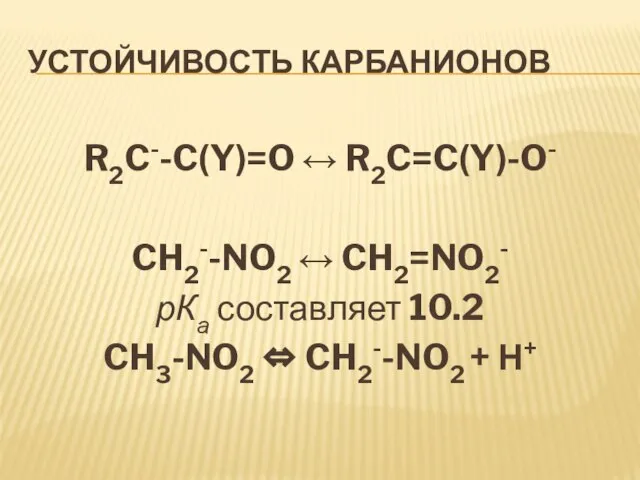
Н+
Слайд 33Устойчивость карбанионов
Cтабилизирующий эффект функциональных групп в -положении к карбанионному центру убывает в

ряду:
NO2 > RCO > COOR > SO2 > CN ~ CONH2 > Hlg > H > R
Слайд 34Устойчивость карбанионов
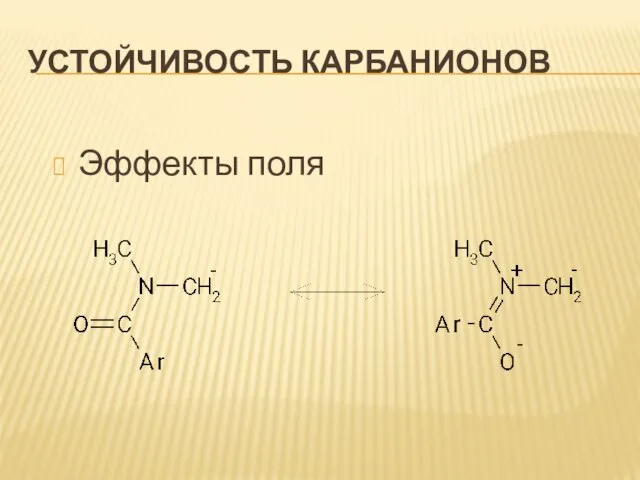
Эффекты поля
Слайд 35Устойчивость карбанионов
Ароматический характер

Слайд 36Пространственная структура карбанионов
sp3-гибридизация атома углерода неподеленная электронная пара занимает одну из вершин

тетраэдра (пирамидальная структура)
sp2-гибридизация атома углерода (стабилизация резонансом)
Структура плоская
Слайд 37Способы получения карбанионов
Отщепление протона
R-H R- + H+

Слайд 38Способы получения карбанионов
Присоединение к С=С связи
CH2=CH2 + Y- YCH2CH2-
Из анионов
R-COO-
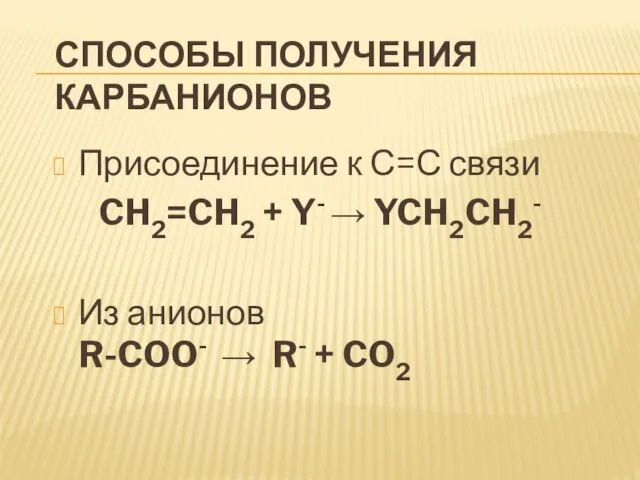
R- + CO2
Слайд 39Реакции карбанионов
Комбинация с положительно заряженной частицей:
R3С- + Y+ R3С-Y
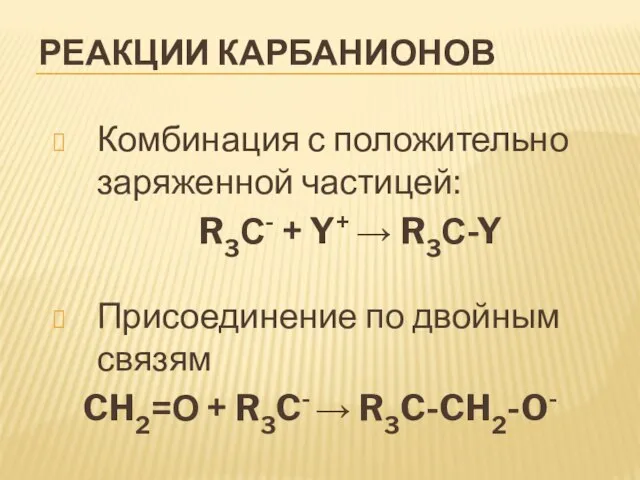
Присоединение по двойным связям
CH2=О + R3C- R3C-CH2-O-
Слайд 40Реакции карбанионов
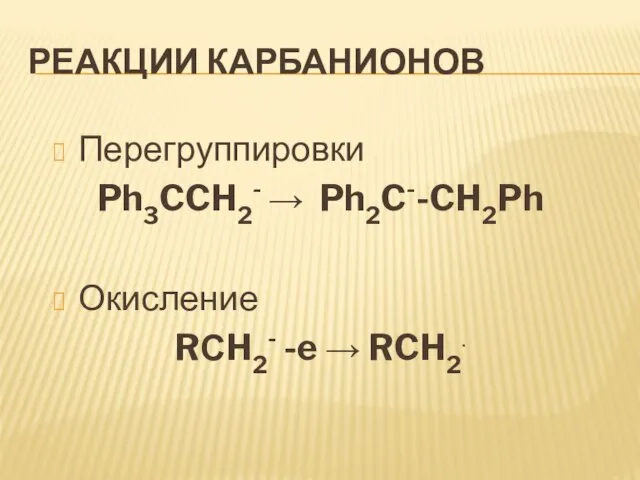
Перегруппировки
Ph3CCH2- Ph2C--CH2Ph
Окисление
RСH2- -e RCH2
Слайд 41Карбены
Карбены - высокореакционноспособные частицы, имеющие два неспаренных электрона
Их удается получить только

в матрицах при низких температурах
Карбен - это метилен СH2
Дихлоркарбен СCl2
Слайд 42Способы получения карбенов
-Элиминированием от углерода
СНCl3 + OH- :CCl2 +
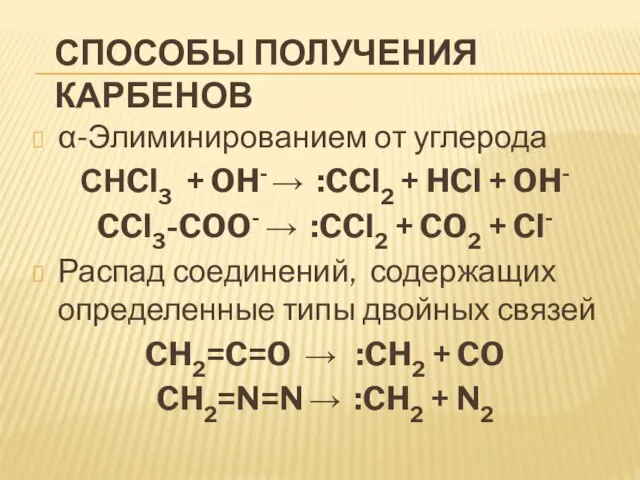
HCl + OH-
CCl3-COO- :CCl2 + CO2 + Cl-
Распад соединений, содержащих определенные типы двойных связей
CH2=C=O :CH2 + CO
CH2=N=N :CH2 + N2
Слайд 43Реакции карбенов
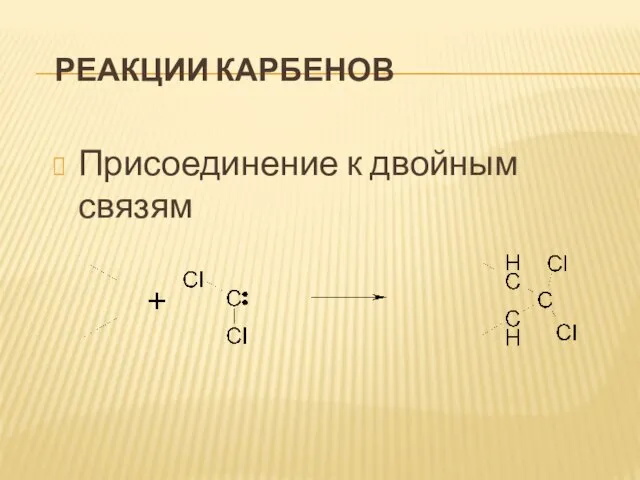
Присоединение к двойным связям
Слайд 44Реакции карбенов
Внедрение по связи С-Н
С3Н8 + :СН2 C4H10 + i-C4H10
Димеризация
:CR2 + :CR2 CR2=CR2
Слайд 45Реакции карбенов
Перегруппировка
СН3-СН2-СН2-СН:
СН3-СН2-СН=СН2
Отрыв от молекулы атомов водорода
:СН2 +
С2Н6 CH3 + C2H5
Слайд 46Нитрены
Аналоги карбенов
Частицы одновалентного азота
RN
Получают термическим или фотохимическим разложением азидов










































 Это характеристики тел или процессов, которые могут быть измерены на опыте
Это характеристики тел или процессов, которые могут быть измерены на опыте Валютное регулирование и валютный контроль. Международные расчеты. Задание
Валютное регулирование и валютный контроль. Международные расчеты. Задание очки Око-Эко
очки Око-Эко Презентация на тему Спектры и спектральный анализ
Презентация на тему Спектры и спектральный анализ Антарктида
Антарктида День Народного Единства. Многонациональный Донбасс
День Народного Единства. Многонациональный Донбасс Emerson Network Power
Emerson Network Power Правовое регулирование общественных отношений
Правовое регулирование общественных отношений Презентация 2 в ходе дебатов на тему «Бесполое размножение»
Презентация 2 в ходе дебатов на тему «Бесполое размножение» Счёт до 30. Порядковые числительные
Счёт до 30. Порядковые числительные История игрушек
История игрушек Проектирование женских сапог
Проектирование женских сапог attachment_938142772
attachment_938142772 Гражданские дела (первая инстанция) Урок 1.9. Регистрация кассационной жалобы
Гражданские дела (первая инстанция) Урок 1.9. Регистрация кассационной жалобы svoya_igra_3_klassy
svoya_igra_3_klassy Виртуальная психологическая студия по формированию и развитию личностных особенностей студентов
Виртуальная психологическая студия по формированию и развитию личностных особенностей студентов Презентация на тему Телевизор и дети
Презентация на тему Телевизор и дети  Криминология
Криминология Компетентностный подход
Компетентностный подход Die Kultur von Nischni Nowgorod
Die Kultur von Nischni Nowgorod Загадка Лермонтова
Загадка Лермонтова Профільне навчання
Профільне навчання «Проектирование компетентностно -ориентированной образовательной среды».
«Проектирование компетентностно -ориентированной образовательной среды». Нечіткі моделі та інформаційна технологія геопросторового багатокритеріального аналізу рішень
Нечіткі моделі та інформаційна технологія геопросторового багатокритеріального аналізу рішень Великая Отечественная война 1941-1945
Великая Отечественная война 1941-1945 Работа психолога с заикающимся ребенком
Работа психолога с заикающимся ребенком Семья в романе Л. Н. Толстого «Война и мир»
Семья в романе Л. Н. Толстого «Война и мир» Развитие науки и образования в России в первой четверти 18 века
Развитие науки и образования в России в первой четверти 18 века