Содержание
- 2. Исследование белков Свое название белки получили от яичного белка, который с незапамятных времен использовался человеком как
- 3. Первая концепция строения белков принадлежит голландскому химику Г. Мульдеру (1836). Основываясь на теории радикалов, он сформулировал
- 4. В 1888 г. А. Я. Данилевский предположил существование в белках -N-S- химических группировок. В 1934 г.
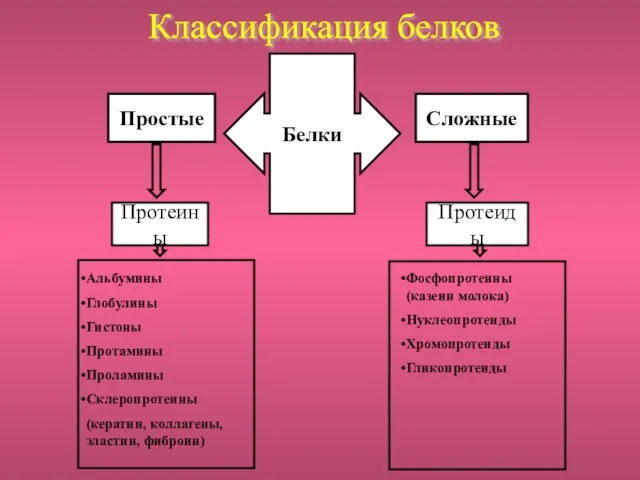
- 5. Белки Простые Сложные Протеины Протеиды Альбумины Глобулины Гистоны Протамины Проламины Склеропротеины (кератин, коллагены, эластин, фиброин) Фосфопротеины
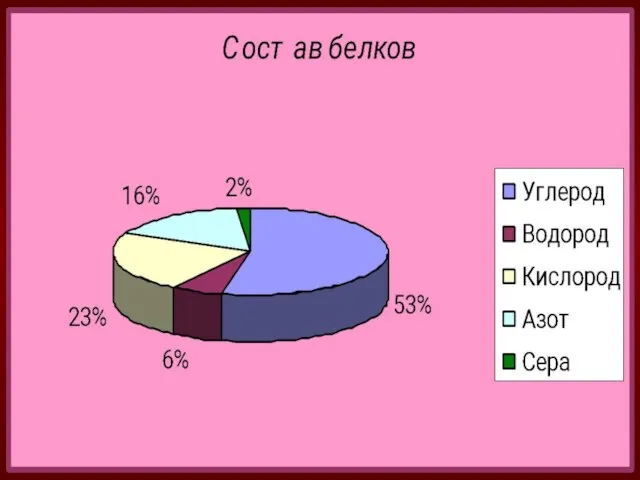
- 6. Состав и строение Составной частью белков являются аминокислоты. Аминокислоты -органические бифункциональные соединения, в состав которых входят
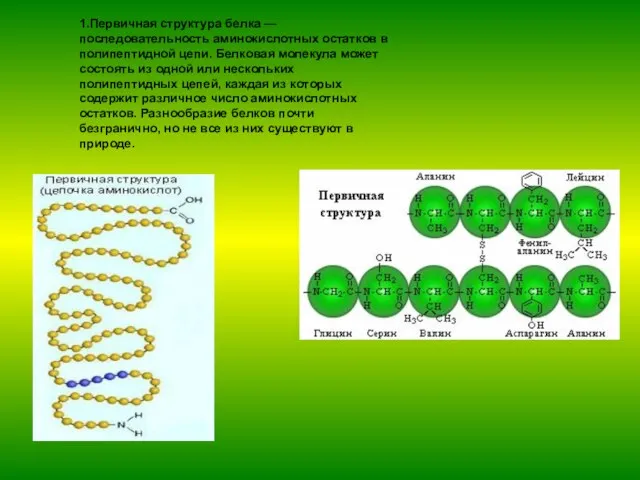
- 8. 1.Первичная структура белка — последовательность аминокислотных остатков в полипептидной цепи. Белковая молекула может состоять из одной
- 9. 2.Вторичная структура белка — способ скручивания полипептидной цепи в пространстве (за счет водородной связи между водородом
- 10. 3.Третичная структура белка — реальная трехмерная конфигурация закрученной спирали полипептидной цепи в пространстве (спираль, скрученная в
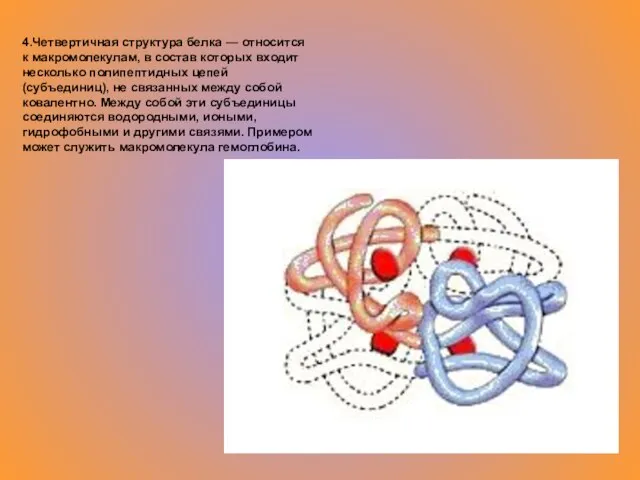
- 11. 4.Четвертичная структура белка — относится к макромолекулам, в состав которых входит несколько полипептидных цепей (субъединиц), не
- 12. Белки – амфотерные электролиты. При определенном значении pH среды число положительных и отрицательных зарядов в молекуле
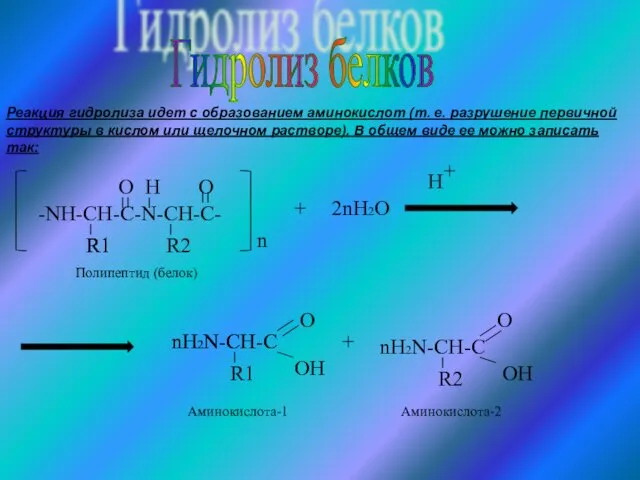
- 13. Гидролиз белков -NH-CH-C-N-CH-C- R1 O H R2 O n + 2nH2O H + nH2N-CH-C R1 OH
- 14. Химический синтез Химический синтез белков имеет большое практическое и теоретическое значение. В практическом отношении важны белковые
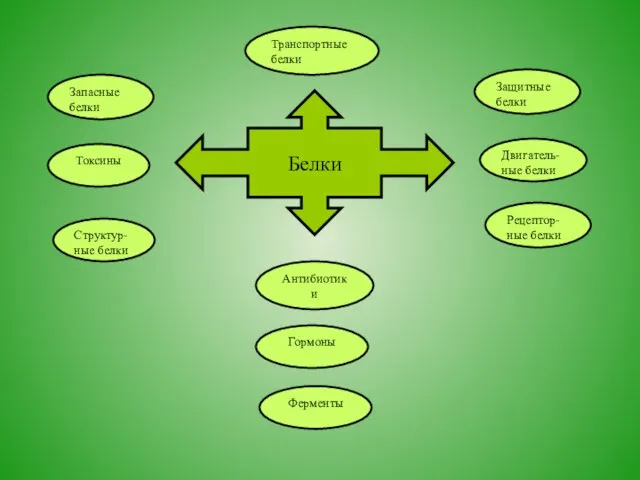
- 15. Ферменты Защитные белки Двигатель- ные белки Структур- ные белки Запасные белки Антибиотики Рецептор-ные белки Гормоны Токсины
- 17. Скачать презентацию








 Диалог культуры в мире
Диалог культуры в мире Рынок рабочей силы в постсоциалистических странах
Рынок рабочей силы в постсоциалистических странах СТРАТЕГИЧЕСКИЕОРИЕНТИРЫ
СТРАТЕГИЧЕСКИЕОРИЕНТИРЫ Воротило Татьяна Георгиевна МСКОУ СКОШ г. Стрежевой
Воротило Татьяна Георгиевна МСКОУ СКОШ г. Стрежевой Фразеологические прозвища английских, американских и российских политиков
Фразеологические прозвища английских, американских и российских политиков Презентация на тему Зарубежный театр XX века
Презентация на тему Зарубежный театр XX века Русский язык в современном мире
Русский язык в современном мире Роль общественных организаций в деятельности министерства труда и социальной защиты населения Рязанской области
Роль общественных организаций в деятельности министерства труда и социальной защиты населения Рязанской области Ребусы по информатике
Ребусы по информатике Особенности планирования рекламных кампаний в Интернете
Особенности планирования рекламных кампаний в Интернете СВЯТАЯ ВЕЛИКОМУЧЕНИЦА ЕКАТЕРИНА
СВЯТАЯ ВЕЛИКОМУЧЕНИЦА ЕКАТЕРИНА Образ солнца в русской поэзии
Образ солнца в русской поэзии Школьное методическое объединение учителей русского языка и литературыпредставляеттворческий отчет.
Школьное методическое объединение учителей русского языка и литературыпредставляеттворческий отчет. Стволовые клетки растений. 3 stem cell series
Стволовые клетки растений. 3 stem cell series Актуальность, проблемы и перспективы развития профессионального признания в России Владивосток 2011
Актуальность, проблемы и перспективы развития профессионального признания в России Владивосток 2011 Плановое повышение квалификации работников общего образования
Плановое повышение квалификации работников общего образования загадки о животных
загадки о животных Онтология государства и права
Онтология государства и права Памятка пешеходу
Памятка пешеходу Трудности обучения письму и чтению в начальной школе
Трудности обучения письму и чтению в начальной школе ЭНЕРГОСБЕРЕЖЕНИЕ
ЭНЕРГОСБЕРЕЖЕНИЕ Ежемесячная выплата на ребенка в возрасте от 3 до 7 лет. Перечень документов
Ежемесячная выплата на ребенка в возрасте от 3 до 7 лет. Перечень документов Как написать введение для курсовой работы
Как написать введение для курсовой работы Словарные слова по теме «Экскурсия» 4 класс
Словарные слова по теме «Экскурсия» 4 класс Тест Подготовка к ЕГЭ по физике Часть А
Тест Подготовка к ЕГЭ по физике Часть А От индустриального общества к информационному
От индустриального общества к информационному Выставка – всегда волнительно, особенно если Вы участвуете впервые. Важно – ярко заявить о себе. На выставке о Вашей компании гово
Выставка – всегда волнительно, особенно если Вы участвуете впервые. Важно – ярко заявить о себе. На выставке о Вашей компании гово Moscow на английском
Moscow на английском