Содержание
- 2. ЦЕЛЬ УРОКА изучить химические свойства солей угольной кислоты – карбонатов и гидрокарбонатов; приобрести навыки в решении
- 3. Тест – экспресс 1) Электронная конфигурация атома углерода? 2) Разновидности простого вещества, образованные одним и тем
- 4. ОТВЕТЫ 1) Аллотропные видоизменения 2) 1s22s22p 3) Четыре 4) Метан СН4, силан SiH4 5) ЭО2 6)
- 5. Фокус-покус для народа: Стоит лишь подуть сквозь воду, Как она легко-легко Превратиться в молоко! СО2 +
- 6. Действие сильной кислоты может служить качественной реакцией на карбонаты: СаСО3 + 2Н+ ↔ Са2+ + Н2О
- 7. Как можно собрать СО2 М(воздуха)=29, т.е. СО2 тяжелее воздуха Метод вытеснения воды невозможен из-за протекания реакции:
- 8. Угольная кислота диссоциирует ступенчато: 1.H2CO3 ↔ Н+ + HCO3- 2. HCO3- ↔ Н+ + CO32-
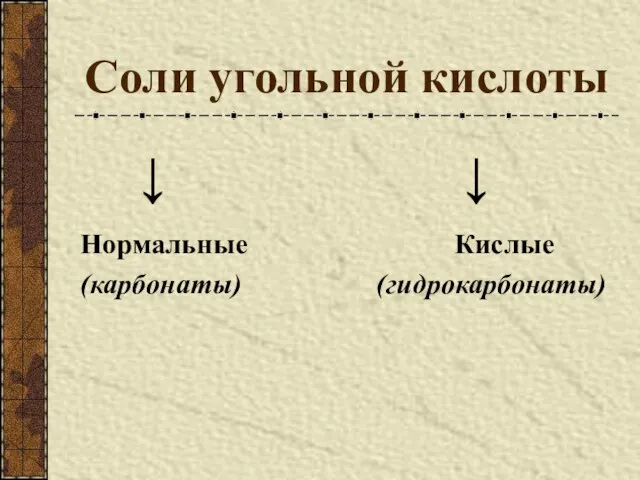
- 9. Соли угольной кислоты ↓ ↓ Нормальные Кислые (карбонаты) (гидрокарбонаты)
- 10. Свойства солей: СО2 + Са(ОН)2 ? СаСО3↓ + Н2О СаСО3 + Н2О + СО2 ? Са(НСО3)2
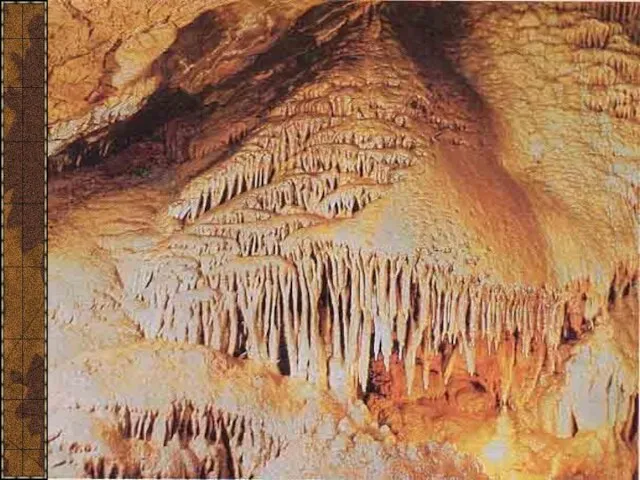
- 11. Красная пещера, или Кизил-Коба, самая крупная из 800 пещер Крыма. Она расположена в 3,5 км от
- 12. Сталагмиты
- 13. Сталактит «Пузатый»
- 14. Сталактит «Огненный»
- 18. Изучением карстовых пещер занимается наука – спелеология
- 19. Соли угольной кислоты: Мрамор, известняк, мел – СаСО3 На земле живут три брата Из семейства Карбонатов.
- 20. Доломит CaCO3. MgCO3 – обычно содержит глины и известняки, применяется для получения извести, солей магния, как
- 21. Сидерит FeCO3 – минерал бурого цвета, служит рудой для получения железа. Кальцинированная сода Na2CO3 – белый
- 22. Презентация разработки темы в курсе 9 класса. Подготовила учитель химии ОГРИНА СВЕТЛАНА ЮРЬЕВНА
- 24. Скачать презентацию



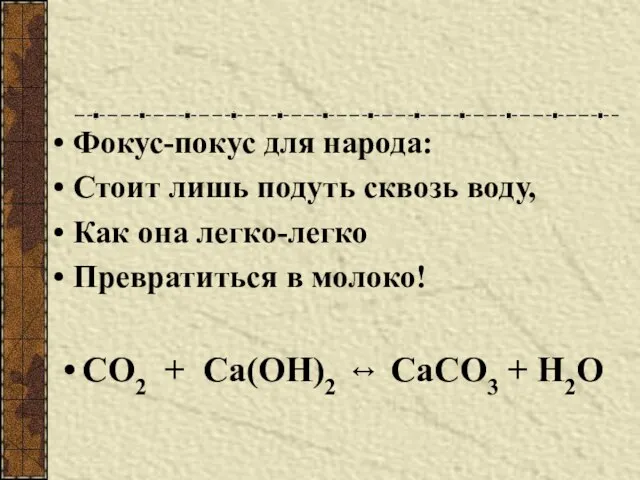


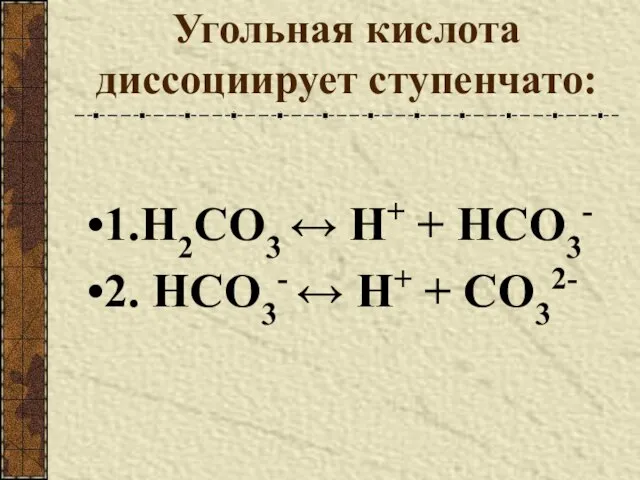
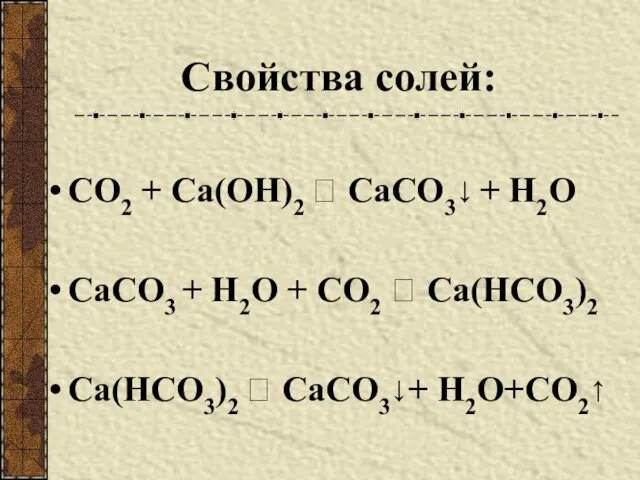











 Автотуризм лекция
Автотуризм лекция Можно ли сказать, что производство – это, прежде всего процесс создания материальных благ?
Можно ли сказать, что производство – это, прежде всего процесс создания материальных благ? Сосуды шеи и головы
Сосуды шеи и головы Глаза - окно в окружающий мир
Глаза - окно в окружающий мир Школенко Юлия Вадимовна, учитель русского языка и литературы высшей квалификационной категории гимназии «Интеллект» г. Ессе
Школенко Юлия Вадимовна, учитель русского языка и литературы высшей квалификационной категории гимназии «Интеллект» г. Ессе Фигурное катание
Фигурное катание МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Факультет радиофизики и электроники Кафе
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ Факультет радиофизики и электроники Кафе Лекция ЭТ 22 - 1 нов
Лекция ЭТ 22 - 1 нов Военная ипотека. Рефинансирование военной ипотеки
Военная ипотека. Рефинансирование военной ипотеки Окружные ресурсные центры (ОРЦ) реализации и мониторинга региональных программ совершенствования питания в образовательных учре
Окружные ресурсные центры (ОРЦ) реализации и мониторинга региональных программ совершенствования питания в образовательных учре Сечения и разрезы
Сечения и разрезы Пунктуация в сложноподчинённом предложении
Пунктуация в сложноподчинённом предложении Системы солнечного тепло- и хладо- снабжения
Системы солнечного тепло- и хладо- снабжения Вредные привычки.
Вредные привычки. Реализация программы для игры в покер Студент: Строков С. В. Научный руководитель: Пильщиков В. Н.
Реализация программы для игры в покер Студент: Строков С. В. Научный руководитель: Пильщиков В. Н. Sorghum Broom Catalogue
Sorghum Broom Catalogue Мониторинг достижения детьми 3-4 лет планируемых результатов освоения основной общеобразовательной программы дошкольного образо
Мониторинг достижения детьми 3-4 лет планируемых результатов освоения основной общеобразовательной программы дошкольного образо Спирты, они же – алкоголи
Спирты, они же – алкоголи magistri
magistri 3
3 Сущность жизни. Свойства живого. Уровни организации живой природы
Сущность жизни. Свойства живого. Уровни организации живой природы Синергия социального духа
Синергия социального духа Презентация История Экономической мысли 2
Презентация История Экономической мысли 2 Презентация на тему Строение и функции пищеварительной системы
Презентация на тему Строение и функции пищеварительной системы Юридическая ответственность
Юридическая ответственность Презентация на тему Органы чувств
Презентация на тему Органы чувств  Бизнес-план
Бизнес-план Презентация на тему Оленеводство
Презентация на тему Оленеводство