Содержание
- 2. Термин «информационные технологии» подразумевает использование компьютеров как новых средств подготовки, диагностики, контроля и обучения предметам. Они
- 3. Применение компьютера при обучении химии в школе целесообразно в тех случаях, когда обычных средств обучения уже
- 4. Медиа- лекции: «Углерод. Аллотропия.» (9 класс) «Природные источники углеводородов» (10 класс) «Белки, их строение и свойства»
- 5. Уроки комбинированного типа: «Алюминий и его соединения»(9 класс) «Многоатомные спирты» (10 класс) «Качественные реакции в органической
- 6. Результаты ЕГЭ: 2003-2004 учебный год Оценка «5» - 2 ученика Оценка «4» - 6 учеников 2004-2005
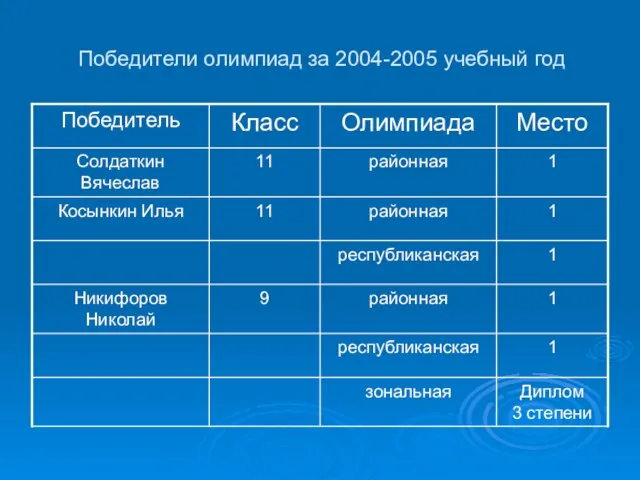
- 7. Победители олимпиад за 2004-2005 учебный год
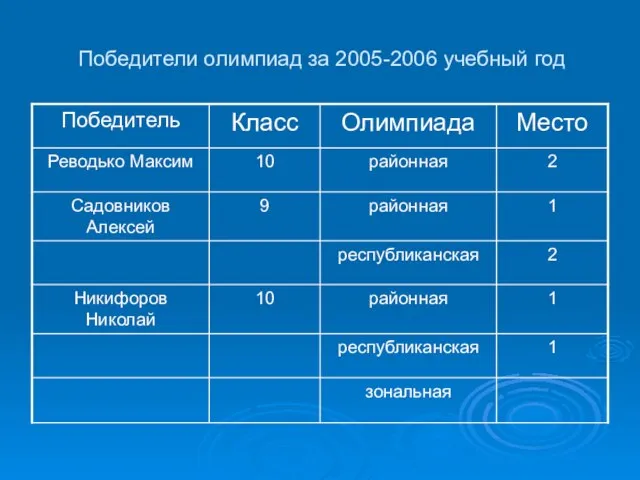
- 8. Победители олимпиад за 2005-2006 учебный год
- 9. NH3 + H2O = NH4+ + OH - HF + H2O = F - + H30
- 10. 1. Катион – это: а) ион меди; б) атом серы; в) ион серы; г) атом меди.
- 11. 1. Катион – это: а) ион меди; б) атом серы; в) ион серы; г) атом меди.
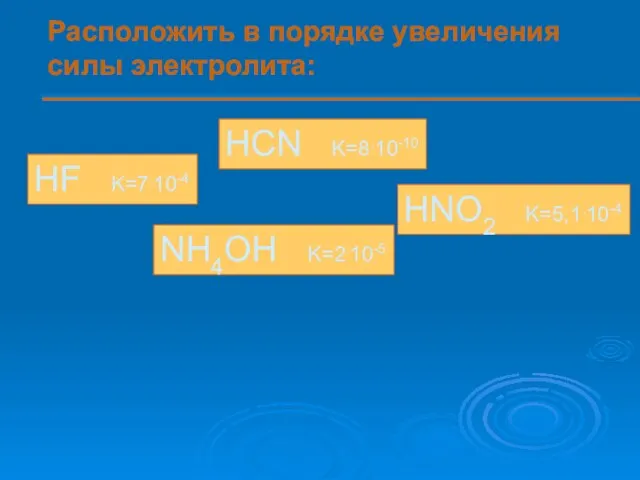
- 12. Расположить в порядке увеличения силы электролита: HF K=7.10-4 HCN K=8.10-10 HNO2 K=5,1.10-4 NH4OH K=2.10-5
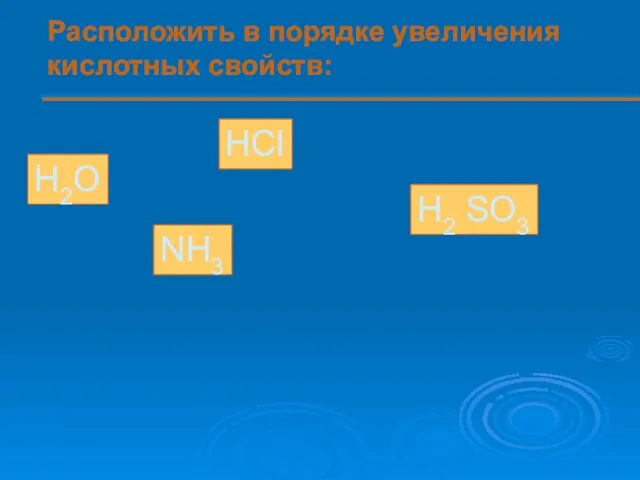
- 13. Расположить в порядке увеличения кислотных свойств: H2O HCl H2 SO3 NH3
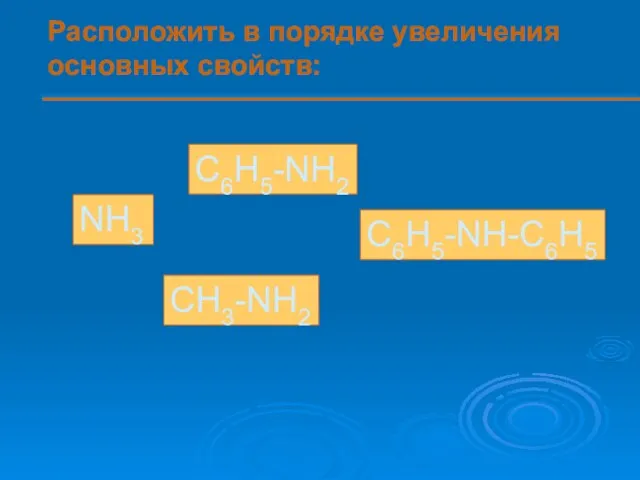
- 14. Расположить в порядке увеличения основных свойств: NH3 C6H5-NH2 C6H5-NH-C6H5 CH3-NH2
- 15. Укажи, допущены ли ошибки в тексте: 1. На процесс диссоциации влияет растворение или расплавление вещества. 2.
- 16. Укажи, допущены ли ошибки в тексте: 1. На процесс диссоциации влияет растворение или расплавление вещества. 2.
- 18. Скачать презентацию










 Составные условия в разветвляющихся алгоритмах © М.Е.Макарова http://www.uchinfo.com.ua http://www.uchinfo.com.ua. - презентация
Составные условия в разветвляющихся алгоритмах © М.Е.Макарова http://www.uchinfo.com.ua http://www.uchinfo.com.ua. - презентация Памятники Всемирного природного и культурного наследия
Памятники Всемирного природного и культурного наследия О КОМПАНИИ
О КОМПАНИИ Цели Формирование духового мира современной молодежи
Цели Формирование духового мира современной молодежи Birds
Birds Презентация на тему Франция после Первой Мировой Войны
Презентация на тему Франция после Первой Мировой Войны Шаблоны для уроков русский язык и литература 2
Шаблоны для уроков русский язык и литература 2 Компьютер и здоровье
Компьютер и здоровье Модели описания конфликта
Модели описания конфликта Развитие АСЦ Abat в РФ
Развитие АСЦ Abat в РФ Типы диагностических методик
Типы диагностических методик Олимпийские интеллектуальные игры
Олимпийские интеллектуальные игры Конкурс проектов lingua latina per se illustrata. Гуманитарный факультет
Конкурс проектов lingua latina per se illustrata. Гуманитарный факультет Perfect passive
Perfect passive Презентация на тему bmw
Презентация на тему bmw  Развитие птиц. Для детей
Развитие птиц. Для детей Характеристика фитнеса, как современного явления в физической культуре
Характеристика фитнеса, как современного явления в физической культуре Orientaciones generales Matrícula 2019-2020
Orientaciones generales Matrícula 2019-2020 Промышленное оборудование и комплексная автоматизация
Промышленное оборудование и комплексная автоматизация Животные Пермского края
Животные Пермского края Математика на службе армии (урок в 9 классе)
Математика на службе армии (урок в 9 классе) Проблема гендерного насилия в контексте гендерной политики в Германии
Проблема гендерного насилия в контексте гендерной политики в Германии Природа власти ее виды и источники
Природа власти ее виды и источники Что такое Хангыль ?
Что такое Хангыль ? Конструктивные решения промышленных зданий. Несущие и ограждающие конструкции промышленных зданий
Конструктивные решения промышленных зданий. Несущие и ограждающие конструкции промышленных зданий 10-13 апреля 2006 г. Украина, Киев Вторая международная выставка
10-13 апреля 2006 г. Украина, Киев Вторая международная выставка Русские ремесла. По трудовому обучению
Русские ремесла. По трудовому обучению Презентация на тему Школа безопасности
Презентация на тему Школа безопасности