Содержание
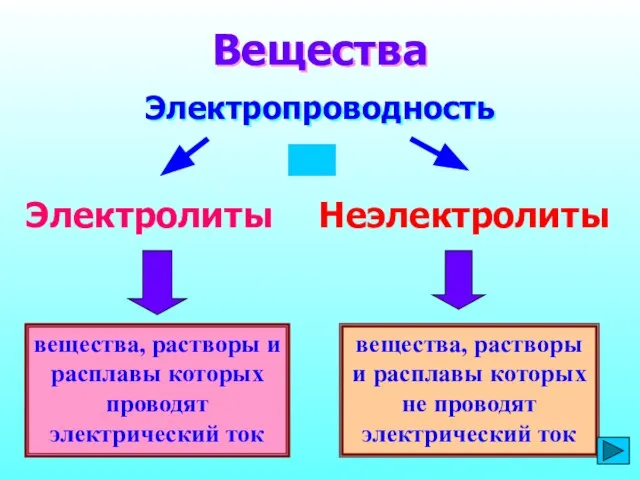
- 2. вещества, растворы и расплавы которых проводят электрический ток Вещества Электропроводность Электролиты Неэлектролиты вещества, растворы и расплавы
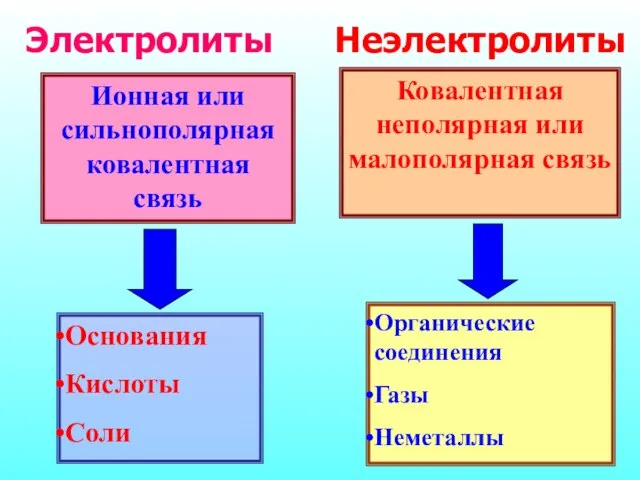
- 4. Ионная или сильнополярная ковалентная связь Основания Кислоты Соли Ковалентная неполярная или малополярная связь Органические соединения Газы
- 5. Теория электролитической диссоциации С. А. Аррениус (1859-1927) процесс растворения электролитов сопровождается образованием заряженных частиц, способных проводить
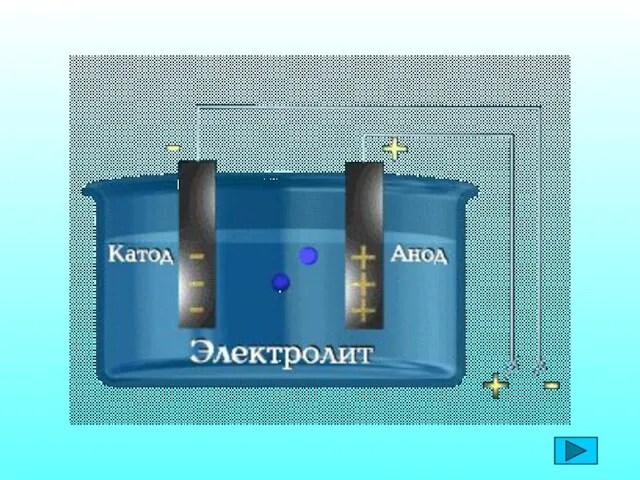
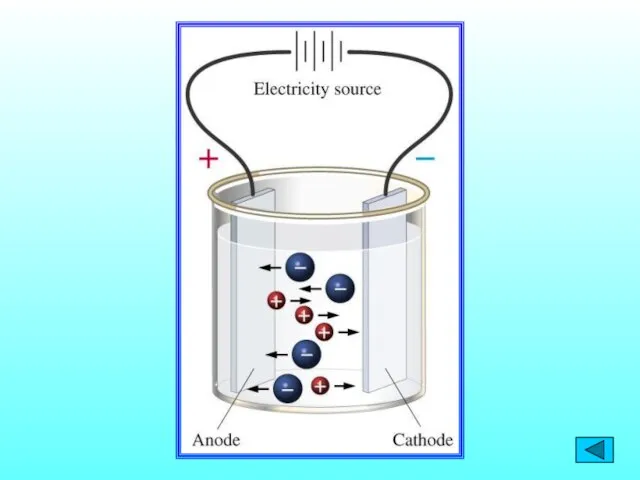
- 6. 1. Электролиты при растворении в воде распадаются на положительные и отрицательно заряженные ионы – электролитическая диссоциация.
- 9. Причины распада вещества на ионы в расплавах Нагревание усиливает колебания ионов в узлах кристаллической решётки -кристаллическая
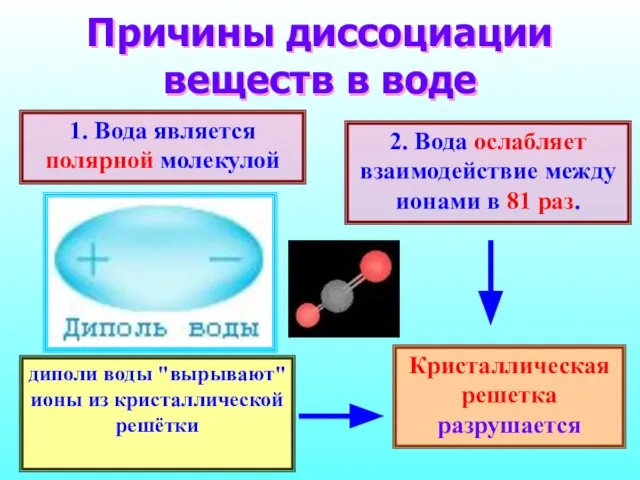
- 10. Причины диссоциации веществ в воде 1. Вода является полярной молекулой 2. Вода ослабляет взаимодействие между ионами
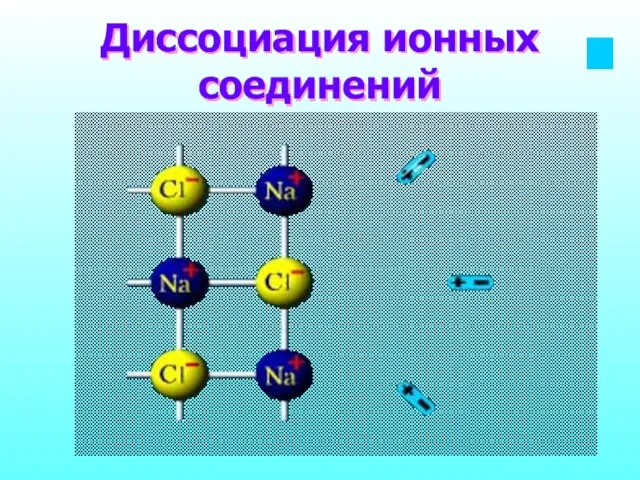
- 11. Диссоциация ионных соединений
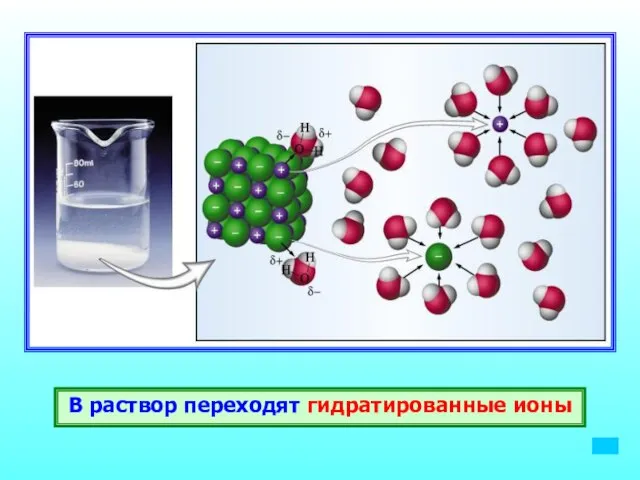
- 12. В раствор переходят гидратированные ионы
- 13. Диссоциация соединений с КП связью
- 14. Образование в результате распада электролитов гидратированных ионов отражается при написании уравнений диссоциации, однако, чаще эти уравнения
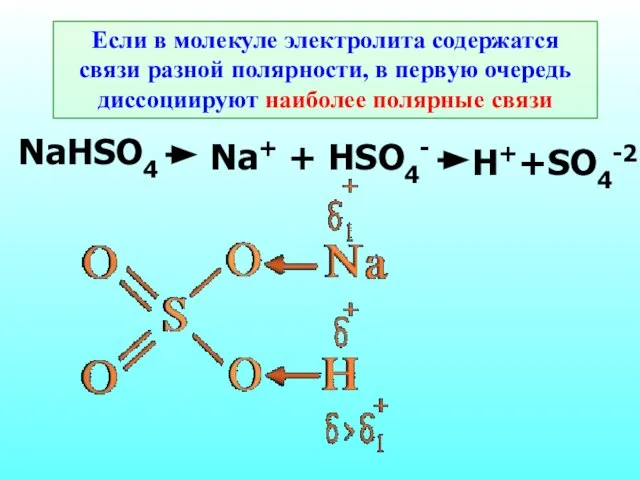
- 15. Если в молекуле электролита содержатся связи разной полярности, в первую очередь диссоциируют наиболее полярные связи NaHSO4
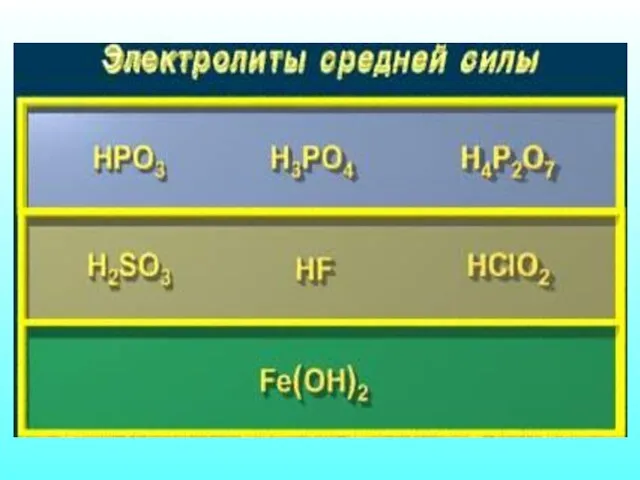
- 16. Количественная характеристика процесса диссоциации Отношение числа распавшихся молекул к общему числу молекул в растворе Сила электролита
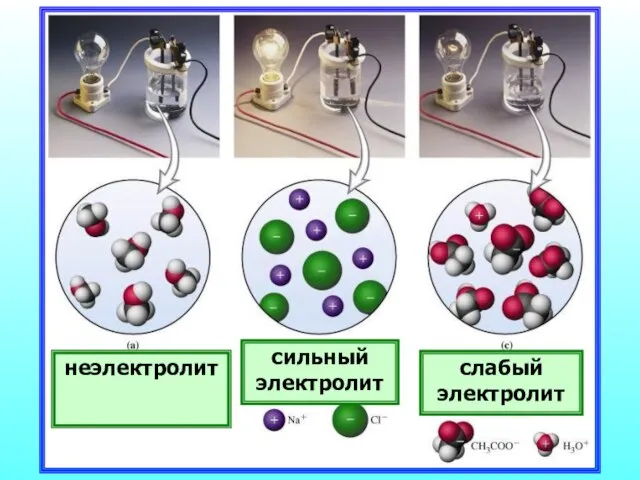
- 18. неэлектролит сильный электролит слабый электролит
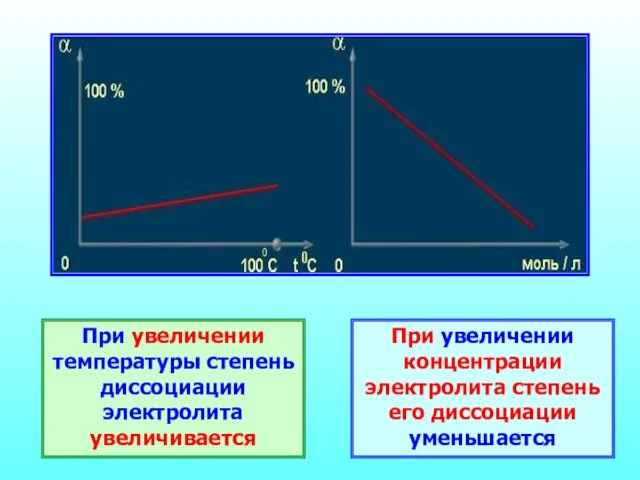
- 22. При увеличении температуры степень диссоциации электролита увеличивается При увеличении концентрации электролита степень его диссоциации уменьшается
- 23. Константа диссоциации Характеризует способность слабого электролита распадаться на ионы
- 25. Скачать презентацию











 Система Электронный кассир. Возможности применения в курьерских и транспортных службах
Система Электронный кассир. Возможности применения в курьерских и транспортных службах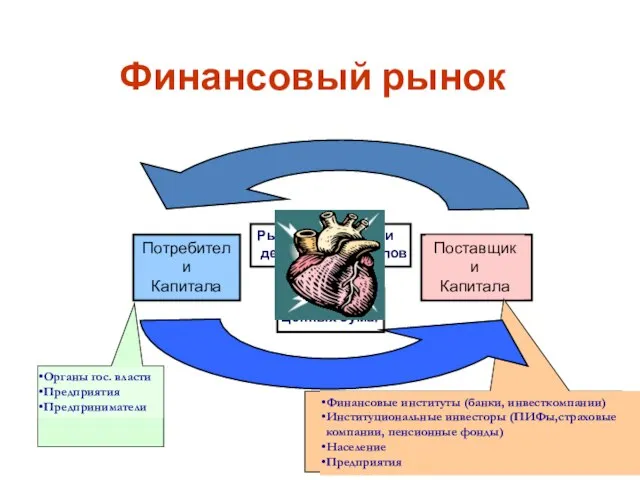 Финансовый рынок
Финансовый рынок Нумерация чисел в пределах 20
Нумерация чисел в пределах 20 Мы
Мы Стандартизация воспитательной деятельности, качество воспитания и оценка эффективности деятельности классного руководителя
Стандартизация воспитательной деятельности, качество воспитания и оценка эффективности деятельности классного руководителя Презентация на тему Культура России XVIII века
Презентация на тему Культура России XVIII века  О компании
О компании Анализ изменений предпочтений и требований клиентов ПОКУПАТЕЛИ И АРЕНДАТОРЫ Уменьшение количества покупателей и арендаторов в п
Анализ изменений предпочтений и требований клиентов ПОКУПАТЕЛИ И АРЕНДАТОРЫ Уменьшение количества покупателей и арендаторов в п Пионерская Карелия
Пионерская Карелия Генерал М. Тучков
Генерал М. Тучков Учебный курс«Человеко-центрированное проектирование ПО»
Учебный курс«Человеко-центрированное проектирование ПО» Областной конкурс «Новогодний переполох»
Областной конкурс «Новогодний переполох» Невропатология
Невропатология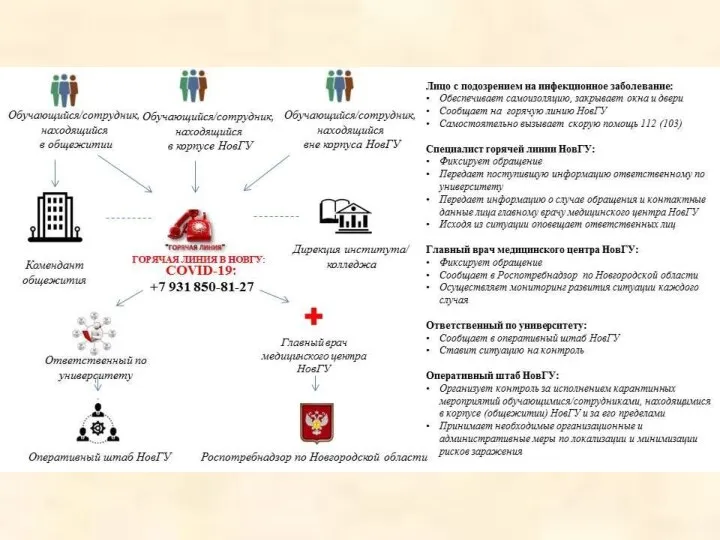 Презентация1
Презентация1 Презентация на тему Фернан Магеллан (8 класс)
Презентация на тему Фернан Магеллан (8 класс)  «1С:Ликероводочный и винный завод» отраслевое решение на базе «1С:Предприятие 8. Управление производственным предприятием»
«1С:Ликероводочный и винный завод» отраслевое решение на базе «1С:Предприятие 8. Управление производственным предприятием» Влияние среды на строение листа. Видоизменения листьев
Влияние среды на строение листа. Видоизменения листьев Организация и проведение семинара-практикума по проектной и исследовательской деятельности
Организация и проведение семинара-практикума по проектной и исследовательской деятельности Стать личностью
Стать личностью О том, как жили люди на Руси
О том, как жили люди на Руси chitalki-skorogovorki2
chitalki-skorogovorki2 Информация, которая не зависит от личного мнения или суждения, называется:
Информация, которая не зависит от личного мнения или суждения, называется: Современный стиль в одежде. Винтажный стиль
Современный стиль в одежде. Винтажный стиль Делийский султанат
Делийский султанат преза
преза Еврейский антифашистский комитет как сообщество памяти
Еврейский антифашистский комитет как сообщество памяти Сборное дорожное покрытие
Сборное дорожное покрытие Анализ современного урока
Анализ современного урока