Слайд 2
Простые вещества. Молекулы состоят из атомов одного вида (атомов одного элемента). В
химических реакциях не могут разлагаться с образованием других веществ.
Сложные вещества (или химические соединения). Молекулы состоят из атомов разного вида (атомов различных химических элементов). В химических реакциях разлагаются с образованием нескольких других веществ.
Неорганические вещества
Простые
Металлы
Неметаллы
Сложные
Оксиды
Основания
Кислоты
Соли
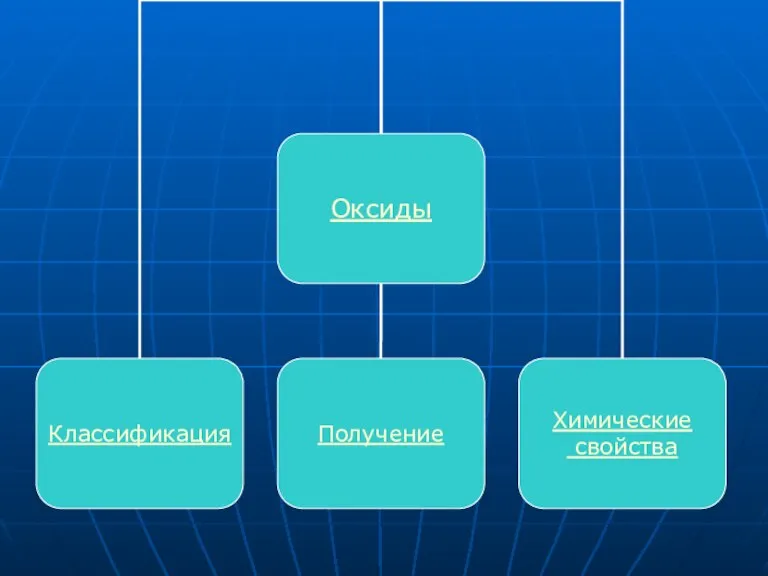
Слайд 4Оксиды - это сложные вещества, состоящие из двух элементов, один из которых

кислород.
Слайд 5ОКСИДЫ
Классификация
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых

кислород.
ОКСИДЫ
Несолеобразующие
CO, N2O, NO
Солеобразующие
Основные
-это оксиды металлов, в которых последние проявляют небольшую степень окисления +1, +2
Na2O; MgO; CuO
Амфотерные
(обычно для металлов со степенью окисления +3, +4). В качестве гидратов им соответствуют амфотерные гидроксиды
ZnO; Al2O3; Cr2O3; SnO2
Кислотные
-это оксиды неметаллов и металлов со степенью окисления от +5 до +7
SO2; SO3; P2O5; Mn2O7; CrO3
Основным оксидам соответствуют основания,
кислотным – кислоты,
амфотерным – и те и другие
Слайд 6Получение
1. Взаимодействие простых и сложных веществ с кислородом:
2Mg + O2 = 2MgO
4P

+ 5O2 =2P2O5
S + O2 = SO2
2CO + O2 =2CO2
2CuS + 3O2= 2CuO + 2SO2
CH4 + 2O2 = CO2 + 2H2O
4NH3 + 5O2 = 4NO + 6H2O
2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании:
Cu(OH)2 = CuO + H2O
(CuOH)2CO3 = 2CuO + CO2 + H2O
2Pb(NO3)2 = 2PbO + 4NO2 + O2
2HMnO4 = Mn2O7 + H2O
Слайд 7Химические свойства
Основные оксиды
1. Взаимодействие с водой
Образуется основание:Na2O + H2O =2NaOH
CaO + H2O

= Ca(OH)2
2. Взаимодействие с кислотой или основанием:
При реакции с кислотой образуется соль и вода
MgO + H2SO4 = MgSO4 + H2O
CuO + 2HCl = CuCl2 + H2O
Слайд 8Кислотные оксиды
1. Взаимодействие с водой
Образуется кислота:
SO3 + H2O =H2SO4
P2O5 + 3H2O =2H3PO4
2.

Взаимодействие с кислотой или основанием:
При реакции с основанием образуется соль и вода
CO2 + Ba(OH)2 = BaCO3 + H2O
SO2 + 2NaOH = Na2SO3 + H2O
Слайд 9Амфотерные оксиды
Амфотерные оксиды взаимодействуют
с кислотами как основные:
ZnO + H2SO4 =ZnSO4 + H2O
с

основаниями как кислотные:
ZnO + 2NaOH = Na2ZnO2 + H2O(ZnO + 2NaOH + H2O =Na2[Zn(OH)4])
3. Взаимодействие основных и кислотных оксидов между собой приводит к солям.Na2O + CO2 ® Na2CO34.
Восстановление до простых веществ:3CuO + 2NH3 = 3Cu + N2 + 3H2O
P2O5 + 5C = 2P + 5CO
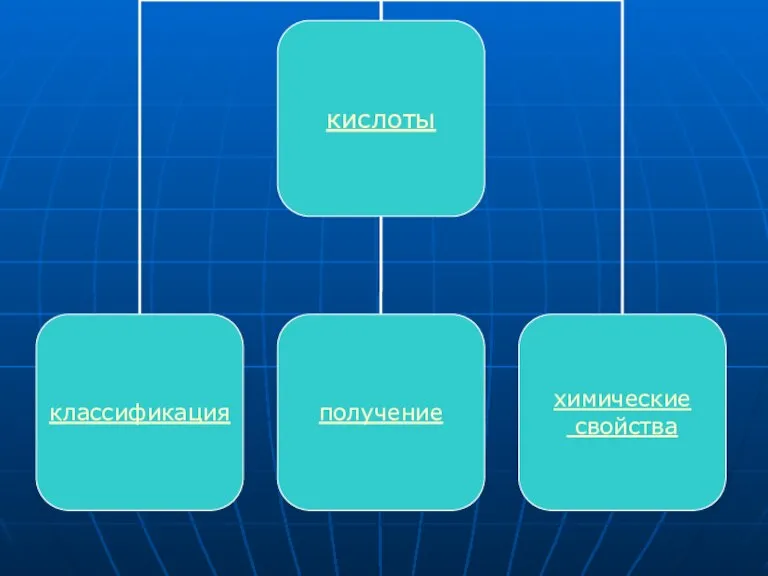
Слайд 11КИСЛОТЫ
Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. (С

точки зрения теории электролитической диссоциации: кислоты - электролиты, которые при диссоциации в качестве катионов образуют только H+).
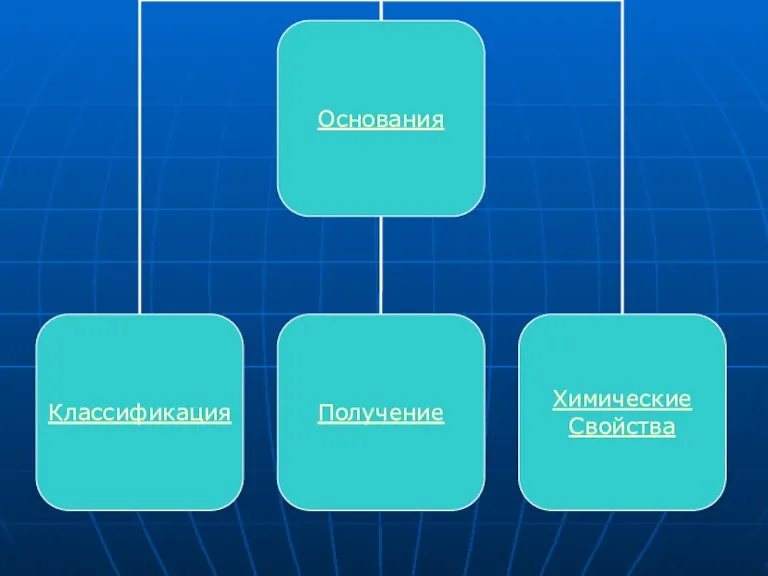
Слайд 13ОСНОВАНИЯ
Основания - сложные вещества, в которых атомы металлов соединены с одной или

несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид - анионы OH-).
Слайд 14Классификация.
Растворимые в воде (щёлочи) и нерастворимые.
Амфотерные основания проявляют также свойства слабых

кислот.
Слайд 16СОЛИ
Соли - сложные вещества, которые состоят из атомов металла и кислотных остатков.

Это наиболее многочисленный класс неорганических соединений.
Слайд 18ГЕНЕТИЧЕСКАЯ СВЯЗЬ
МЕЖДУ РАЗЛИЧНЫМИ
КЛАССАМИ
СОЕДИНЕНИЙ













 Как заставить покупные ссылки помогать, а не препятствовать продвижению сайта
Как заставить покупные ссылки помогать, а не препятствовать продвижению сайта Реформы Александра II
Реформы Александра II Статистика зачисления на программу бакалавриата (прямое поступление и переводные студенты) 2014-2019
Статистика зачисления на программу бакалавриата (прямое поступление и переводные студенты) 2014-2019 Презентация на тему Рейтинг самых востребованных профессий
Презентация на тему Рейтинг самых востребованных профессий Презентация на тему Здоровым быть модно
Презентация на тему Здоровым быть модно Политические режимы
Политические режимы Четырёхугольники
Четырёхугольники Правило буравчика и левой руки
Правило буравчика и левой руки Северный морской путь
Северный морской путь Презентация на тему « Создание и реализация проекта «Зеленый уголок»
Презентация на тему « Создание и реализация проекта «Зеленый уголок» Газовые законы (изопроцессы в газах)
Газовые законы (изопроцессы в газах) Отчет об исполнении бюджета внутригородского муниципального образования Санкт-Петербурга поселок Стрельна
Отчет об исполнении бюджета внутригородского муниципального образования Санкт-Петербурга поселок Стрельна Функционально-планировочная схема. Функциональные процессы архитектурных объектов в природном ландшафте
Функционально-планировочная схема. Функциональные процессы архитектурных объектов в природном ландшафте Решение задач по формулам
Решение задач по формулам Помощь по консервации и восстановлении храма Живоначальной Троицы в селе Пятино
Помощь по консервации и восстановлении храма Живоначальной Троицы в селе Пятино 11а 04.10
11а 04.10 КОЛЫБЕЛИ НАДЕЖДЫ:право на жизнь для новорожденных в Украине
КОЛЫБЕЛИ НАДЕЖДЫ:право на жизнь для новорожденных в Украине Защита прав потребителей
Защита прав потребителей Социальная защита государственных служащих. Льготы. Гарантии
Социальная защита государственных служащих. Льготы. Гарантии Разнообразие природы
Разнообразие природы Методическая разработка по физике по теме «Кинематика» 9 класс
Методическая разработка по физике по теме «Кинематика» 9 класс Деятельное долголетие
Деятельное долголетие Презентация на тему Музыкальная культура
Презентация на тему Музыкальная культура Технология приготовления кролика
Технология приготовления кролика Южный Федеральный Университет Факультет социологии и политологии Презентация лекции по семестровому курсу социологии Для бака
Южный Федеральный Университет Факультет социологии и политологии Презентация лекции по семестровому курсу социологии Для бака В. Ю. Драгунский
В. Ю. Драгунский Основы атрибуции искусства
Основы атрибуции искусства Храмы в искусстве
Храмы в искусстве