Содержание
- 2. В настоящее время мы являемся свидетелями разрушения архитектурных сооружений и конструкций. От кислотных дождей катастрофически страдают
- 3. Слово коррозия происходит от латинского corrodere, что означает разъедать. Коррозией называют самопроизвольный процесс разрушения материалов и
- 4. КОРРОЗИЯ - РЖАВАЯ КРЫСА, ГРЫЗЕТ МЕТАЛЛИЧЕСКИЙ ЛОМ, В ШЕФНЕР 4Fe + 6H2O + 3O2 = 4Fe(OH)3
- 5. Виды коррозии Химическая Электрохимическая
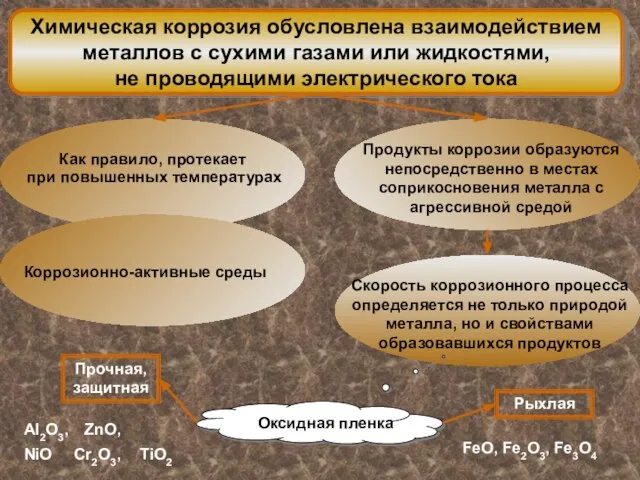
- 6. Химическая коррозия обусловлена взаимодействием металлов с сухими газами или жидкостями, не проводящими электрического тока Прочная, защитная
- 7. Электрохимическая коррозия осуществляется за счет электрохимических реакций, происходящих на поверхности металла, находящегося в контакте с раствором
- 9. Электрохимический ряд напряжений металлов Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni,
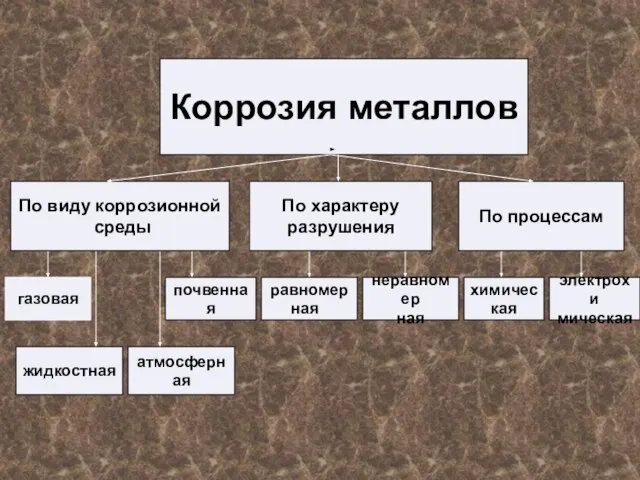
- 10. Коррозия металлов СПЛОШНАЯ МЕСТНАЯ не представляет особой опасности для конструкций и аппаратов особенно в тех случаях,
- 11. Коррозия металлов
- 12. Виды защиты от коррозии Протекторная Создание сплавов, стойких к коррозии Защита поверхности металла покрытиями Подавление влияния
- 16. Скачать презентацию











 Европейский рынок лизинга и перспективы развития лизинга в России
Европейский рынок лизинга и перспективы развития лизинга в России Аник Автоматизация. Эффективная работа
Аник Автоматизация. Эффективная работа Танцевальная группа Русские узоры в Международном фестивале Вуокса - река дружбы
Танцевальная группа Русские узоры в Международном фестивале Вуокса - река дружбы Verbi irregolari. Lezione 6-2
Verbi irregolari. Lezione 6-2 Великий круговорот жизни 3 класс
Великий круговорот жизни 3 класс Простое прошедшее время в английском
Простое прошедшее время в английском Devohki,vnimanie
Devohki,vnimanie Межличностные отношения в классном коллективе
Межличностные отношения в классном коллективе Национализм как политическая идеология
Национализм как политическая идеология Последовательное и параллельное соединения проводников
Последовательное и параллельное соединения проводников Проект Красная книга Бабочка -махаон
Проект Красная книга Бабочка -махаон Звери
Звери mon_cours_nouveau-ne_volet__2_copie_etud
mon_cours_nouveau-ne_volet__2_copie_etud Фосфор
Фосфор МОУ «СОШ № 56 г. Орск»Родительский всеобуч
МОУ «СОШ № 56 г. Орск»Родительский всеобуч Физическая сила. Виды силы
Физическая сила. Виды силы Радиоактивные превращения атомных ядер. Правила смещения
Радиоактивные превращения атомных ядер. Правила смещения Футбол. Тренажёр по английскому языку
Футбол. Тренажёр по английскому языку Презентация на тему Макраме
Презентация на тему Макраме Основная образовательная программаначального общего образования
Основная образовательная программаначального общего образования Компания объединенных кредитных карточек
Компания объединенных кредитных карточек Славный город мой Асбест
Славный город мой Асбест Sahul. Catalog
Sahul. Catalog От опорных конспектов – к алгоритмизации и компьютеризации
От опорных конспектов – к алгоритмизации и компьютеризации Психология деятельности специалиста по социальной работе по профилактике девиантного поведения подростков на основе анализа
Психология деятельности специалиста по социальной работе по профилактике девиантного поведения подростков на основе анализа Present Simple
Present Simple Классификация видов групп однородной продукции и их характеристики
Классификация видов групп однородной продукции и их характеристики Привет В зоопарке
Привет В зоопарке