Слайд 2Электролиз
- совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую систему,

состоящую из двух электродов и расплава или раствора электролита.
Слайд 3Электролиз расплава бромида свинца
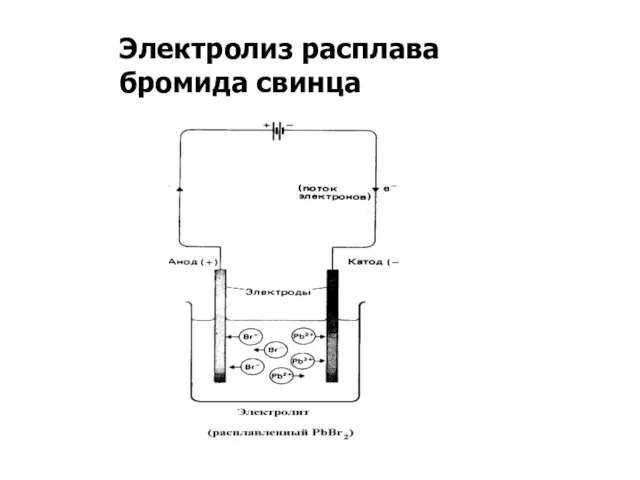
Слайд 4Процессы на электродах электролизера
Анод (+): окисление 2Br- - 2ē → Br2
Катод

(-): восстановление Pb2+ + 2ē → Pb
Слайд 5Особенности электролиза водных растворов
1. Имеется несколько типов частиц, которые могут окисляться на

аноде и восстанавливаться на катоде.
Пример:
Водный раствор хлорида натрия содержит анионы: Cl-, катионы: Na+, а также молекулы воды.
Какие частицы будут окисляться на аноде и восстанавливаться на катоде?
Слайд 6
Последовательность реакции на электродах различных ионов определяется:
1. Химической природой электродов
2. Окислительно-восстановитель-ным

(электродным) потенциалом реакции
Слайд 7
1. Инертные и активные электроды
Инертные электроды: Pt, графит в реакциях на электродах

не участвуют.
Активные электроды: Cu, Fe, Zn, Ni… принимают активное участие в реакциях.
Например, в нашем случае:
Анод (окисление): Сu - 2e = Cu2+
φо= +0,34 В
Слайд 82. Окислительно-восстановительный потенциал реакции (на инертном электроде)
А) На катоде сначала восстанавливаются частицы,

реакции которых соответствует больший окислительно-восстановительный (электродный) потенциал;
Слайд 9Решение
Принципиально возможно восстановление на катоде следующих частиц:
1. Na+ + ē → Na

φо1= -2,7 В
2. 2H2O + 2ē → H2+2OH- φо2= -0,83 В
Самый большой окислительно-восстановительный потенциал имеет 2 реакция. Поэтому на катоде будет восстанавливаться вода (реакция 2).
Слайд 10Б) На аноде сначала окисляются частицы, реакции которых соответствует меньший окислительно-восстановительный потенциал.
Сначала

восстанавливаются бескислородные анионы, затем вода, затем кислородсодержашие анионы.
Слайд 11В нашем примере принципиально возможно окисление на аноде следующих частиц:
1. 2H2О -

4ē → 4H+ + О2 φо1= +1,23 В
2. 2Cl- - 2ē → Cl2 φо2= +1,36 В
φо1< φо2 Следовательно на аноде должна окисляться вода, однако на большинстве электродов окисляются хлорид-ионы.
Это связано с явлением, которое называется перенапряжение.
Слайд 12 Перенапряжение
- добавочная по отношению к расчетной ЭДС, которую нужно приложить к
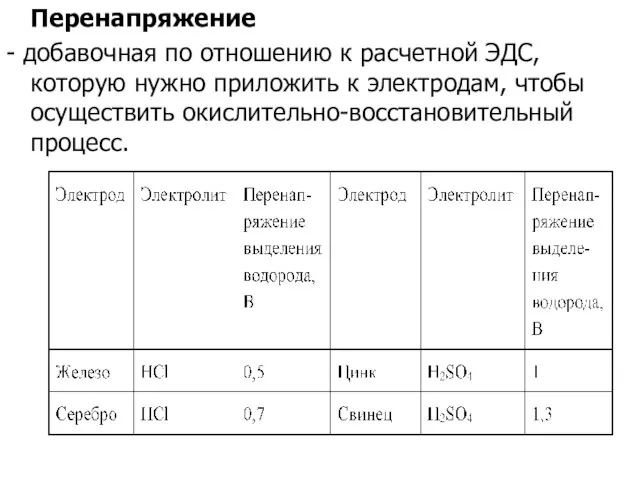
электродам, чтобы осуществить окислительно-восстановительный процесс.
Слайд 13
Законы Фарадея (1827)
1. Масса выделившегося на электроде вещества пропорциональна количеству электричества, прошедшего

через электролит.
2. Одинаковые количества электричества выделяют на электродах массы веществ, пропорциональные молярным массам их химических эквивалентов.
Слайд 14
Постоянная Фарадея
F = 96500 Кл/моль экв.
n экв(B) = Q/F= It/F
Q- количество

электричества, Кл
I - ток, А
t - время, с
m(B) = Mэкв n экв(B) = MэквIt/F
Слайд 15
Пример
Через расплавленный бромид свинца пропускали ток силой 2А в течение 30

минут.
Какая масса свинца выделилась?
Слайд 16Решение
Катод (-): восстановление Pb2+ + 2ē → Pb
Из уравнения: n(Pb)/n(ē) =

½
n(ē) = Q/F = It/F =
=2A·1800c/96500Kл/моль ē = 0,037 моль
n(Pb) = ½ ·0,037 моль= 0,0185 моль
m(Pb) = 0,0185 моль·207 г/моль = 3,83 г
Ответ: выделилось 3,83 г свинца
Слайд 17
Задача
Сколько времени нужно пропускать ток 10 А через раствор поваренной соли, чтобы

получить 44,8 л хлора (н.у.)?
Слайд 18Решение
Анод (-): окисление 2Сl- - 2ē → Cl2
n(Cl2) = 44,8 л

/22,4 л/моль = 2 моль
Из уравнения:
n(Cl2)/n(ē) = ½n(ē) n(ē) = 2 n(Cl2) = 4 моль
n(ē) = Q/F = It/F =
=10A·t c/96500Kл/моль ē = 4 моль
t c = 38600 c
Ответ: Ток следует пропускать 38600 c
Слайд 19Темы коротких сообщений
Современные ингибиторы коррозии: история создания, химический состав, области применения.

Протекторная защита и электрозащита металлов от коррозии: принцип действия, области применения.
Гальванопластика: история, принцип действия, области применения.
Использование электролиза для создания газовых смесей для дыхания под водой: электроланг А.Н. Лодыгина, системы жизнеобеспечения современных подводных лодок.


















 Hacemos una postal de Navidad
Hacemos una postal de Navidad Понятие локальной сети
Понятие локальной сети Метод сходства гистограмм и его применение
Метод сходства гистограмм и его применение Формы взаимодействия адвоката и следователя на предварительном следствии. Содействие и противодействие
Формы взаимодействия адвоката и следователя на предварительном следствии. Содействие и противодействие Особенности организации урока в условиях модернизации системы образования
Особенности организации урока в условиях модернизации системы образования Умурзаков Эрлан Менеджер по контекстной рекламе
Умурзаков Эрлан Менеджер по контекстной рекламе ЗППП
ЗППП Фрагмент урока
Фрагмент урока Застосування рідких кристалів
Застосування рідких кристалів Мой друг - велосипед
Мой друг - велосипед БУР для наставників
БУР для наставників Гражданское общество
Гражданское общество Презентация на тему Дисциплина - это...
Презентация на тему Дисциплина - это... Секреты эффективной презентации
Секреты эффективной презентации Машины для помола материалов. Струйные мельницы. (Лекция №4)
Машины для помола материалов. Струйные мельницы. (Лекция №4) Компания 1
Компания 1 Федоренко Павел Счастливая жизнь без панических атак и страхов
Федоренко Павел Счастливая жизнь без панических атак и страхов Пернатые изобретатели
Пернатые изобретатели Презентация на тему Действие магнитного поля на проводник с током
Презентация на тему Действие магнитного поля на проводник с током Эмоциональное развитие в младшей группе
Эмоциональное развитие в младшей группе Урок – игра Пирамида по теме Машиноведение
Урок – игра Пирамида по теме Машиноведение HelpExam
HelpExam О концепции развития ГОСУДАРСТВЕННОГО АВТОНОМНОГО НАУЧНОГО УЧРЕЖДЕНИЯ «ИНСТИТУТ РЕГИОНАЛЬНЫХ ИССЛЕДОВАНИЙ» АКАДЕМИИ НАУК РЕС
О концепции развития ГОСУДАРСТВЕННОГО АВТОНОМНОГО НАУЧНОГО УЧРЕЖДЕНИЯ «ИНСТИТУТ РЕГИОНАЛЬНЫХ ИССЛЕДОВАНИЙ» АКАДЕМИИ НАУК РЕС История деревни Порослово и судьбы ее жителей
История деревни Порослово и судьбы ее жителей Кислотные оксиды
Кислотные оксиды Загадки
Загадки ОСНОВНЫЕ ЦЕЛИ I.организация автоматизированного межведомственного информационного обмена, в том числе для предоставления госуда
ОСНОВНЫЕ ЦЕЛИ I.организация автоматизированного межведомственного информационного обмена, в том числе для предоставления госуда Аппаратура помехоустойчивого кодирования для систем дистанционного зондирования Земли и дальней космической связиThe equipment of noise
Аппаратура помехоустойчивого кодирования для систем дистанционного зондирования Земли и дальней космической связиThe equipment of noise