Содержание
- 2. Лекция 2 Характерные типы и энергетика связей металл-углерод Основные синтетические подходы к металлоорганическим соединениям
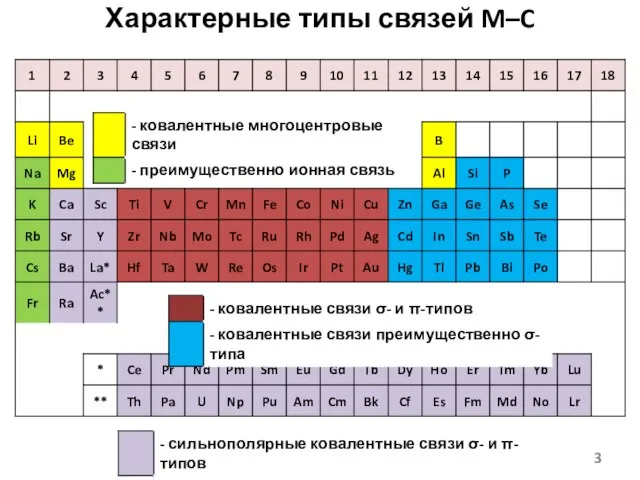
- 3. Характерные типы связей M–C
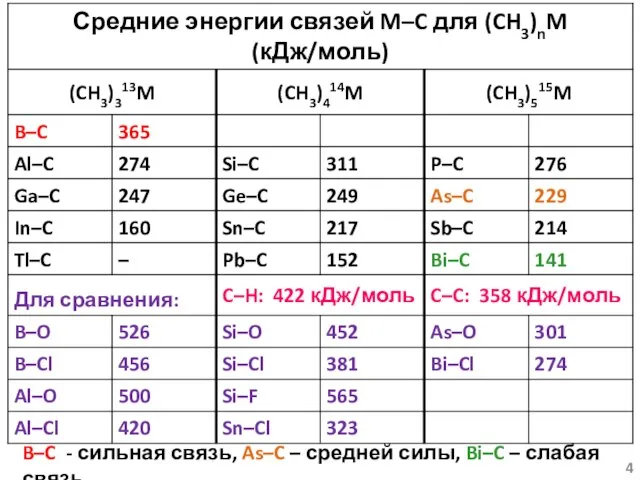
- 4. B–C - сильная связь, As–C – средней силы, Bi–C – слабая связь
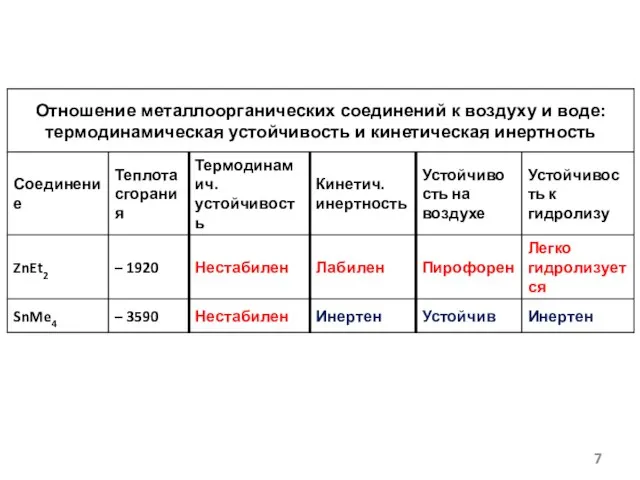
- 5. Условность величины средней энергии связи!!! (CH3)2Hg → CH3Hg∙ + CH3∙ D1(Hg – C) = 214 кДж/моль
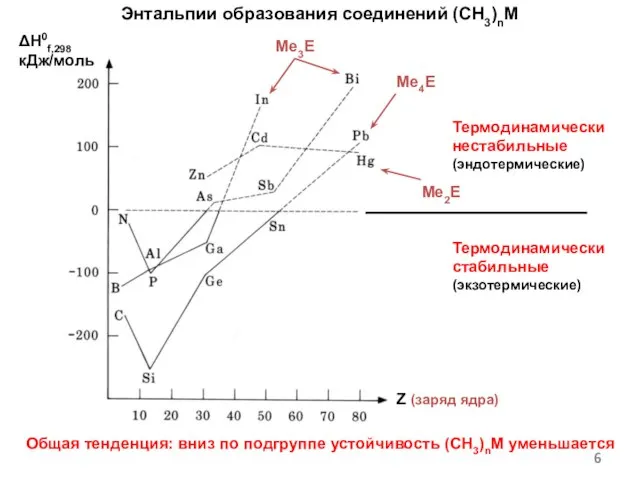
- 6. Энтальпии образования соединений (CH3)nM Общая тенденция: вниз по подгруппе устойчивость (CH3)nM уменьшается ΔH0f,298 кДж/моль Me3E Z
- 8. Обзор методов синтеза металлоорганических соединений (для металлов главных подгрупп)
- 9. Основа подхода – окисление металла галогенуглеводородами 2M + nRX → RnM + MXn↓ M0 – ne–
- 10. Подход [1], примеры Метод [1a] - «прямой синтез» - металл + галогенуглеводород 2Li + C4H9Br →
- 11. Метод [1б] - «смешаннометаллический» - смесь металла-восстановителя + металл, соединение которого вы хотите получить: 2Na +
- 12. Метод [1в] – окисление металлов в промежуточной степени окисления: PbI2 + CH3I → (CH3)PbI3 Подход [1],
- 13. Трансметаллирование (подход [2]) Основа подхода – восстановление металлоорганического соединения менее электроположительного металла более электроположительным M +
- 14. Обмен металлов (подход [3]) Основа подхода – вывод одного из продуктов в другую фазу (чаще, в
- 15. Метатезис (подход [4]) (нуклеофильное замещение галогена на R−) Движущая сила – образование галогенида электроположительного металла nRM
- 16. Замещение галогена на металл в реакции арилгалогенидов с алкиллитием (подход [5]) RLi + ArX → RX
- 17. Металлирование C–H кислот (подход [6]) Пример: Кислотно-основное равновесие. Образуется «соль» более сильной кислоты.
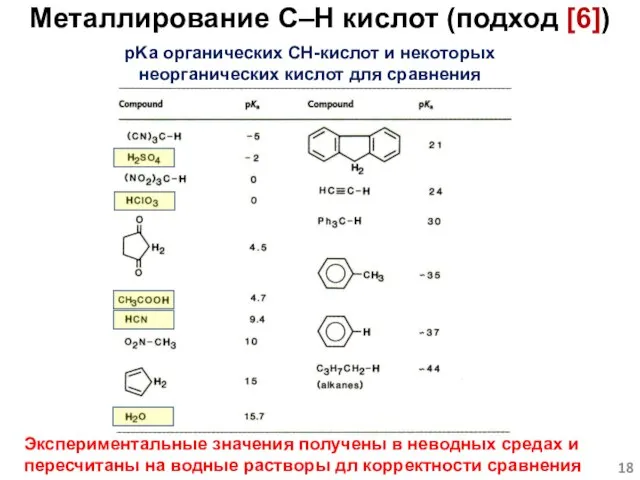
- 18. pKa органических CH-кислот и некоторых неорганических кислот для сравнения Экспериментальные значения получены в неводных средах и
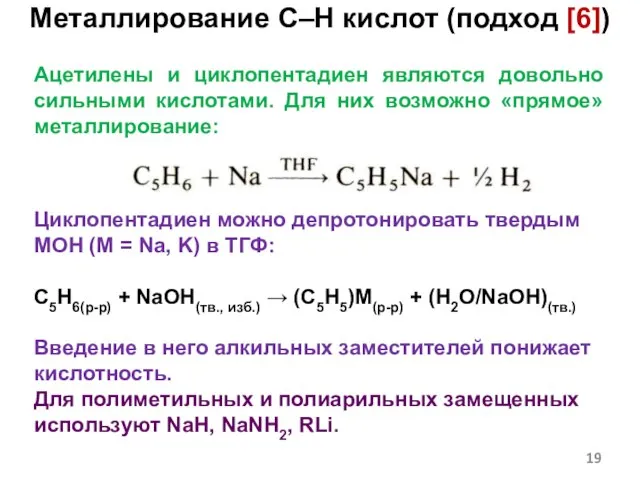
- 19. Ацетилены и циклопентадиен являются довольно сильными кислотами. Для них возможно «прямое» металлирование: Циклопентадиен можно депротонировать твердым
- 20. Металлирование C–H кислот (подход [6]) Возможные проблемы: в некоторых случаях депротонирование в органических средах чрезвычайно заторможено!
- 21. Меркурирование C–H кислот (подход [7]) (особый случай металлирования!) Первая стадия – легко, вторая требует более жестких
- 22. Гидрометаллирование (подход [8]) Пример: Способность к присоединению увеличивается в ряду:
- 23. Карбометаллирование (подход [9]) Аналогично гидрометаллированию, но с присоединением углеводородного радикала. Пример: Только для щелочных металлов и
- 24. Внедрение карбенов (подход [10]) Примеры: Обычно карбены внедряются по связи M–H и M–X, внедрение по связи
- 25. Декарбоксилирование (подход [11]) Примеры: Важно!!! Радикалы R должны быть сильноакцепторными: C6F5, CF3, CCl3, и т.п. Металлоорганические
- 27. Скачать презентацию




![Подход [1], примеры Метод [1a] - «прямой синтез» - металл + галогенуглеводород](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362072/slide-9.jpg)
![Метод [1б] - «смешаннометаллический» - смесь металла-восстановителя + металл, соединение которого вы](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362072/slide-10.jpg)
![Метод [1в] – окисление металлов в промежуточной степени окисления: PbI2 + CH3I](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362072/slide-11.jpg)
![Трансметаллирование (подход [2]) Основа подхода – восстановление металлоорганического соединения менее электроположительного металла](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362072/slide-12.jpg)
![Обмен металлов (подход [3]) Основа подхода – вывод одного из продуктов в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362072/slide-13.jpg)
![Метатезис (подход [4]) (нуклеофильное замещение галогена на R−) Движущая сила – образование](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362072/slide-14.jpg)
![Замещение галогена на металл в реакции арилгалогенидов с алкиллитием (подход [5]) RLi](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362072/slide-15.jpg)
![Металлирование C–H кислот (подход [6]) Пример: Кислотно-основное равновесие. Образуется «соль» более сильной кислоты.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362072/slide-16.jpg)
![Металлирование C–H кислот (подход [6]) Возможные проблемы: в некоторых случаях депротонирование в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362072/slide-19.jpg)
![Меркурирование C–H кислот (подход [7]) (особый случай металлирования!) Первая стадия – легко,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362072/slide-20.jpg)
![Гидрометаллирование (подход [8]) Пример: Способность к присоединению увеличивается в ряду:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362072/slide-21.jpg)
![Карбометаллирование (подход [9]) Аналогично гидрометаллированию, но с присоединением углеводородного радикала. Пример: Только](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362072/slide-22.jpg)
![Внедрение карбенов (подход [10]) Примеры: Обычно карбены внедряются по связи M–H и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362072/slide-23.jpg)
![Декарбоксилирование (подход [11]) Примеры: Важно!!! Радикалы R должны быть сильноакцепторными: C6F5, CF3,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/362072/slide-24.jpg)
 Право, его роль в жизни общества и государства
Право, его роль в жизни общества и государства Муравьи
Муравьи Правила игры Морской бой
Правила игры Морской бой КПСО и качество обучения
КПСО и качество обучения Молодежный кадровый центр
Молодежный кадровый центр Кошка. Оригами
Кошка. Оригами Россия сможет остановить коллапс всей системы авторского права?
Россия сможет остановить коллапс всей системы авторского права? Операционный автомат типа I
Операционный автомат типа I Группа компаний ERZIG
Группа компаний ERZIG 5
5 Государственное управление как система
Государственное управление как система Денежная реформа в России 1839—1843
Денежная реформа в России 1839—1843 История Коми Края
История Коми Края Weather and clothes
Weather and clothes Institut fur Slawistik der Karl-Franzens-Universitat GrazSE Sprachkultur: russkij recevoj etiket 515.504LV-Leiter: Branco TosovicSoSe 2010„Ты“ „Вы“Salicites
Institut fur Slawistik der Karl-Franzens-Universitat GrazSE Sprachkultur: russkij recevoj etiket 515.504LV-Leiter: Branco TosovicSoSe 2010„Ты“ „Вы“Salicites  ?????
????? Сурвивин
Сурвивин Tutkimustyön perusteet ja menetelmät THE7lh004
Tutkimustyön perusteet ja menetelmät THE7lh004 Стажировки в Дубае
Стажировки в Дубае Текстовая и графическая информация (2 класс)
Текстовая и графическая информация (2 класс) Особый вид стекла хрусталь
Особый вид стекла хрусталь Моральный выбор. Воспитание самого себя
Моральный выбор. Воспитание самого себя mir vokrug nas_02
mir vokrug nas_02 Роль электрических машин и трансформаторов в современной электротехнике и энергетике. лекция 1
Роль электрических машин и трансформаторов в современной электротехнике и энергетике. лекция 1 Вводная лекция
Вводная лекция The United Kingdom of Great Britain
The United Kingdom of Great Britain  Статус военнослужащего контингента миротворческих сил России
Статус военнослужащего контингента миротворческих сил России Презентация на тему Никола Тесла
Презентация на тему Никола Тесла