Содержание
- 2. Микориза – эволюционно сложившийся структурно оформленный симбиоз, необходимый для одного или обоих партнеров, между грибом и
- 3. Микориза : структура - модифицированная часть корня, заселенная грибом-микоризообразователем (= микоризное окончание) тип трофических взаимоотношений между
- 4. Арбускулярная микориза (АМ) Образуют: около 200 видов грибов ( отд. Glomeromycota), около 300 тыс. видов растений,
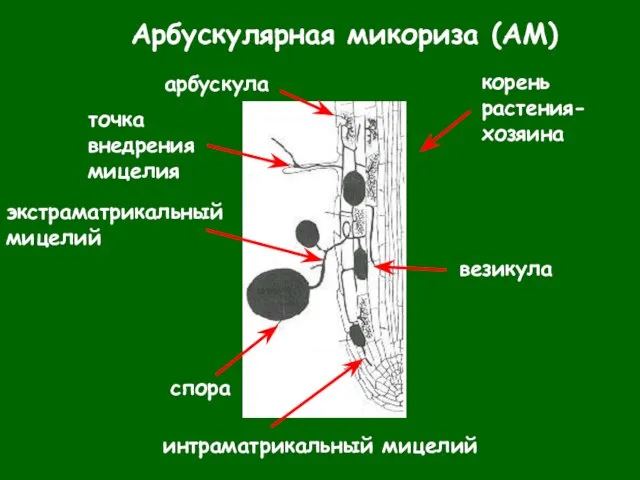
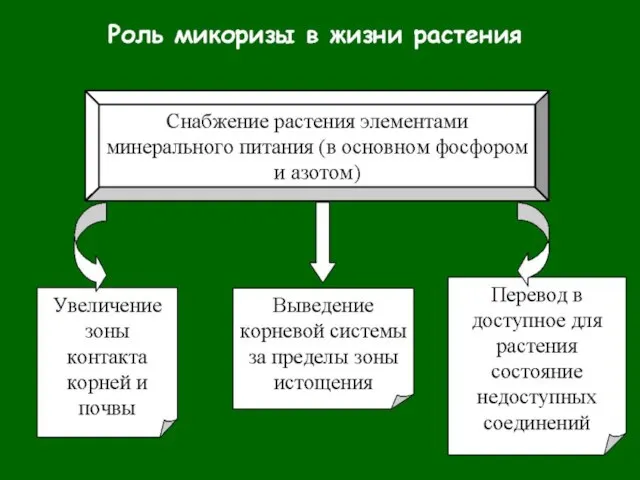
- 5. Арбускулярная микориза (АМ) везикулы - запасающие структуры внутри тканей растения - пропагулы, запасающие структуры на свободном
- 6. Арбускулярная микориза (АМ)
- 7. Типы микориз Эктомикориза Образуют: около 6 тыс. видов грибов (преимущественно Агарикоидные, отд. Basidiomycota, реже представители отд.
- 8. Эктомикориза (ЭМ) Характерны морфологические изменения корневой системы, заселенной микобионтом Чехол (М) – на поверхности корня, от
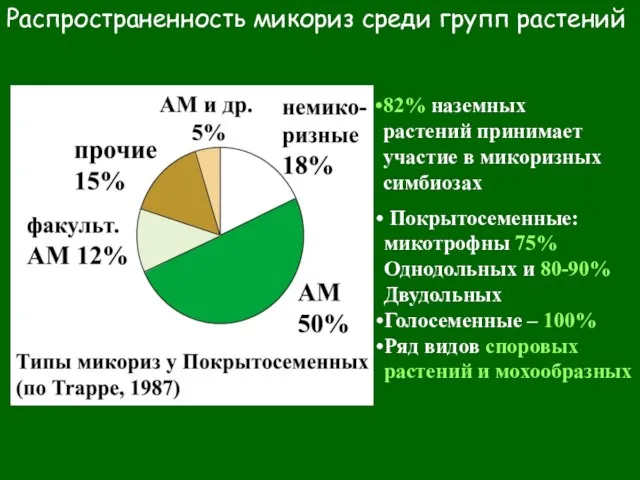
- 9. Распространенность микориз среди групп растений 82% наземных растений принимает участие в микоризных симбиозах Покрытосеменные: микотрофны 75%
- 16. История исследования микориз Каменский Франц Михайлович (1851 – 1913) 1881 – Die Vegetationsorgane der Monotropa hypopitys
- 17. История исследования микориз 1885 - А.Б. Франком введен термин «микориза» До 1920-х – преимущественно исследования анатомии
- 18. История исследования микориз В настоящее время исследования представлены следующими направлениями: Анализ отношений симбионтов на молекулярно-генетическом уровне,
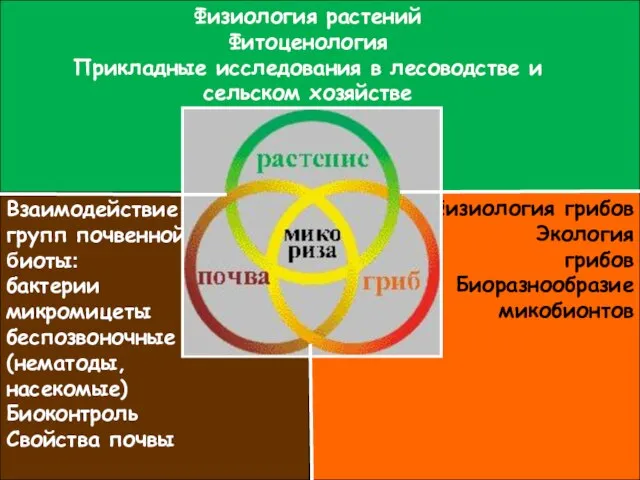
- 19. Физиология растений Фитоценология Прикладные исследования в лесоводстве и сельском хозяйстве
- 20. Отбор образцов арбускулярной микоризы для анализа У трав с мочковатыми корнями последние берут почти полностью. У
- 21. Отбор образцов эктомикоризы для анализа У сеянцев – отбор корневой системы целиком У взрослых деревьев –
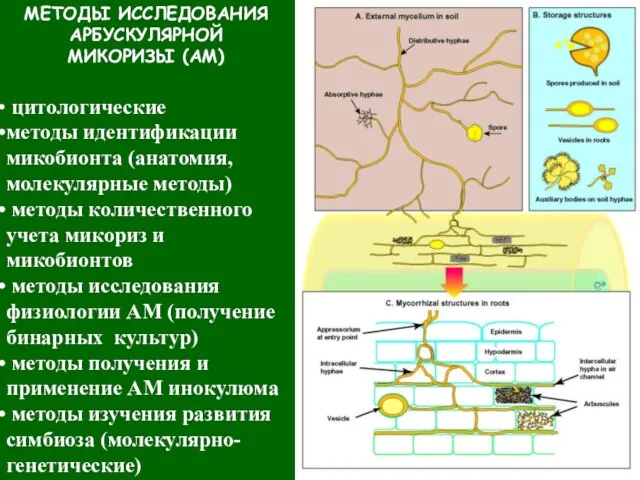
- 22. МЕТОДЫ ИССЛЕДОВАНИЯ АРБУСКУЛЯРНОЙ МИКОРИЗЫ (АМ) цитологические методы идентификации микобионта (анатомия, молекулярные методы) методы количественного учета микориз
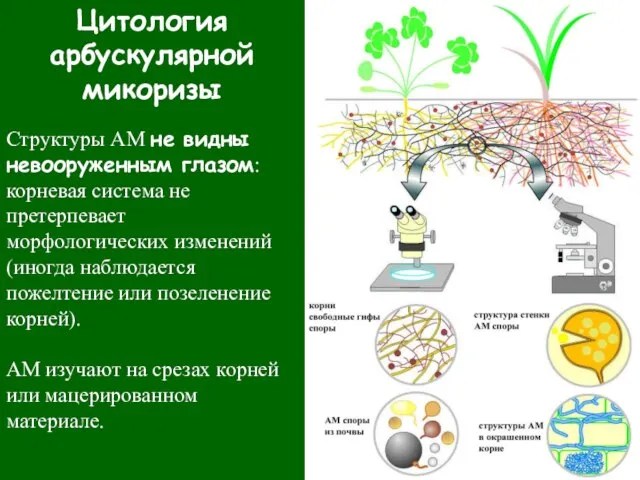
- 23. Цитология арбускулярной микоризы Структуры АМ не видны невооруженным глазом: корневая система не претерпевает морфологических изменений (иногда
- 24. Цитология арбускулярной микоризы Осветление корней в 10% р-ре КОН при нагревании (15-20 мин при 121°С в
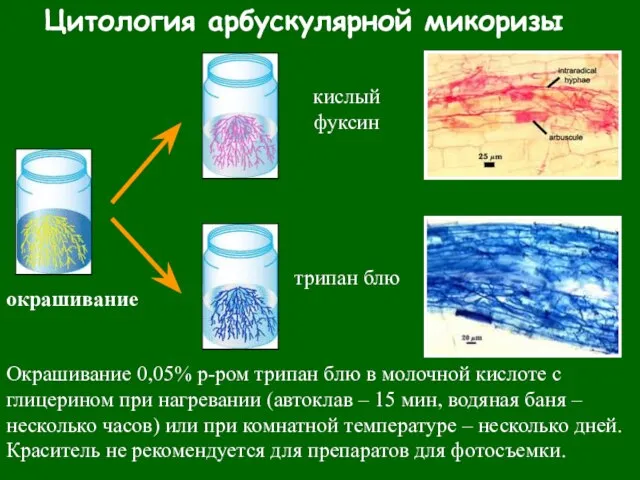
- 25. Цитология арбускулярной микоризы окрашивание кислый фуксин трипан блю Окрашивание 0,05% р-ром трипан блю в молочной кислоте
- 26. Цитология арбускулярной микоризы Прочие красители: Хлоразол черный Е (СВЕ) – 0,05% р-р в молочной кислоте с
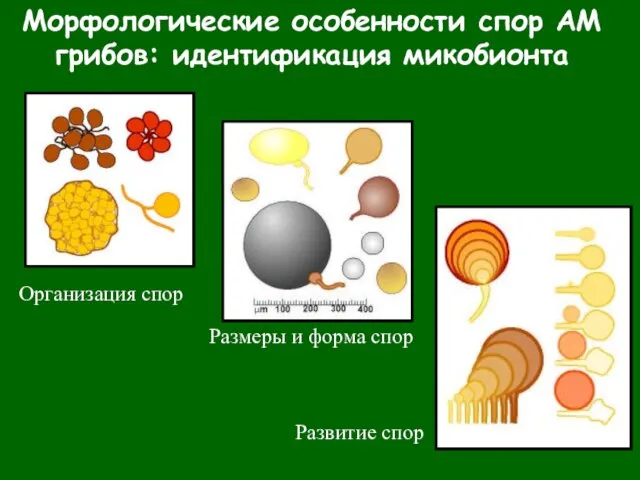
- 27. Морфологические особенности спор АМ грибов: идентификация микобионта Организация спор Размеры и форма спор Развитие спор
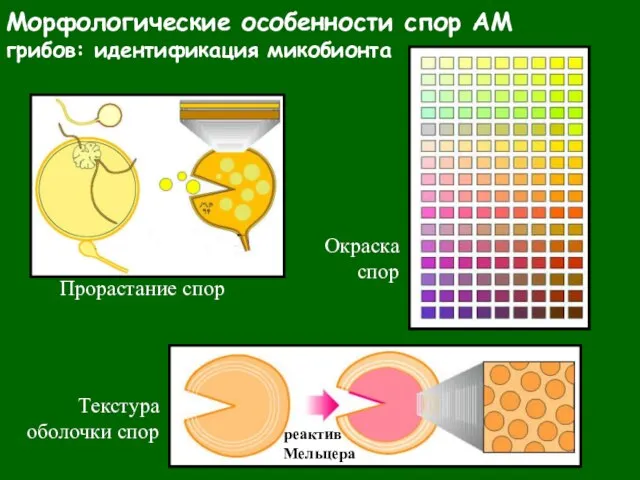
- 28. Морфологические особенности спор АМ грибов: идентификация микобионта Прорастание спор Текстура оболочки спор Окраска спор
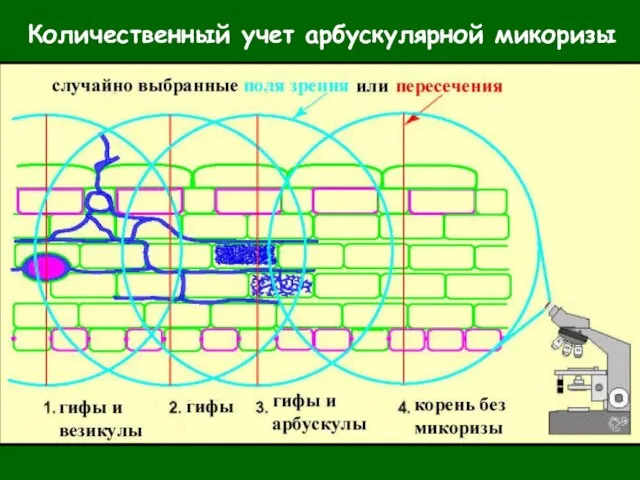
- 29. Количественный учет арбускулярной микоризы
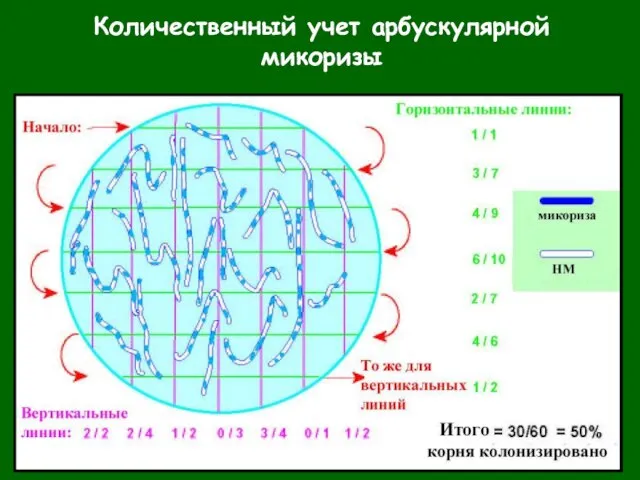
- 30. Количественный учет арбускулярной микоризы
- 31. Количественный учет арбускулярной микоризы Корни (не более 0,1 – 0,2 г) раскладывают на чашке Петри с
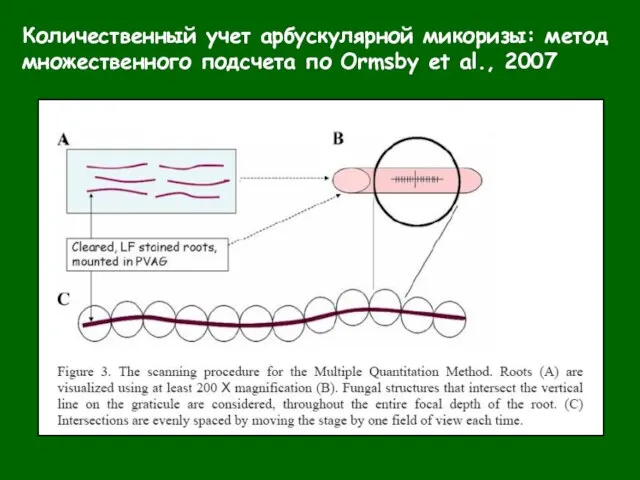
- 32. Количественный учет арбускулярной микоризы: метод множественного подсчета по Ormsby et al., 2007
- 33. Количественный учет арбускулярной микоризы Степень микотрофности (М) характеризует обилие гриба в растении. На каждом исследуемом участке
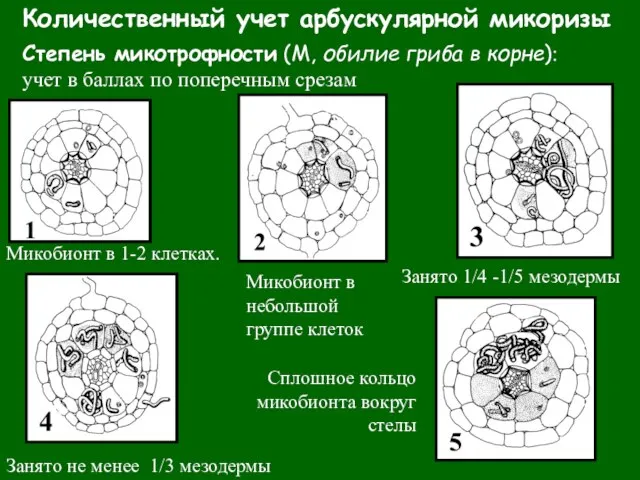
- 34. Количественный учет арбускулярной микоризы Степень микотрофности (М, обилие гриба в корне): учет в баллах по поперечным
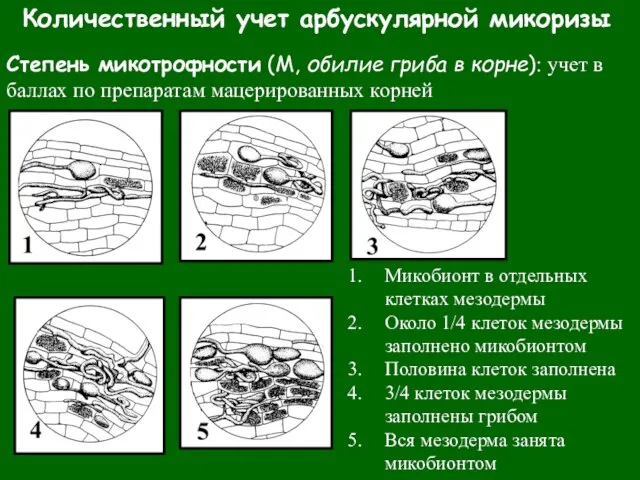
- 35. Количественный учет арбускулярной микоризы Степень микотрофности (М, обилие гриба в корне): учет в баллах по препаратам
- 36. Количественный учет арбускулярной микоризы Интенсивность микоризной инфекции (С) характеризует обилие гриба в растении. где — сумма
- 37. Способы очистки: 1. центрифугирование в градиенте сахарозы (на дне 50% р-р сахарозы, выше 25% р-р, наверху
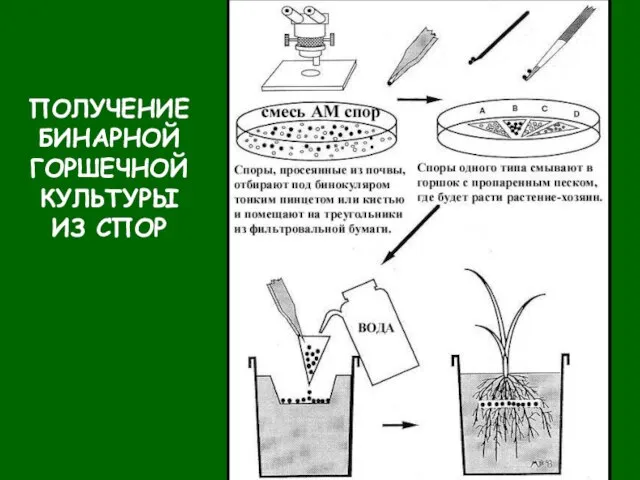
- 38. ПОЛУЧЕНИЕ БИНАРНОЙ ГОРШЕЧНОЙ КУЛЬТУРЫ ИЗ СПОР
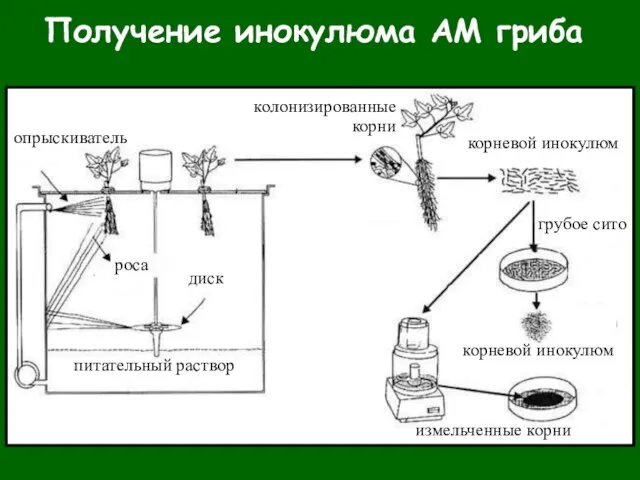
- 39. Получение инокулюма АМ гриба
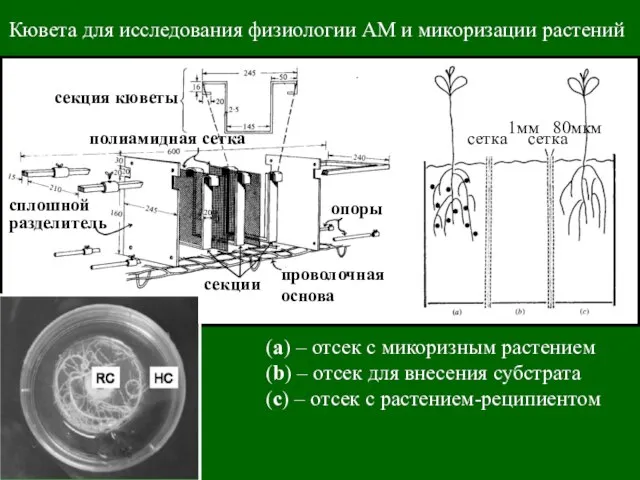
- 40. Кювета для исследования физиологии АМ и микоризации растений (а) – отсек с микоризным растением (b) –
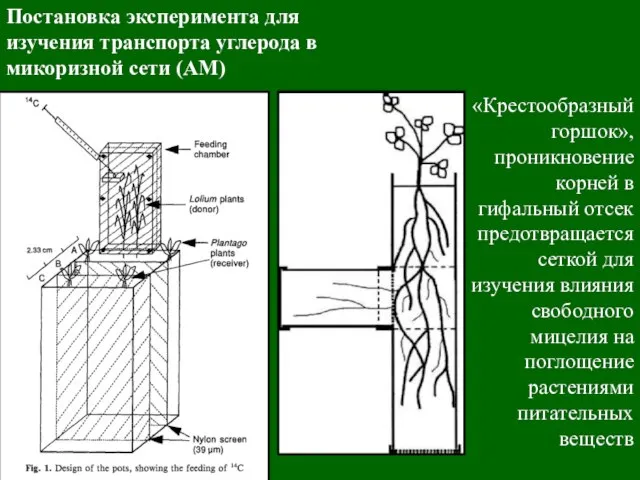
- 41. Постановка эксперимента для изучения транспорта углерода в микоризной сети (АМ) «Крестообразный горшок», проникновение корней в гифальный
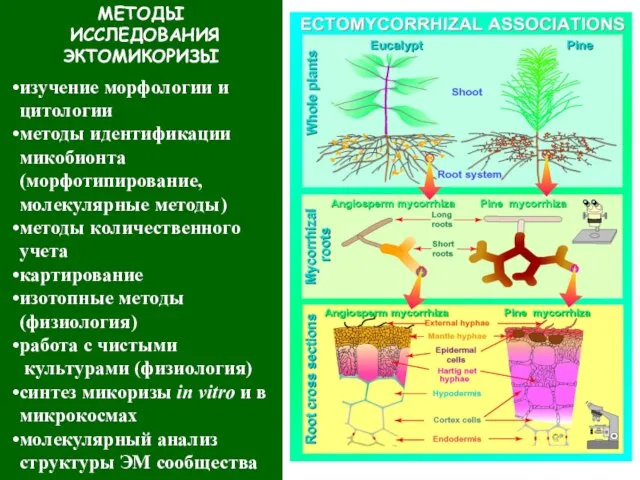
- 42. МЕТОДЫ ИССЛЕДОВАНИЯ ЭКТОМИКОРИЗЫ изучение морфологии и цитологии методы идентификации микобионта (морфотипирование, молекулярные методы) методы количественного учета
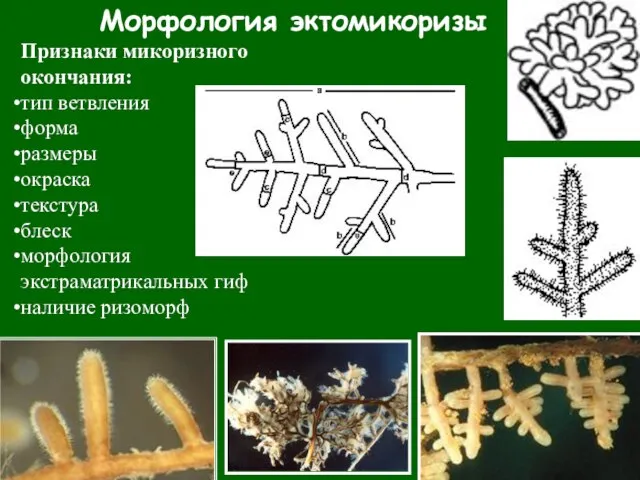
- 43. Морфология эктомикоризы
- 45. фиксаторы: р-р Джуэля (2%-ная хромовая к-та – 25 мл, 10%-ный хлорид платины - 2,5 мл, ледяная
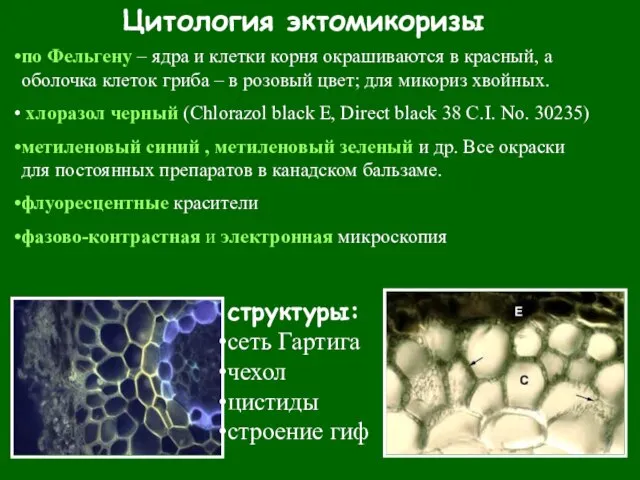
- 46. Цитология эктомикоризы структуры: сеть Гартига чехол цистиды строение гиф по Фельгену – ядра и клетки корня
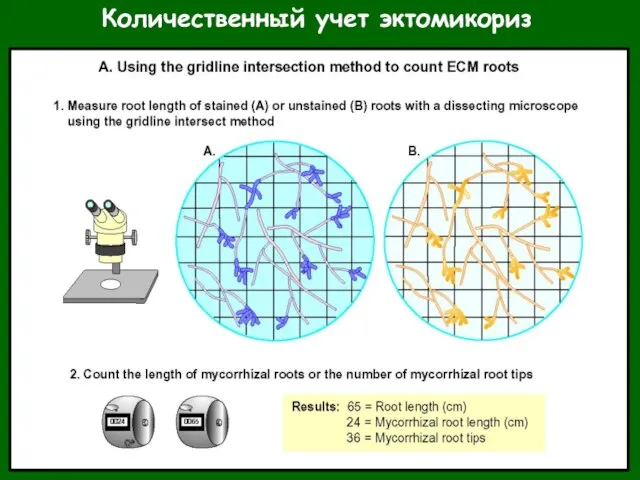
- 47. Количественный учет эктомикориз У сеянцев: измерение корневой системы целиком; отношение длин микоризованной части к общей –
- 48. Количественный учет эктомикориз
- 49. Количественный учет микоризы в фитоценозе Количественные характеристики микотрофизма, или доли участия немикотрофных и в разной степени
- 50. Количественный учет микоризы в фитоценозе 3) относительная интенсивность микоризной инфекции, или мико-симбиотический коэффициент фитоценоза (M); 4)
- 51. Методы идентификации микобионтов микориз Наблюдение распределения ПТ в лесах Прослеживание гиф от ПТ к микоризе Идентификация
- 52. Трудности идентификации микобионта ЭМ: Выделение морфотипов микоризных окончаний и создание описаний и определителей– проблема до сих
- 53. Методы изучения микоризообразующих грибов Наблюдение за плодовыми телами Культуральные исследования мицелия Молекулярные техники анализа ЭМ сообществ
- 54. ПРОСТРАНСТВЕННОЕ РАСПРЕДЕЛЕНИЕ МИКОРИЗ И ЭМ ГРИБОВ: КАРТИРОВАНИЕ КАРТИРОВАНИЕ КОЛОНИЙ ЭМ ГРИБОВ МИКРОКАРТИРОВАНИЕ (McMp) ЭКТОМИКОРИЗ (Agerer, 2002)
- 55. Простран-ственное распреде-ление ЭМ грибов: карти-рование ПТ
- 56. Чистые культуры эктомикоризных грибов Дезинфицирующие р-ры: 100 мг сулемы на 1л воды – обрабатывают 2-3 мин;
- 57. Чистые культуры эктомикоризных грибов модифицированная среда Мелина – Норкранса (MMN) CaCl2 0,05 г NaCl 0,025 г
- 58. ИДЕНТИФИКАЦИЯ ЧИСТЫХ КУЛЬТУР . Для подтверждения микоризности необходимо инокулировать растение-хозяин и при подходящих условиях получить микоризу.
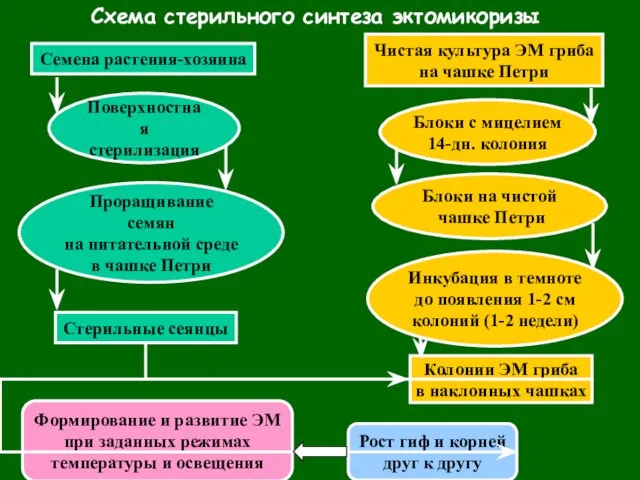
- 59. Схема стерильного синтеза эктомикоризы
- 60. Микрокосмы для синтеза эктомикоризы
- 61. Микрокосмы для синтеза эктомикоризы В микрокосмах возможны эксперименты с внесением определенных веществ или микроорганизмов и оценкой
- 62. Микрокосм Suillus bovinus + Pinus sylvestris. Разрастание мицелия на участке внесения органического вещества из лесной подстилки
- 63. Цветная лазерная сканирующая авторадиография микрокосма через 48 ч. после внесения в побеги Betula 14CO2 Меченый С
- 64. Методы аксеничных и почвенных культур для синтеза эктомикориз. Аксеничные культуры
- 65. Аксеничные культуры
- 66. Нестерильные почвенные культуры
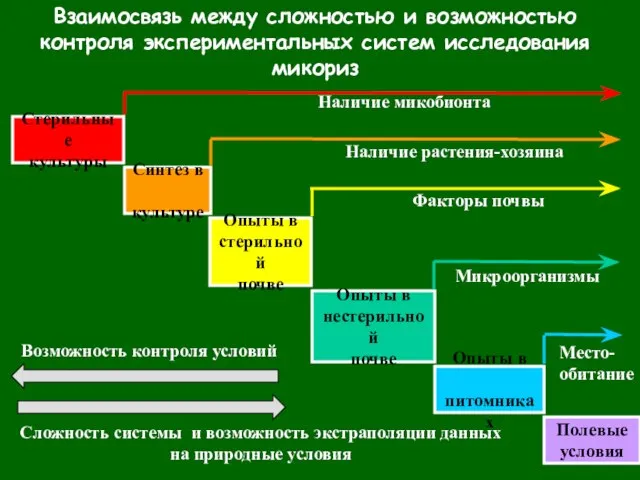
- 67. Взаимосвязь между сложностью и возможностью контроля экспериментальных систем исследования микориз Возможность контроля условий Сложность системы и
- 68. Микрокосм vs полевые исследования Микрокосм Отсутствие природных флуктуаций и экстремальных значений влажности, концентрации пит. в-в Отсутствие
- 69. Микрокосм vs полевые исследования Микрокосм Возможность исследования особенностей микоризы известных видов и генотипов грибов в чистой,
- 70. Микрокосм vs полевые исследования Полевые исследования Сложность изучения подземной части сообщества без серьезных нарушений его целостности
- 71. Подбор почвы, качественно и количественно близкой по составу к природной в изучаемом сообществе Подбор типа почвы,
- 72. Представители каждой группы должны быть включены в виде природных генотипов Включение растительноядных организмов (выедание) с экологически
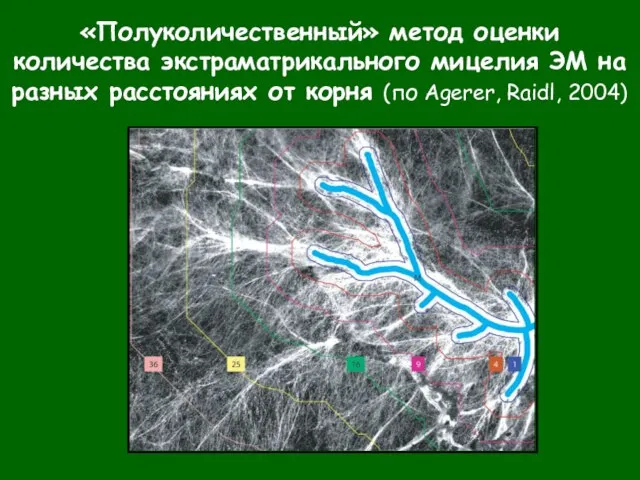
- 73. «Полуколичественный» метод оценки количества экстраматрикального мицелия ЭМ на разных расстояниях от корня (по Agerer, Raidl, 2004)
- 74. Методы исследования свободного мицелия эктомикориза арбускулярная микориза Метод вставочных мембран модификация метода мембранных фильтров Целлюлозо-нитратный или
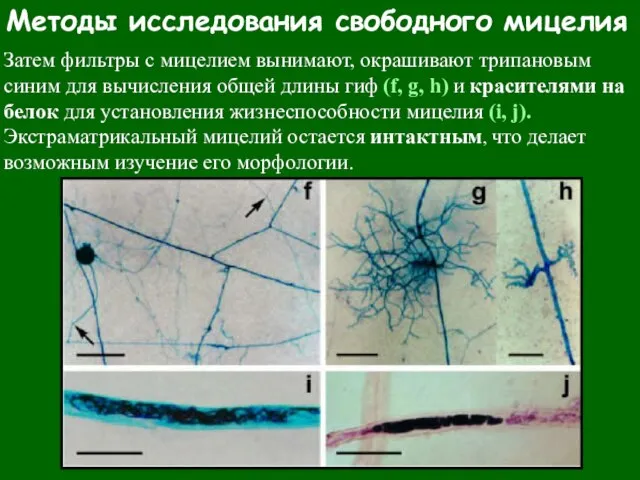
- 75. Методы исследования свободного мицелия Затем фильтры с мицелием вынимают, окрашивают трипановым синим для вычисления общей длины
- 76. Микоризосфера 1904 – Хилтнер ввел термин «ризосфера», наблюдая увеличение численности микроорганизмов в прикорневой зоне 1953 –
- 77. Микоризосфера Методы исследования принадлежат к стандартным методам почвенной микологии, в частности, методам анализа ризосферы. В пределах
- 78. Молекулярные методы исследования микориз
- 79. I Исследование вклада симбиоза в динамику экосистем (новое направление в экологии – молекулярная экология): 1. распределение
- 80. Применение молекулярно-генетических методов для исследования микориз II идентификация чистых культур микоризообразователей III идентификация микобионтов непосредственно из
- 81. Количественно изучать сообщества ЭМ грибов, распространение их в природе. Оценить видовое разнообразие и роль в сообществе
- 82. Исследовать генотипы грибов и их связь с физиологией микоризы Исследовать организмы микоризопланы и микоризосферы Идентифицировать микобионт
- 83. Выделение (экстракция ) ДНК из микоризного окончания Накопление нужного участка ДНК (ITS-области (спейсеры) р ДНК или
- 84. Недостатки молекулярных исследований микориз: Получаемые данные принципиально несравнимы (методы экстракции ДНК, ПЦР и т.д.) Эталонные последовательности,
- 85. Перспективы молекулярно-генетических исследований микоризообразующих грибов I Анализ отношений симбионтов на молекулярно-генетическом уровне, выявление природы сигналов, определяющих
- 87. Скачать презентацию






















































 ЧС в быту
ЧС в быту Пустыни
Пустыни Проект группы “Б”
Проект группы “Б” Древние люди Забайкалья
Древние люди Забайкалья 1816 г. Рене-Теофиль Лаэннек изобрёл стетоскоп
1816 г. Рене-Теофиль Лаэннек изобрёл стетоскоп Образовательная программа по вопросам ценообразования и государственного регулирования отраслей экономики РФ
Образовательная программа по вопросам ценообразования и государственного регулирования отраслей экономики РФ СОДЕРЖАНИЕ: Краткая информация………………………………………33 Партнеры………………..……………………………………44 Стадии процесса…..………………
СОДЕРЖАНИЕ: Краткая информация………………………………………33 Партнеры………………..……………………………………44 Стадии процесса…..……………… Инфекции — Туляремия
Инфекции — Туляремия Презентация на тему Автомеханик
Презентация на тему Автомеханик Организация проектной деятельности на уроках
Организация проектной деятельности на уроках Однокомнатная квартира. Тип 1
Однокомнатная квартира. Тип 1 «Учителя – в годы Великой Отечественной войны» Экспозиция школьного музеявыполнена зам. директора по ВР Мельниченко В.В.С.Нарв
«Учителя – в годы Великой Отечественной войны» Экспозиция школьного музеявыполнена зам. директора по ВР Мельниченко В.В.С.Нарв Растительный мир тундры
Растительный мир тундры Строительный подряд
Строительный подряд Еженедельная газета «ЮРИДИЧЕСКАЯ ПРАКТИКА» —главный источник правовой информации для профессионалов в сфере юриспруденции
Еженедельная газета «ЮРИДИЧЕСКАЯ ПРАКТИКА» —главный источник правовой информации для профессионалов в сфере юриспруденции Презентация на тему Аркадий Кирсанов в произведение Ивана сергеевича тургенева «отцы и дети»
Презентация на тему Аркадий Кирсанов в произведение Ивана сергеевича тургенева «отцы и дети» Загрязнение окружающей среды.Проблема мусора
Загрязнение окружающей среды.Проблема мусора Идеи по формированию концепции безопасности на Талони
Идеи по формированию концепции безопасности на Талони Вводный урок по русскому языку
Вводный урок по русскому языку Апаратты кодтау жне сатау. СРС
Апаратты кодтау жне сатау. СРС Творческий проект "Мой друг Кеша"
Творческий проект "Мой друг Кеша" The Blending of Genres
The Blending of Genres  Программируем в Windows Forms
Программируем в Windows Forms  Биосинтез белков
Биосинтез белков Конструирование балки
Конструирование балки Министерство сельского хозяйства Ульяновской области МЯСНЫЕ ПОРОДЫКРУПНОГО РОГАТОГО СКОТА
Министерство сельского хозяйства Ульяновской области МЯСНЫЕ ПОРОДЫКРУПНОГО РОГАТОГО СКОТА Презентация на тему Нравственный поступок
Презентация на тему Нравственный поступок  1 Descriptive geometry Introduction
1 Descriptive geometry Introduction