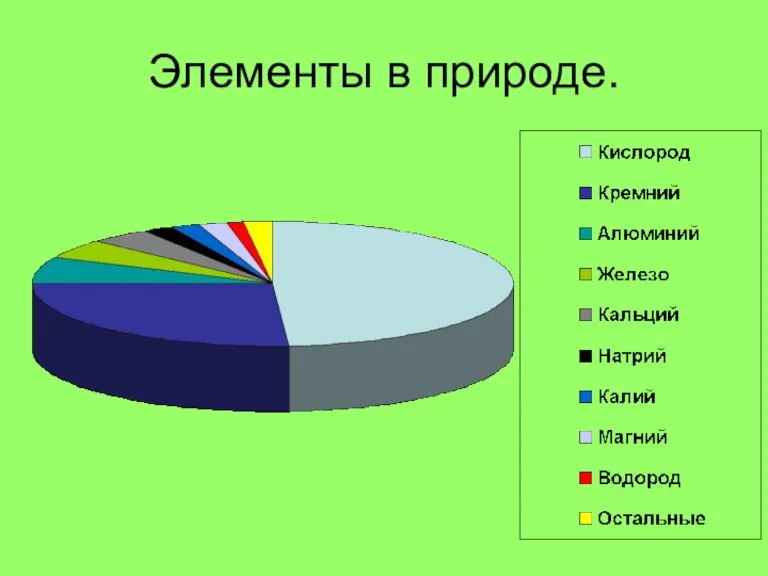
Слайд 3Нахождение в природе.
Самородные элементы
Сера
Графит С
Алмаз С
Азот и кислород, инертные газы в

составе воздуха
Слайд 4Нахождение в природе
← Апатиты Р
Галит NaCl →
← FeS2 пирит
Кварц SiO2 →

Слайд 5Неметаллы - это химические элементы, которые могут проявлять свойства как окислителя (

принимают электроны), так и восстановителя (отдают электроны).
НеМ – элементы с высокой ОЭО (2 - 4)
Исключения : фтор – только окислитель,
инертные газы – могут только отдавать электроны.
Гелий, неон и аргон – соединений не образуют.
Слайд 6Соединения неметаллов.
Оксиды – только кислотные
SO3, SO2, CO2 и другие.
(кроме NO и

CO –безразличные)
Гидроксиды – только кислоты
H2SO4, H2SO3,H2CO3 и другие
Образуют летучие соединения с водородом HCl, NH3…
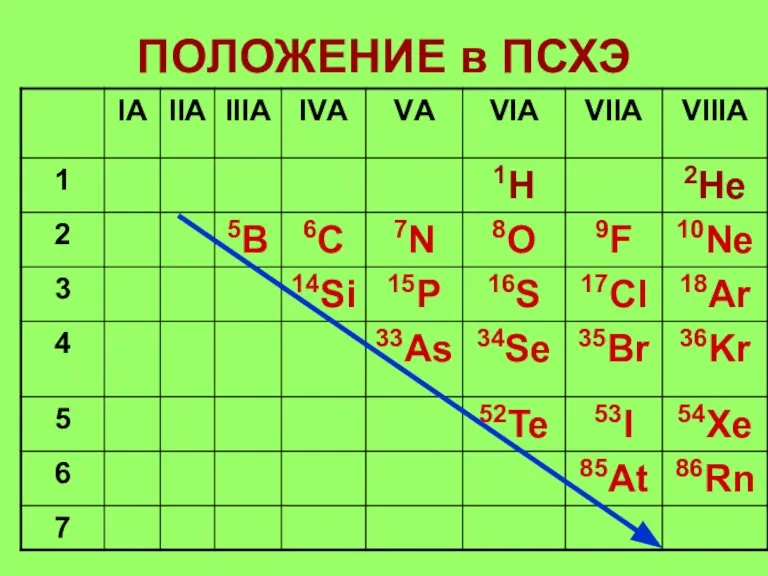
Слайд 13Строение атомов НеМ
1. Элементы расположены в главных подгруппах III –VIII групп (А).
2.
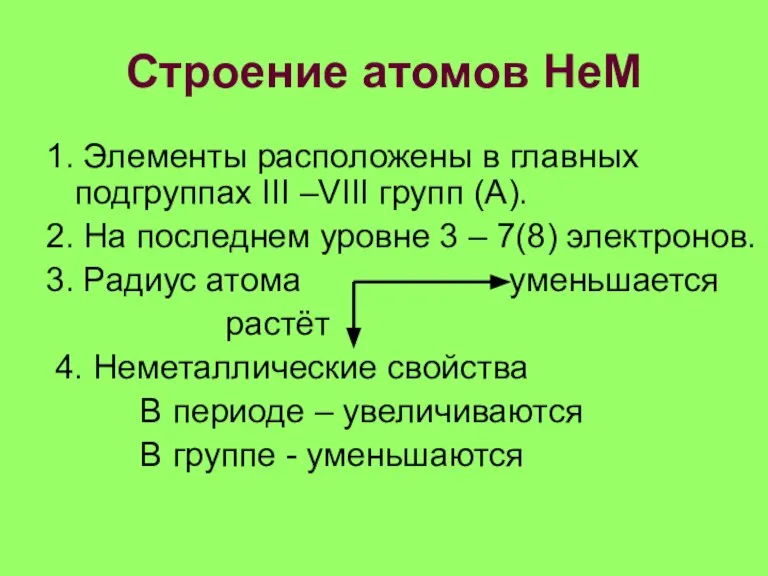
На последнем уровне 3 – 7(8) электронов.
3. Радиус атома уменьшается
растёт
4. Неметаллические свойства
В периоде – увеличиваются
В группе - уменьшаются
Слайд 14Строение атомов НеМ
5. Высокая электроотрицательность.
6. Принимают электроны и отдают.
7. НеМ → кислотный

оксид→кислота
8. Летучие водородные соединения
(кислоты, основания и безразличные)
Слайд 15Физические свойства
Агрегатное состояние.
Газообразные – азот, кислород, хлор, инертные газы, водород.
Жидкий –

бром,
Твёрдые – сера, фосфор, углерод…
Растворимость в воде.
Нерастворимы.
Отношение к электрическому току.
Неэлектропроводные: сера, кислород…
Проводники: графит
Полупроводники: кремний
Слайд 16Строение неметаллов.
Молекулярное (НеМ), где
Инертные газы He, Ar, Ne…
H2, Cl2, N2…
P4 белый
Pn

красный
Атомное строение
(С)n -алмаз, графит;
(Si)n кремний;
(B)n бор
Слайд 17Кислород, водород – пример газообразных бесцветных неметаллов

Слайд 18Большинство неметаллов имеют твёрдое агрегатное состояние
Сера – кристаллическое вещество жёлтого цвета
Красный фосфор
Углерод

(уголь)
Слайд 19Неметаллы малорастворимы в воде
Уголь
Фосфор
Сера не смачивается водой

















 Назови десятки и единицы.
Назови десятки и единицы. Личностно-ориентированное обучение в начальной школе
Личностно-ориентированное обучение в начальной школе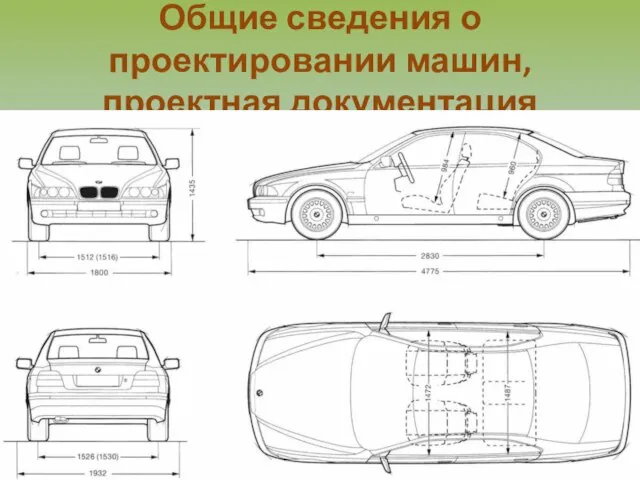 Общие сведения о проектировании машин, проектная документация
Общие сведения о проектировании машин, проектная документация Анализируя правила, вскрывая их механизм, следует сопровождать их алгоритмами, которые должны помочь человеку безошибочно писать.
Анализируя правила, вскрывая их механизм, следует сопровождать их алгоритмами, которые должны помочь человеку безошибочно писать. Реальное и фантастическое в повести Н. В. Гоголь "Заколдованное место"
Реальное и фантастическое в повести Н. В. Гоголь "Заколдованное место" Профессиональная поддержка психологов: опыт работы районного методического объединения Сергиево-Посадского муниципального райо
Профессиональная поддержка психологов: опыт работы районного методического объединения Сергиево-Посадского муниципального райо III закон Ньютона
III закон Ньютона «Constructor»
«Constructor» Знаменитые педагоги прошлого
Знаменитые педагоги прошлого Газированные напитки: вред или польза???
Газированные напитки: вред или польза??? Leçon dix
Leçon dix Здоровое питание – крепкое здоровье!
Здоровое питание – крепкое здоровье! Информационные транспортные системы и безопасность на железных дорогах
Информационные транспортные системы и безопасность на железных дорогах Панки
Панки РАО «ЕЭС России»: Инвестиционная фаза реформы
РАО «ЕЭС России»: Инвестиционная фаза реформы Великая Отечественная война в Заполярье
Великая Отечественная война в Заполярье Реклама в мобильных картах: Почему нет
Реклама в мобильных картах: Почему нет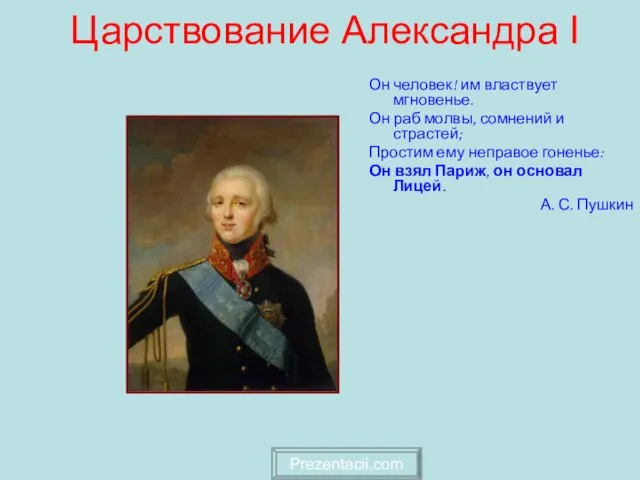 Царствование Александра I
Царствование Александра I Манипулятивные методы в рекламе
Манипулятивные методы в рекламе беспризорные дети
беспризорные дети Презентацию подготовили ученики 4 «Б» класса «МОУ СОШ 4».
Презентацию подготовили ученики 4 «Б» класса «МОУ СОШ 4». М Е Д И Т А Ц И Я
М Е Д И Т А Ц И Я Методика РОО (проект)
Методика РОО (проект) Объединение «Художественное моделирование, квиллинг»
Объединение «Художественное моделирование, квиллинг» Белая сова
Белая сова в поэзии А.С. Пушкина
в поэзии А.С. Пушкина преобразование города: СТРАТЕГИЯ СОЦИАЛЬНО-ЭКОНОМИЧЕСКОГО РАЗВИТИЯ ГОРОДА ПЕРМИ ГЕНЕРАЛЬНЫЙ ПЛАН ГОРОДА ПЕРМИ
преобразование города: СТРАТЕГИЯ СОЦИАЛЬНО-ЭКОНОМИЧЕСКОГО РАЗВИТИЯ ГОРОДА ПЕРМИ ГЕНЕРАЛЬНЫЙ ПЛАН ГОРОДА ПЕРМИ Прогрессии и непрерывные арифметические пропорции
Прогрессии и непрерывные арифметические пропорции