Слайд 2Содержание
1.Определение
2.Номенклатура алкенов
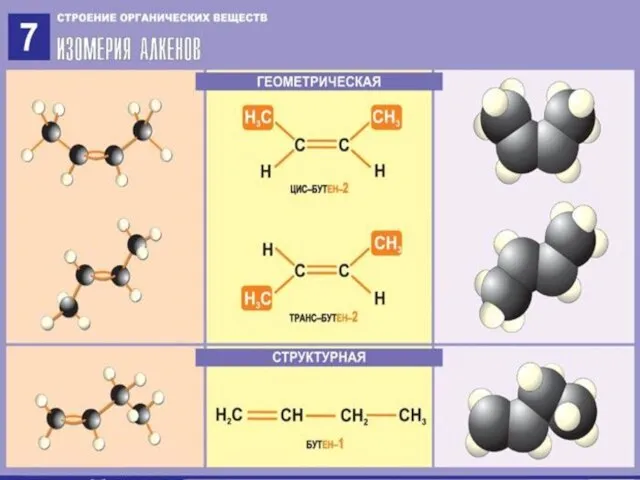
3.Изомерия алкенов
4.Строение алкенов
5.Получение алкенов
6.Физические свойства
7.Химические свойства
8.Применение алкенов

Слайд 3Определение
Алкены – непредельные углеводороды, в молекулах которых между атомами углерода имеется

одна двойная связь.
Общая формула: СnH2n , где n ≥2
Слайд 4Номенклатура алкенов
СН2 = СН2 этен (этилен)
СН3 – СН = СН2

пропен (пропилен)
4 3 2 1 1 2 3 4
СН3 – СН2 – СН = СН2 СН3 – СН = СН – СН3
бутен -1 (бутилен-1) бутен -2 (бутилен-2)
5 4 3 2 1
СН3 – СН – CH2 – CH=CH2
|
CH3 4 – метилпентен -1
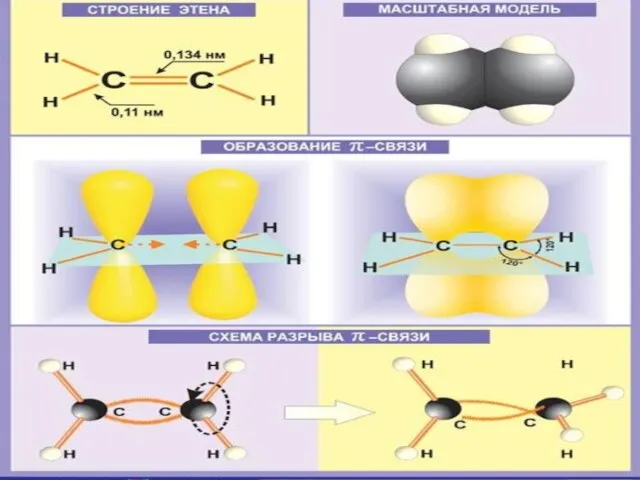
Слайд 6Строение алкенов
СН2 = СН2 этилен (этен)
Двойная связь: σ-связь+π-связь
Тип

гибридизации: sp²
Валентный угол: 120°
Форма молекулы:
плоскостная (треугольная)
Слайд 8Получение алкенов
1.Крекинг нефтепродуктов:
СН3 –СН2 –СН2 –СН3 → СН2 = СН2 + СН3
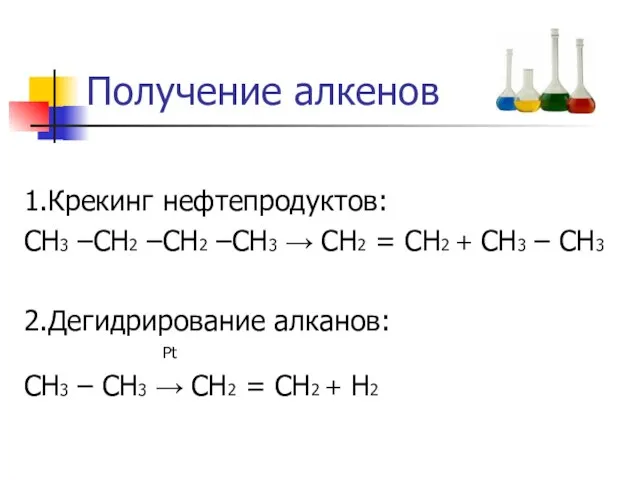
– СН3
2.Дегидрирование алканов:
Pt
СН3 – СН3 → СН2 = СН2 + Н2
Слайд 9Получение алкенов
3.Дегидратация спиртов:
4.Дегидрогалогенирование:
H3C-CH2-CH2Br + NaOH(спирт.р-р) → NaBr+ H2O + + H3C-CH=CH2

Слайд 10Получение алкенов
5.Дегалогенирование:

Слайд 11Физические свойства
Этен,пропен, бутен – газы
С5Н10 – С16Н32 - жидкости
Высшие алкены

– тв.вещества
Слайд 12Химические свойства
I.Реакции присоединения:
1.Гидрирование :
CH2=CH-CH3+Н2 → CH3-CH2-CH3
2.Галогенирование:
CH2=CH-CH3+Cl2 → CH2Cl-CHCl-CH3
3.Гидрогалогенирование:
CH2=CH-CH3+НCl →

CH3-CHCl-CH3
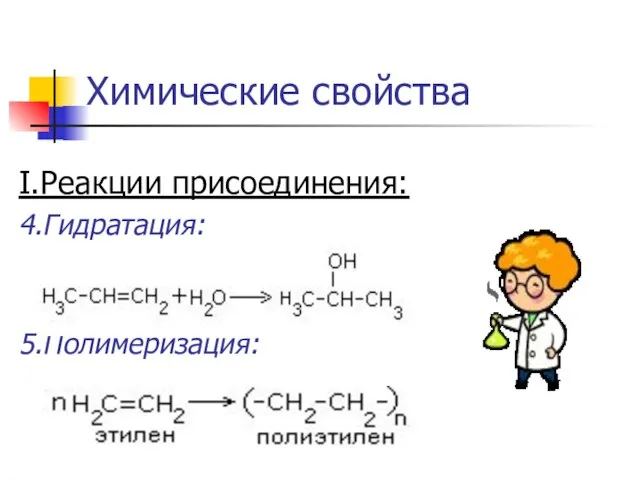
Слайд 13Химические свойства
I.Реакции присоединения:
4.Гидратация:
5.Полимеризация:
Слайд 14Химические свойства
II.Реакции окисления:
1.Полное окисление (горение):
С2Н4 + 3О2 → 2СО2 + 2Н2О
2.Неполное

окисление:
3С2Н4 + 2KMnO4 +4Н2О →3HOCH2-CH2OH +
+2MnO2 + 2KOH












 THE CHRISTIAN WORKER
THE CHRISTIAN WORKER 1665678763032__30ro86
1665678763032__30ro86 Агрессия (4 класс)
Агрессия (4 класс) 1.1 + 1.2
1.1 + 1.2 История носового платка
История носового платка Поля листа
Поля листа Вкусное и красивое лакомство для неожиданных гостей
Вкусное и красивое лакомство для неожиданных гостей Добро пожаловать
Добро пожаловать Независимое распределение затрат в управленческом и регламентированном учете
Независимое распределение затрат в управленческом и регламентированном учете Абсолютные показатели оценки риска
Абсолютные показатели оценки риска Кипение
Кипение Страны Северной Европы
Страны Северной Европы Конструкция головы человека и её пропорции (6 класс)
Конструкция головы человека и её пропорции (6 класс) Энтеровирусная инфекция
Энтеровирусная инфекция Конвекция
Конвекция САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКИЕ ТРЕБОВАНИЯ К УСЛОВИЯМИ ОРГАНИЗАЦИИ ОБУЧЕНИЯ В ОБЩЕОБРАЗОВАТЕЛЬНЫХ УЧРЕЖДЕНИЯХ
САНИТАРНО-ЭПИДЕМИОЛОГИЧЕСКИЕ ТРЕБОВАНИЯ К УСЛОВИЯМИ ОРГАНИЗАЦИИ ОБУЧЕНИЯ В ОБЩЕОБРАЗОВАТЕЛЬНЫХ УЧРЕЖДЕНИЯХ Ассоциация «МЫ»
Ассоциация «МЫ»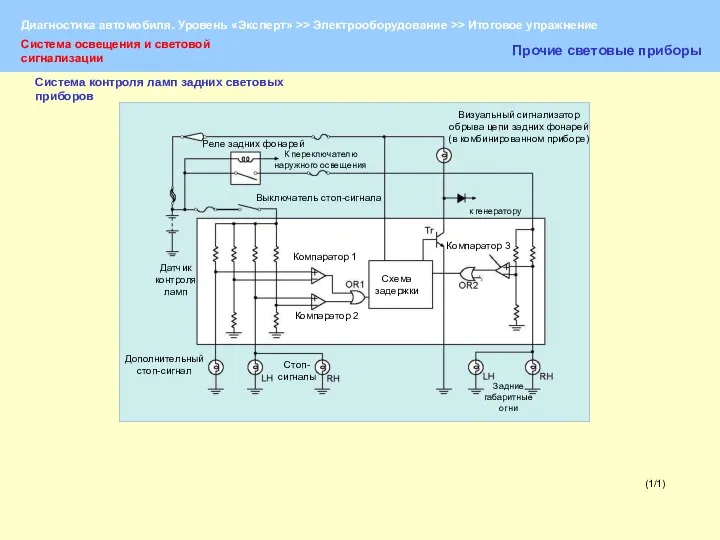 Диагностика автомобиля. Диагностирование осветительных приборов
Диагностика автомобиля. Диагностирование осветительных приборов Денис Васильевич Давыдов
Денис Васильевич Давыдов Рекомендую как пособие по медицинской генетике
Рекомендую как пособие по медицинской генетике Любимый семейный завтрак семьи Пьянковых
Любимый семейный завтрак семьи Пьянковых Доброта
Доброта О РЕЗУЛЬТАТАХ ЕГЭ в г. Сочи в 2011 ГОДУ
О РЕЗУЛЬТАТАХ ЕГЭ в г. Сочи в 2011 ГОДУ Психологические закономерности формирования личности в тренировочном процессе.
Психологические закономерности формирования личности в тренировочном процессе. Базовый межшкольный методический центр 26311
Базовый межшкольный методический центр 26311 Сложение и вычитание двузначных чисел 2 класс
Сложение и вычитание двузначных чисел 2 класс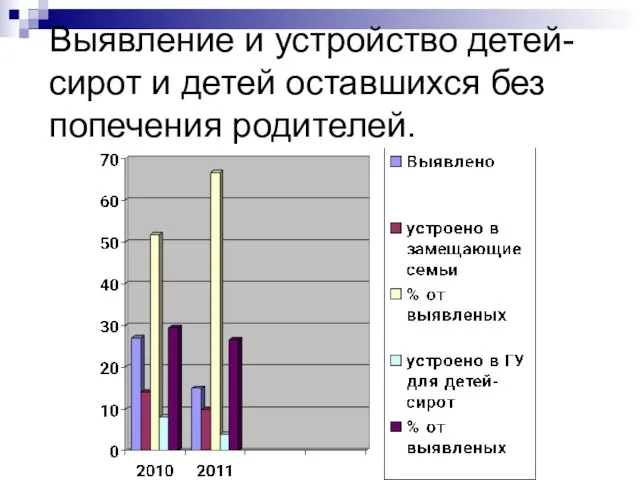 Выявление и устройство детей-сирот и детей оставшихся без попечения родителей.
Выявление и устройство детей-сирот и детей оставшихся без попечения родителей. Создание единого китайского государства
Создание единого китайского государства