Содержание
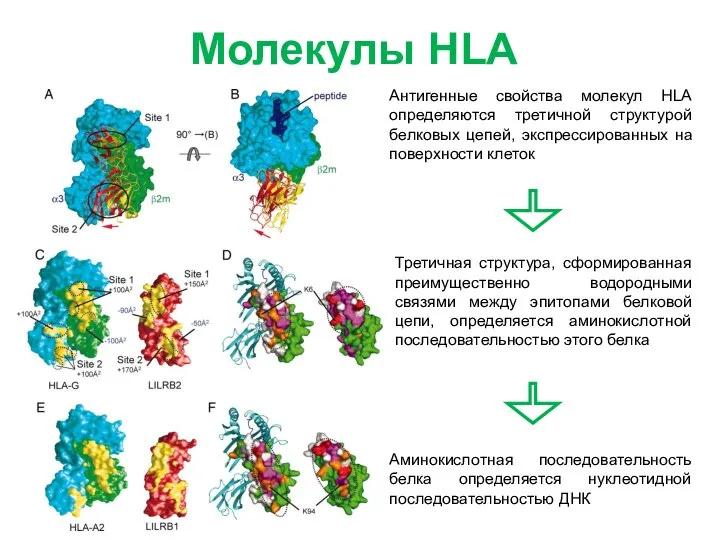
- 2. Молекулы HLA Антигенные свойства молекул HLA определяются третичной структурой белковых цепей, экспрессированных на поверхности клеток Третичная
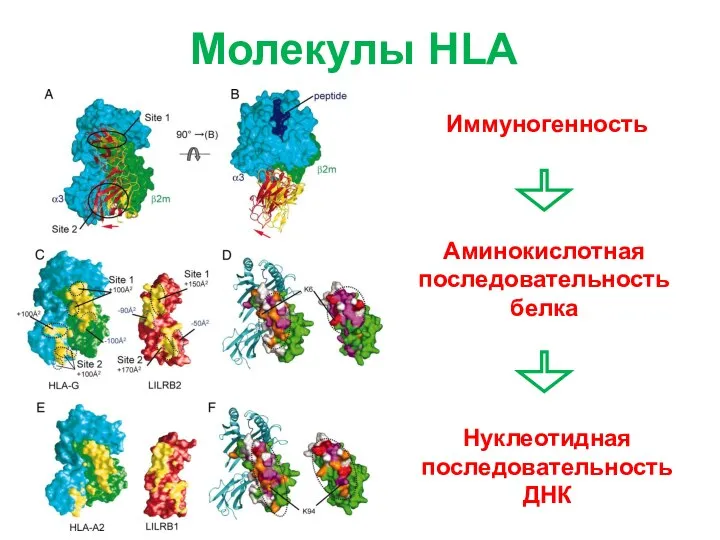
- 3. Молекулы HLA Иммуногенность Аминокислотная последовательность белка Нуклеотидная последовательность ДНК
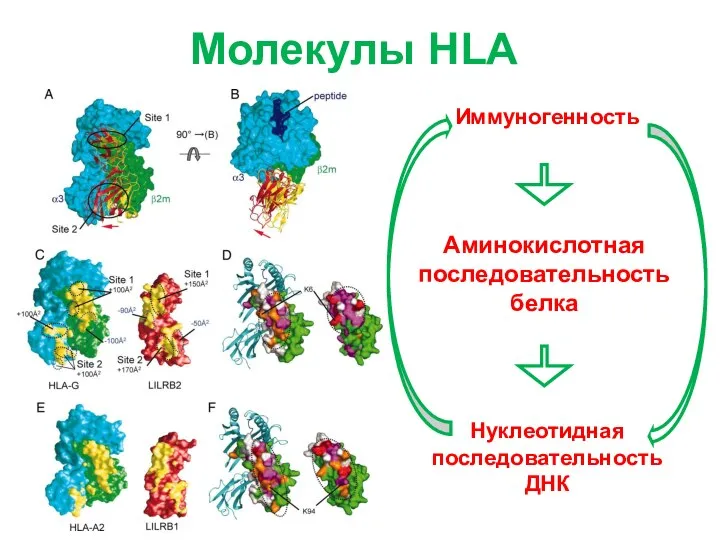
- 4. Молекулы HLA Иммуногенность Аминокислотная последовательность белка Нуклеотидная последовательность ДНК
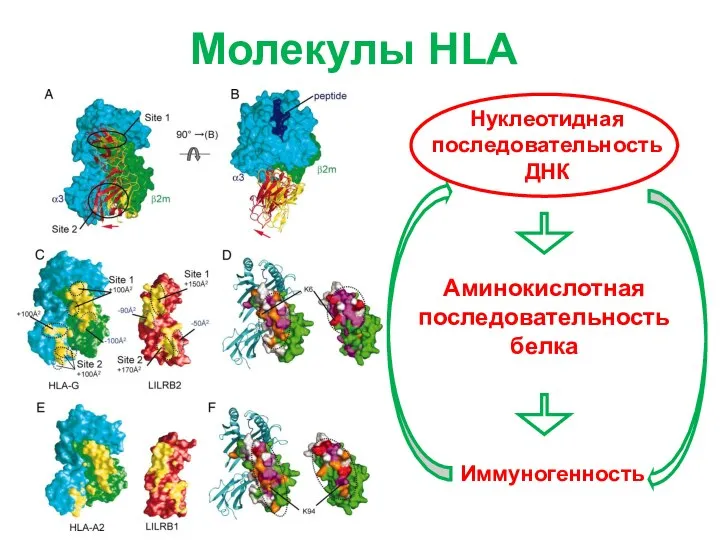
- 5. Молекулы HLA Иммуногенность Аминокислотная последовательность белка Нуклеотидная последовательность ДНК
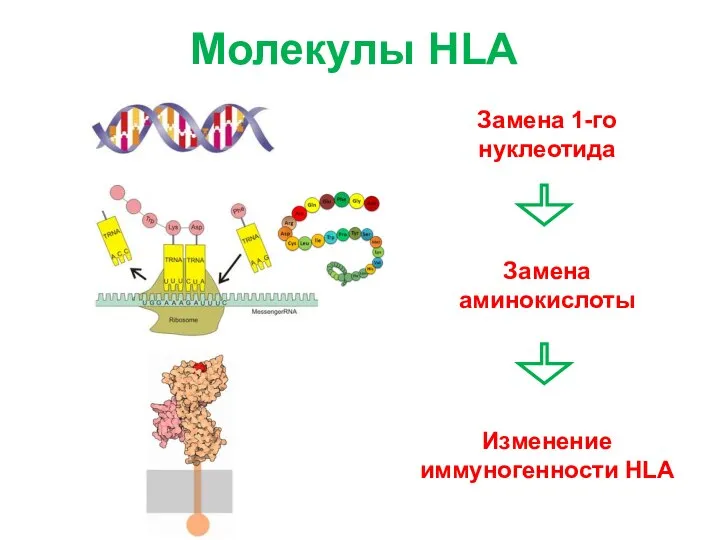
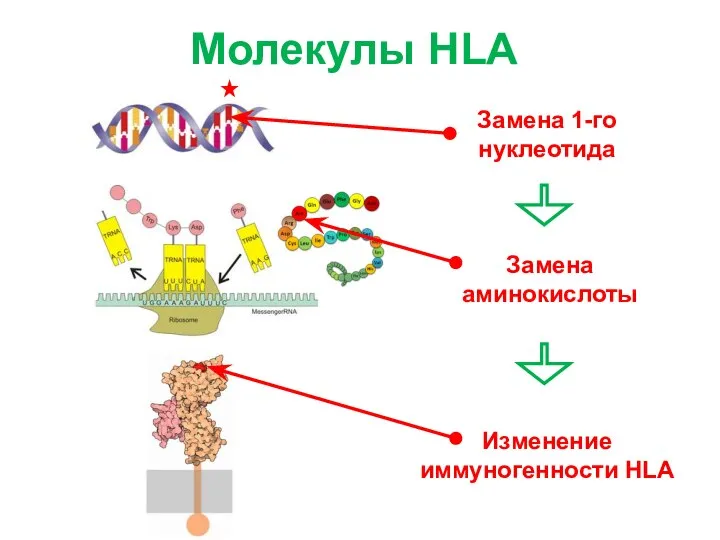
- 6. Молекулы HLA Изменение иммуногенности HLA Замена аминокислоты Замена 1-го нуклеотида
- 7. Молекулы HLA Изменение иммуногенности HLA Замена аминокислоты Замена 1-го нуклеотида
- 8. Задача HLA-типирования – охарактеризовать специфичность молекулы HLA Наиболее точный способ HLA-типирования – получение представления о последовательности
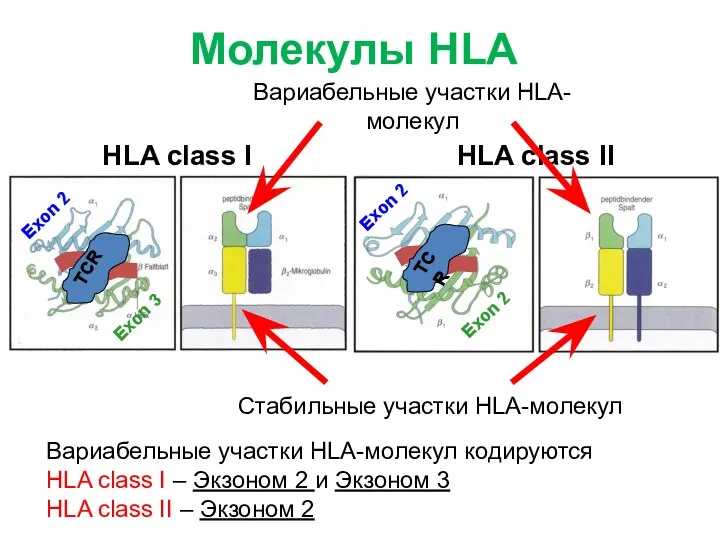
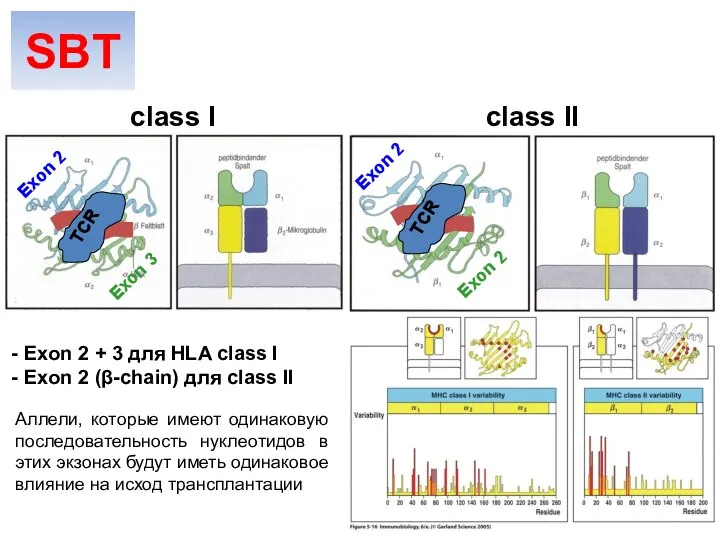
- 9. Exon 2 Exon 3 Exon 2 Exon 2 HLA class I HLA class II Вариабельные участки
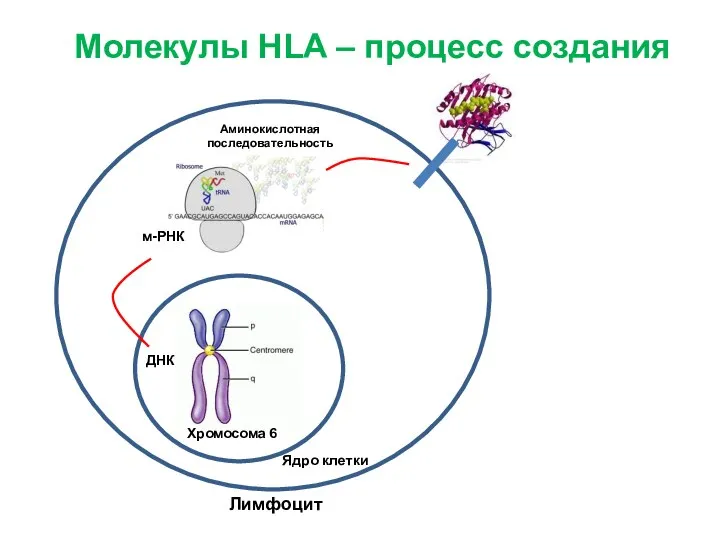
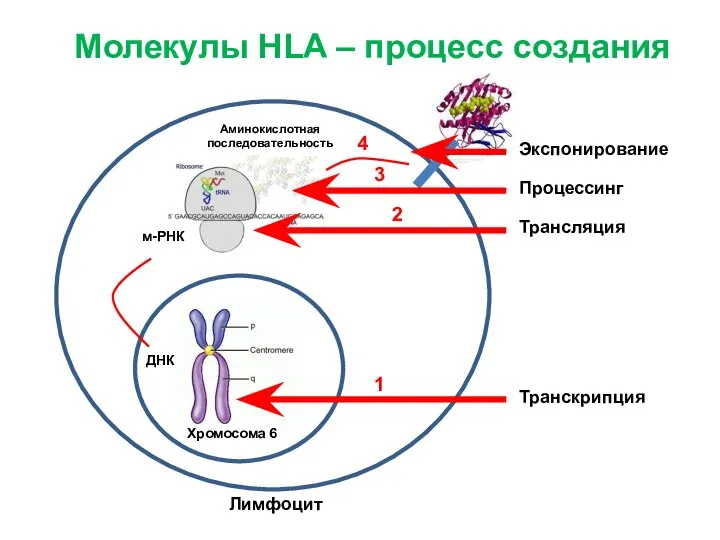
- 10. Лимфоцит м-РНК ДНК Аминокислотная последовательность Молекулы HLA – процесс создания Хромосома 6 Ядро клетки
- 11. Лимфоцит м-РНК ДНК Аминокислотная последовательность Молекулы HLA – процесс создания Хромосома 6 Транскрипция Трансляция Процессинг Экспонирование
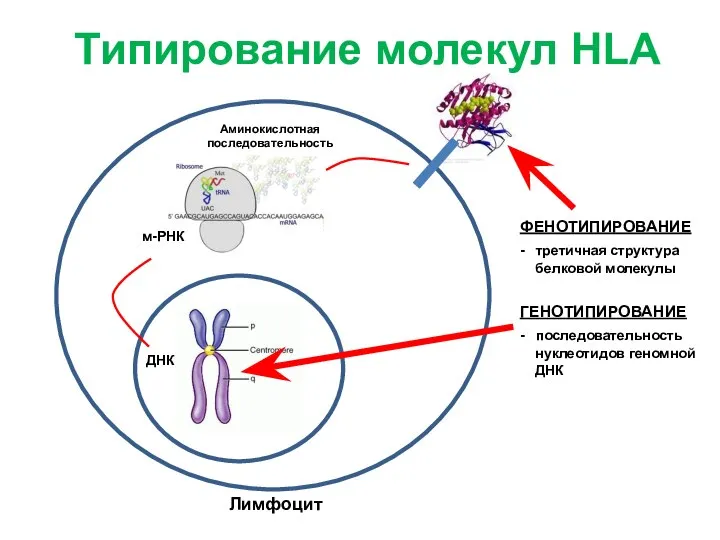
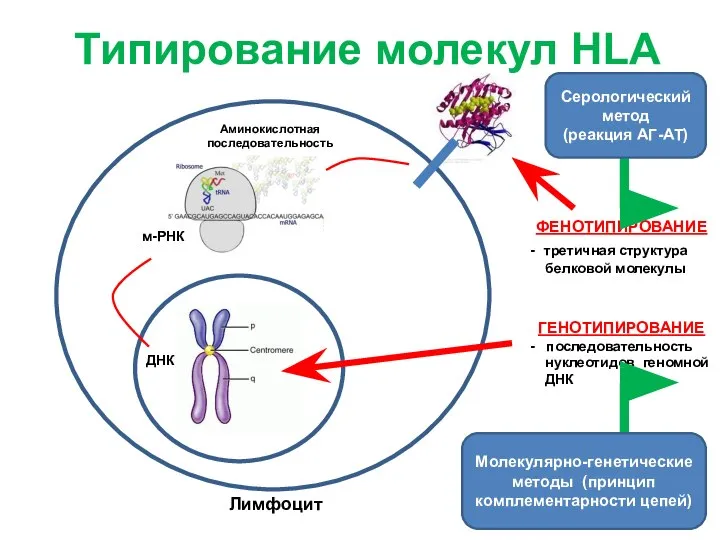
- 12. Лимфоцит м-РНК ДНК Аминокислотная последовательность ФЕНОТИПИРОВАНИЕ - третичная структура белковой молекулы Типирование молекул HLA ГЕНОТИПИРОВАНИЕ -
- 13. Лимфоцит м-РНК ДНК Аминокислотная последовательность ФЕНОТИПИРОВАНИЕ - третичная структура белковой молекулы ГЕНОТИПИРОВАНИЕ - последовательность нуклеотидов геномной
- 14. ФЕНОТИПИРОВАНИЕ 1. Выделение популяции Т-лимфоцитов - центрифугирование - иммуномагнитная сепарация 2. Лимфоцитотоксический тест 1 2
- 15. ФЕНОТИПИРОВАНИЕ Серологическое типирование необходимо провести в течение 1 рабочего дня с момента взятия крови, так как
- 16. ФЕНОТИПИРОВАНИЕ Метод субъективен, нет возможности документации изображения результатов комплемент-зависимого лизиса лимфоцитов, требует работы персонала с микроскопом.
- 17. ФЕНОТИПИРОВАНИЕ Существует возможность фенотипирования с помощью проточной цитометрии. Результаты по качеству аналогичны серологическому типированию в лимфоцитотоксическом
- 18. ГЕНОТИПИРОВАНИЕ 1. Выделение ДНК из цельной крови (источник – ядросодержащие форменные элементы) - ручные способы (спиртовая
- 19. ГЕНОТИПИРОВАНИЕ Взятие венозной крови Выделение ДНК Хранение крови, а лучше – выделенной ДНК при -80оС несколько
- 20. ГЕНОТИПИРОВАНИЕ Выделение ДНК возможно всего из 150 мкл венозной крови 1. Выделение ДНК: однотипно для всех
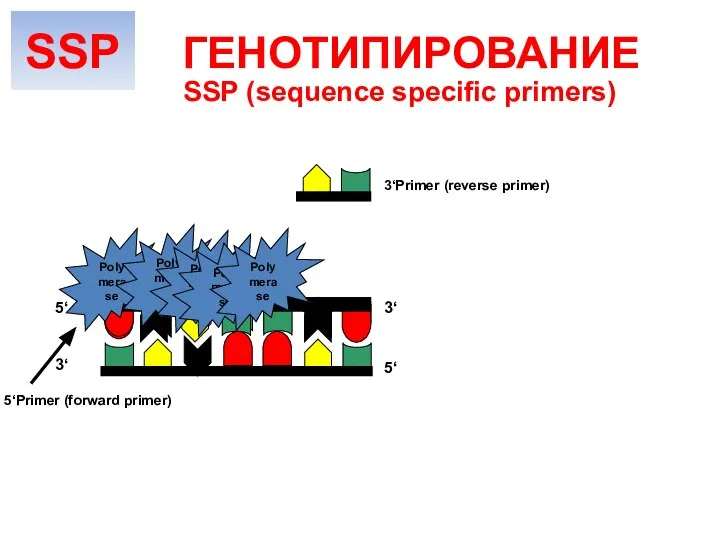
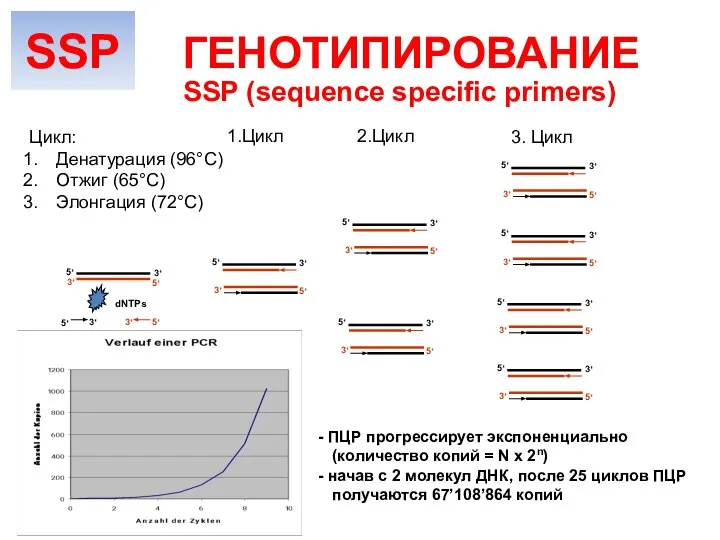
- 21. SSP (sequence specific primers) ГЕНОТИПИРОВАНИЕ Амплификация ДНК На дно лунок планшеты закреплены смеси праймеров, комплементарных определенным
- 22. Polymerase Polymerase Polymerase Polymerase Polymerase 5‘ 5‘ 3‘ 3‘ 3‘Primer (reverse primer) 5‘Primer (forward primer) SSP
- 23. 5‘ 5‘ 3‘ 3‘ 5‘ 3‘ 5‘ 3‘ 5‘ 3‘ 5‘ 3‘ 5‘ 3‘ 5‘ 3‘
- 24. Метод документируем, оборудование универсальное (для любого ПЦР-анализа), система открытая – в РФ поставляются наборы 5 производителей.
- 25. SSO (sequence specific oligonucleotides) ГЕНОТИПИРОВАНИЕ ДНК Амплифицируются не конкретные специфичности, а большие участки ДНК – целые
- 26. Гибридизация крупных «локусных» ампликонов со специфическими олигонуклеотидами, нанесенными на микросферы или стрипы. По принципу комплементарности участки
- 27. Метод документируем, оборудование специфическое, системы закрытые, невозможно высокоразрешающее типирование, ПО необходимо контролировать. Метод позволяет генотипировать HLA
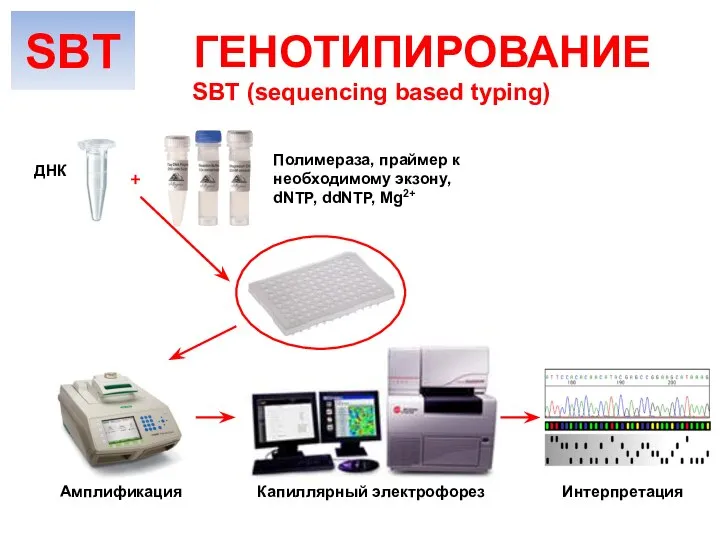
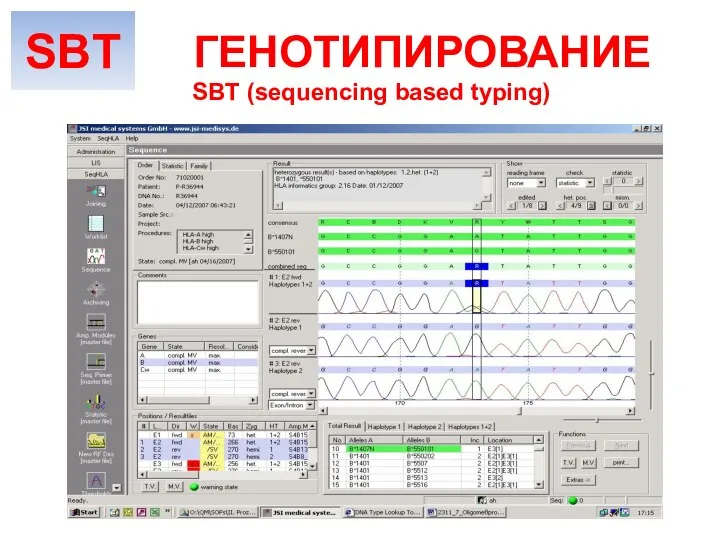
- 28. SBT (sequencing based typing) ГЕНОТИПИРОВАНИЕ Амплификация ДНК Полимераза, праймер к необходимому экзону, dNTP, ddNTP, Mg2+ Капиллярный
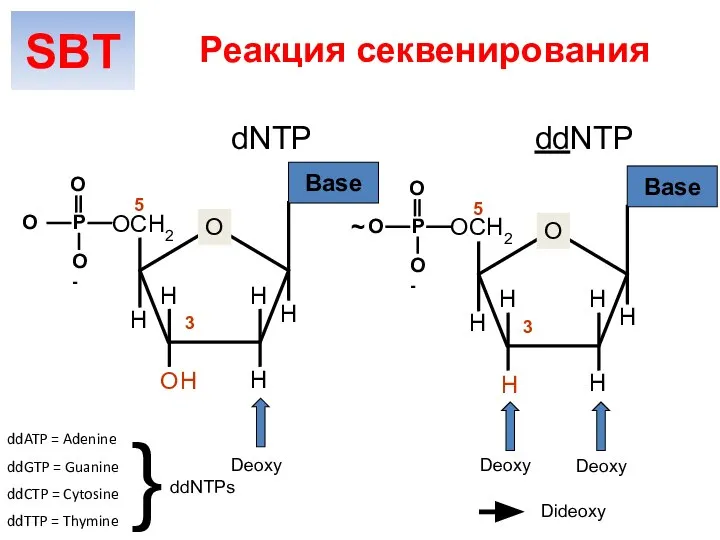
- 29. dNTP ddNTP O OCH2 H H H H O H P O O O- Base H
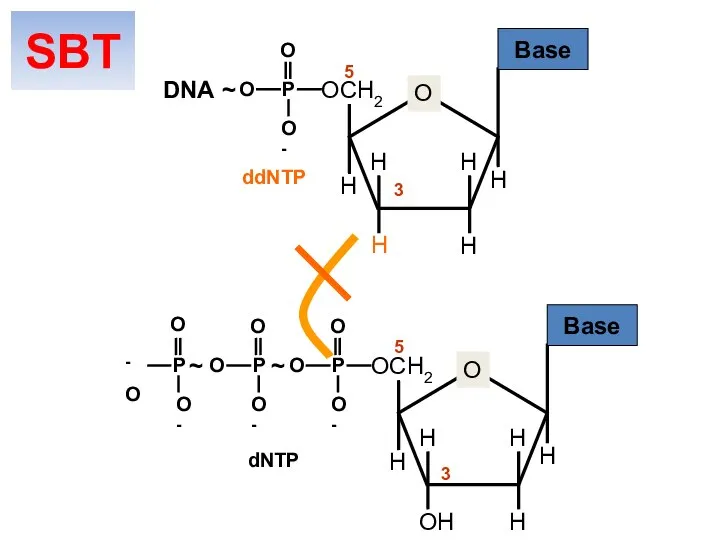
- 30. O OCH2 H H H H H P O O O- ~ Base O OCH2 H
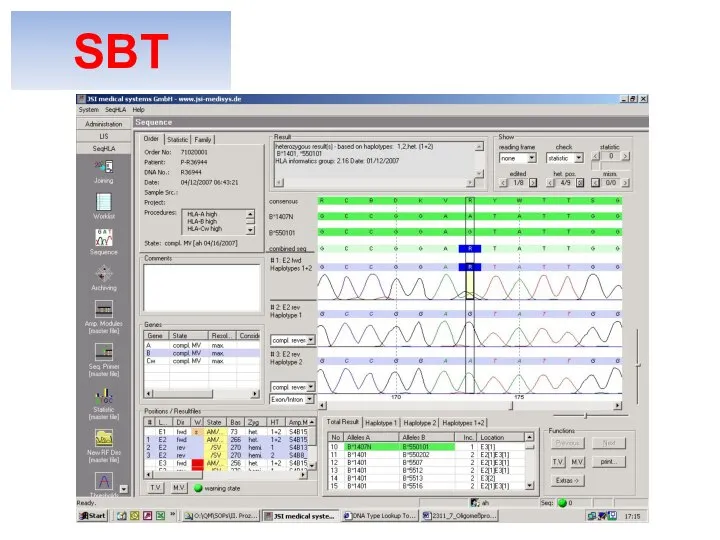
- 31. SBT (sequencing based typing) ГЕНОТИПИРОВАНИЕ SBT
- 32. Только с помощью SBT возможно определение новых аллелей (в мире ежегодно открываются порядка 500 новых аллелей
- 33. Exon 2 Exon 3 Exon 2 Exon 2 Exon 2 + 3 для HLA class I
- 34. ОГРАНИЧЕНИЕ МЕТОДОВ Искусство производства наборов SSP – создание многообразия высокоспецифичных праймеров; наборов SSO – специфичных олигонуклеотидов,
- 35. Искусство типирования методом SBT заключается в технической точности выполнения исследования для получения «чистого» ссиквенса, который отображает
- 36. SBT
- 37. Стоимость SBT SSO SSP Serology > > >
- 39. Скачать презентацию

















 Развитие науки Вторая половина XIX века
Развитие науки Вторая половина XIX века Финансовая грамотность дошкольников
Финансовая грамотность дошкольников Встречают по одежке. Дизайн современной одежды
Встречают по одежке. Дизайн современной одежды Проекты использования генераторного газа в коммунальной теплоэнергетике
Проекты использования генераторного газа в коммунальной теплоэнергетике Профессия бухгалтер
Профессия бухгалтер День 4. Применять возрождение на практике
День 4. Применять возрождение на практике История сварочного дела. Славянов Николай Гаврилович
История сварочного дела. Славянов Николай Гаврилович КВАДРАНТ КИЙОСАКИ
КВАДРАНТ КИЙОСАКИ Быстрые методы гигиенического мониторинга
Быстрые методы гигиенического мониторинга Каменная соль – чудо-минерал
Каменная соль – чудо-минерал "Воспитание толерантности"
"Воспитание толерантности" АВТОМАТИЗАЦИЯ ЗВУКА Р, Рь В СЛОВАХ
АВТОМАТИЗАЦИЯ ЗВУКА Р, Рь В СЛОВАХ ЦЕЛЬ: РАСШИРИТЬ ЗНАНИЕ УЧАЩИХСЯ О ПРАВИЛЬНОМ ПИТАНИИ
ЦЕЛЬ: РАСШИРИТЬ ЗНАНИЕ УЧАЩИХСЯ О ПРАВИЛЬНОМ ПИТАНИИ Подготовка к ВПР (№ 8) (геометрические задания). Математика. УМК: любой. 6 класс
Подготовка к ВПР (№ 8) (геометрические задания). Математика. УМК: любой. 6 класс Жизнь и творчество Д.Н.Ушакова
Жизнь и творчество Д.Н.Ушакова SELFLLERY Рынок цифровой фотографии
SELFLLERY Рынок цифровой фотографии Соблюдение лицензионных требований в сфере телерадиовещания
Соблюдение лицензионных требований в сфере телерадиовещания LR5_1ch__Stoimostnye_kharakteristiki_informatsionnoy_deyatelnosti
LR5_1ch__Stoimostnye_kharakteristiki_informatsionnoy_deyatelnosti Земля отцов – моя земля (из истории местных географических названий)
Земля отцов – моя земля (из истории местных географических названий) Движение
Движение Бораны и карбораны
Бораны и карбораны Время глагола
Время глагола походами ходили
походами ходили Компьютер Что это такое?
Компьютер Что это такое? Международный день чая
Международный день чая Декоративное убранство русского северного дома
Декоративное убранство русского северного дома Александр Солженицын
Александр Солженицын Совет единомышленников ГБОУ СОШ № 2001
Совет единомышленников ГБОУ СОШ № 2001