Содержание
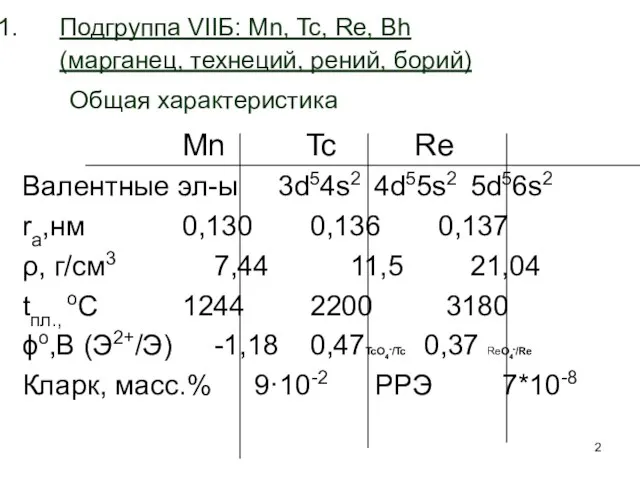
- 2. Подгруппа VIIБ: Mn, Tc, Re, Bh (марганец, технеций, рений, борий) Общая характеристика Mn Tc Re Валентные
- 3. Природные cоединения Mn: MnO2 - пиролюзит Tc: первый элемент, полученный искусственно (1937 г.), предсказан Д.И.Менделеевым в
- 4. Получение металлов Mn Сплав ферромарганец (Mn + Fe): MnO2 + Fe2O3 + C → (Mn +
- 5. Степени окисления Возможные: +2 +3 +4 +5 +6 +7 Характерные: Mn +2 +4 +6 +7 Tc,
- 6. Химические свойства металлов Э + Г2 → MnF3, MnF4, ReF6, ReCl5 Mn + O2 → MnO2
- 7. Химические свойства металлов Взаимодействие с кислотами Mn + HCl (H2SO4 разб.) → Re (Tc) + HCl,
- 8. Химические свойства металлов Re (Tc) + HNO3 → + NO + H2O (t) Re (Tc) +
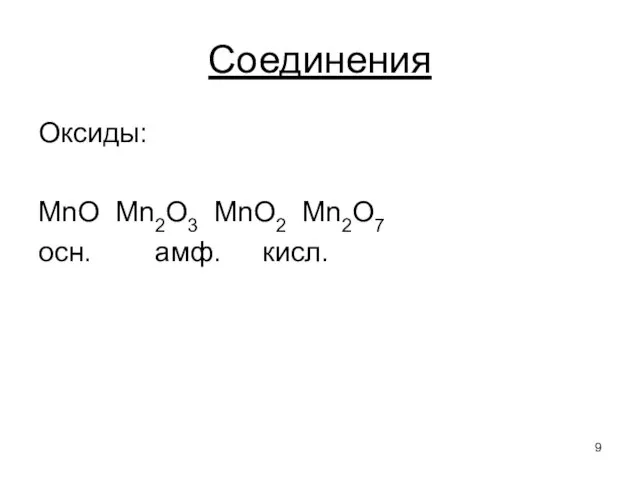
- 9. Оксиды: MnO Mn2O3 MnO2 Mn2O7 осн. амф. кисл. Соединения
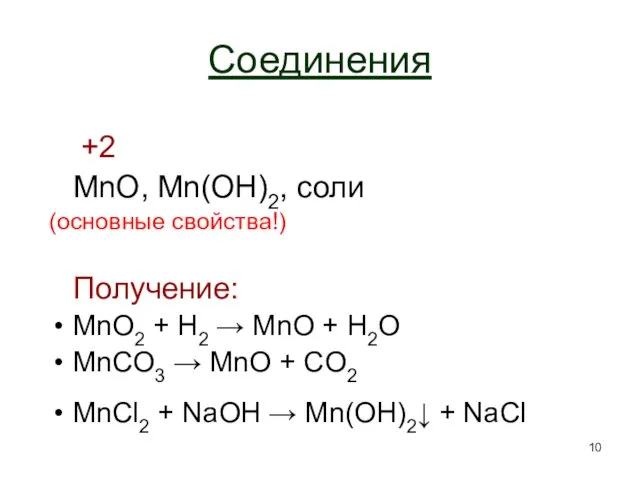
- 10. Соединения +2 MnO, Mn(OH)2, соли (основные свойства!) Получение: MnO2 + H2 → MnO + H2O MnCO3
- 11. Характерные соединения Свойства: MnO + HCl → MnCl2 + H2O Mn(OH)2 + HCl → … MnO,
- 12. Характерные соединения +3 Mn2O3 Получение: MnO2 → Mn2O3 + O2 (500oC) Свойства: Mn2O3 + H2SO4(р) →
- 13. Характерные соединения +4 MnO2, TcO2, ReO2 - черные Получение: MnO2 – пиролюзит NH4ReO4 → ReO2 +
- 14. Характерные соединения Свойства: MnO2 – химически инертен (высокая Eк.р.) MnO2 – амфотерен MnO2 + NaOH →
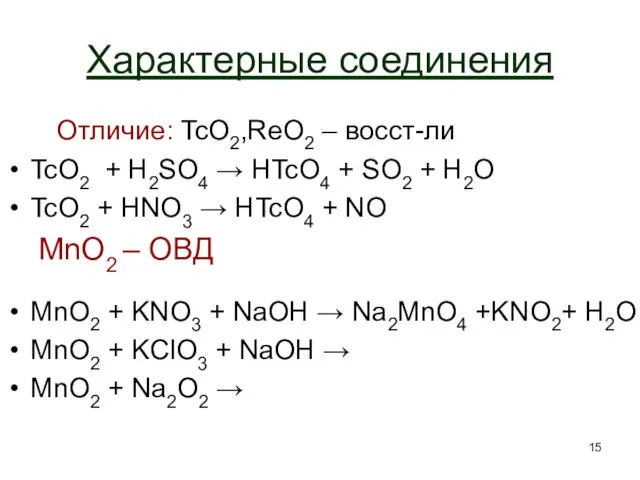
- 15. Характерные соединения Отличие: TcO2,ReO2 – восст-ли TcO2 + H2SO4 → HTcO4 + SO2 + H2O TcO2
- 16. Характерные соединения +6 Оксиды MnO3 TcO3 ReO3 не сущ. ув-ся устойчивость Получение: Re2O7 (Tc2O7) + Re→
- 17. Характерные соединения Кислоты, соли MnO42- TcO42- ReO42- манганат технат ренат Получение: KЭO4 + K2SO3 + KOH
- 18. Характерные соединения Свойства: Ионы стабильны в щелочной среде: ЭO42- + H2O → ЭO4- + ЭO2 +
- 19. Характерные соединения +7 Оксиды Mn2O7 Tc2O7 Re2O7 tпл.оС 6 120 301 красный желтый желтый не устойчив
- 20. Характерные соединения Свойства: Mn2O7 → MnO2 + O2 (55оС) Mn2O7 + С2H5OH → MnO2 + CO2
- 21. Характерные соединения Кислоты, соли MnO4- TcO4- ReO4- перманганат пертехнат перренат HMnO4 – существует в р-рах с
- 22. Характерные соединения Получение KMnO4 В промышленности: 1) MnO2 + KOH + O2 → K2MnO4 + H2O
- 23. Характерные соединения HMnO4 – сильная кислота (как HCl), не устойчивая Перманганаты – термически неустойчивы KMnO4 →
- 25. Скачать презентацию


















 Специальные диеты в спорте
Специальные диеты в спорте Правила для велосипедистов
Правила для велосипедистов ООО «ЭнергоСеть»
ООО «ЭнергоСеть» Финансовая поддержка Гранта. Правительство Кировской области с участием министерства финансов Кировской области
Финансовая поддержка Гранта. Правительство Кировской области с участием министерства финансов Кировской области возникновение страхового дела
возникновение страхового дела РЕАЛИЗАЦИЯ ЭНЕРГОСЕРВИСНЫХ КОНТРАКТОВ В БЮДЖЕТНОЙ СФЕРЕ
РЕАЛИЗАЦИЯ ЭНЕРГОСЕРВИСНЫХ КОНТРАКТОВ В БЮДЖЕТНОЙ СФЕРЕ САЛОН
САЛОН Ребрендинг волонтёрского центра ЮФУ
Ребрендинг волонтёрского центра ЮФУ Проект межрегионального единого координационногоцентра помощи освободившимся заключённым
Проект межрегионального единого координационногоцентра помощи освободившимся заключённым 498 Примкните к Иисусу
498 Примкните к Иисусу Моя семья в годы Великой Отечественной войны
Моя семья в годы Великой Отечественной войны Popular British holidays
Popular British holidays ПРАКТИЧЕСКИЕ ИНСТРУМЕНТЫ НОРМИРОВАНИЯ ПРОИЗВОДСТВЕННОГО И ОФИСНОГО ПЕРСОНАЛА
ПРАКТИЧЕСКИЕ ИНСТРУМЕНТЫ НОРМИРОВАНИЯ ПРОИЗВОДСТВЕННОГО И ОФИСНОГО ПЕРСОНАЛА Литературное чтение
Литературное чтение Сказки в произведениях русских художников
Сказки в произведениях русских художников Финансирование мероприятий общественных студенческих организаций КФУ
Финансирование мероприятий общественных студенческих организаций КФУ Солина Наталья Викторовна М.О.У.С.Ш.79 Содержание a Возбудитель. b Переносчики. c Пути передачи. d Клиника e Профилактика f Диаграммы g Ла
Солина Наталья Викторовна М.О.У.С.Ш.79 Содержание a Возбудитель. b Переносчики. c Пути передачи. d Клиника e Профилактика f Диаграммы g Ла Защиты от уголовного преследования в США
Защиты от уголовного преследования в США В городе богини Афины
В городе богини Афины Презентация на тему Куприн "Слон" 3 класс
Презентация на тему Куприн "Слон" 3 класс ПРОГНОЗИРОВАНИЕ КУРСОВ ВАЛЮТ С ИСПОЛЬЗОВАНИЕМ НЕЙРОСЕТЕВЫХ ТЕХНОЛОГИЙ
ПРОГНОЗИРОВАНИЕ КУРСОВ ВАЛЮТ С ИСПОЛЬЗОВАНИЕМ НЕЙРОСЕТЕВЫХ ТЕХНОЛОГИЙ Право преимущественной покупки доли (части доли) участника в уставном фонде общества с ограниченной ответственностью
Право преимущественной покупки доли (части доли) участника в уставном фонде общества с ограниченной ответственностью Презентация на тему Профилактика туберкулеза
Презентация на тему Профилактика туберкулеза  Распятие. Иконостас Благовещенского собора Московского Кремля. 1405 год
Распятие. Иконостас Благовещенского собора Московского Кремля. 1405 год Презентация на тему Урок литературного чтения А.П.Чехов «Каштанка» 4 класс
Презентация на тему Урок литературного чтения А.П.Чехов «Каштанка» 4 класс НОМИНАЦИЯ «Добро и Зло»
НОМИНАЦИЯ «Добро и Зло» Африка Africa
Африка Africa Табличный процессор Microsoft Excel
Табличный процессор Microsoft Excel