Содержание
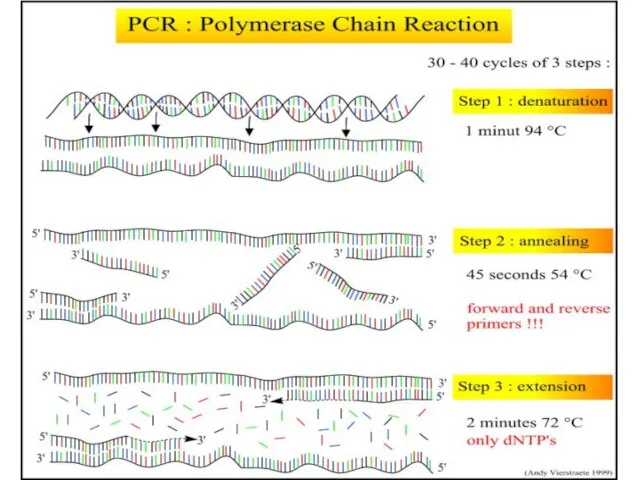
- 2. Что такое ПЦР? Методика для «усиления» (получения многочисленных копий) специфического участка двухцепочной ДНК. В ходе ПЦР-реакции
- 3. Компоненты ПЦР ДНК-темплейт, например, грубый клеточный экстракт, общая геномная ДНК, плазмидная ДНК и т.д. (нанограммы)
- 6. ? Историческая перспектива I метод был предложен в 1983 группой, работающей в Корпорации Cetus. Кэри Муллиз
- 8. Изоляция Taq-ДНК-полимеразы Источник: Thermus aquaticus Ключевое свойство: термостабильность Применение Taq в ПЦР было впервые описано:
- 10. Технические аспекты ПЦР ❶ Дизайн праймеров ❷ Температура ренатурации (отжига) ❸ Предотвращение загрязнения ❹ Число ПЦР-циклов
- 11. ❶ Дизайн праймеров сбаллансированная точка плавления Tm для обоих праймеров. Tm = (A+T) x 2 +
- 12. ❷ Температура ренатурации (отжига) обычно на 5 градусов ниже температуры плавления данных праймеров (5°C) Более высокая
- 13. ❸ Предотвращение загрязнения Контроль реагентов - используется только стерильная деионизованная или дистиллированная вода стерильная пластиковая посуда
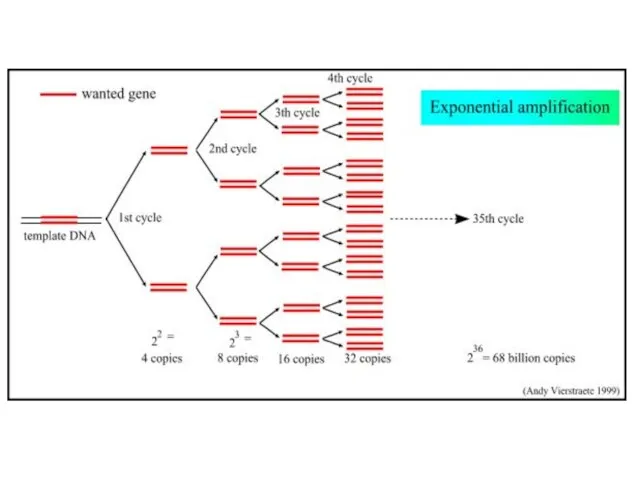
- 14. ❹ Число ПЦР-циклов С увеличением кол-ва ПЦР-циклов ☺ + растет кол-во (“урожай”) ДНК ☹ - растут
- 15. ❺ Концентрация Mg2+ увеличение [Mg2+] приводит к: ? повышению стрингетности (четкости гибридизации) ? снижению кол-ва синтезируемых
- 16. ❻ Выбор полимеразы Taq-полимеразы : Преимущества: ☺ Высокий «урожай» (выход НК) ☺ Taq-полимераза добавляет A
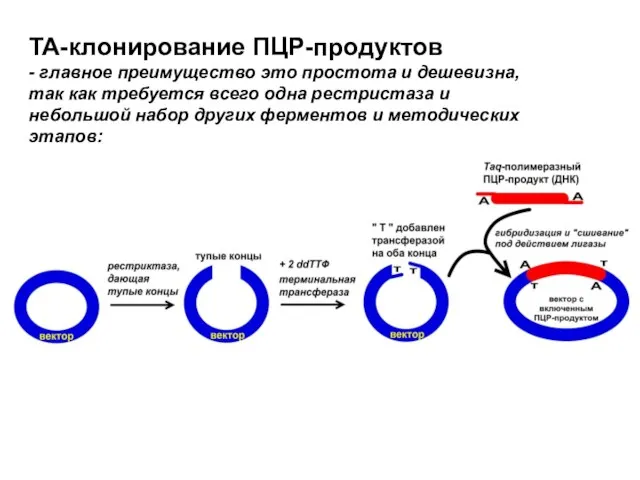
- 17. TA-клонирование ПЦР-продуктов - главное преимущество это простота и дешевизна, так как требуется всего одна рестристаза и
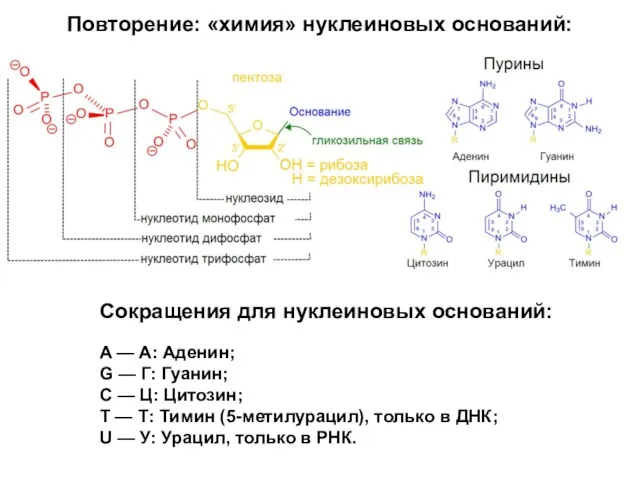
- 18. Сокращения для нуклеиновых оснований: A — А: Аденин; G — Г: Гуанин; C — Ц: Цитозин;
- 19. Вариации на тему ПЦР: производные протоколы ❶ ПЦР из РНК – при помощи обратной транскриптазы ❷
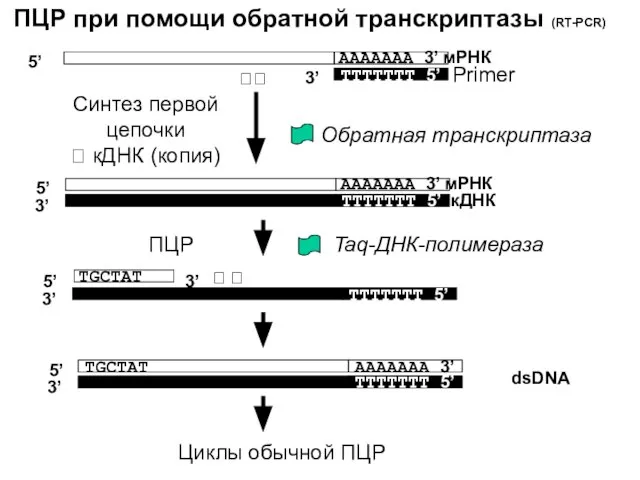
- 20. ПЦР при помощи обратной транскриптазы (RT-PCR) 5’ AAAAAAA 3’ мРНК TTTTTTT 5’ Primer AAAAAAA 3’ мРНК
- 21. Области применения: Позволяет получить подтверждение того, что определенный ген экспрессируется, при том даже если экспрессия очень
- 22. Оптимизация ПЦР Hot-start ПЦР (горячий старт) Реакция удерживается на «ДНК-денатурирующей температуре до добавления ферментов и
- 23. Оптимизирование ПЦР Long PCR (продолжительная ПЦР) Taq-ДНК-полимераза обычно ограничена синтезом 5000 оснований поэтому ее комбинируют
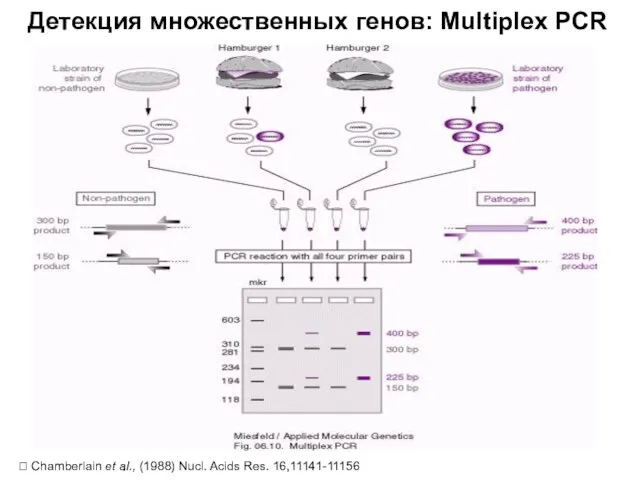
- 24. Детекция множественных генов: Multiplex PCR Chamberlain et al., (1988) Nucl. Acids Res. 16,11141-11156
- 25. Количественный анализ НК при помощи ПЦР Многочисленные «неточности» делают процесс количественного ПЦР-анализа проблематичным 3 подхода: a)
- 26. ПЦР in situ ПЦР внутри клетки обычно это фиксированный на предметной стекле клеточный экстракт
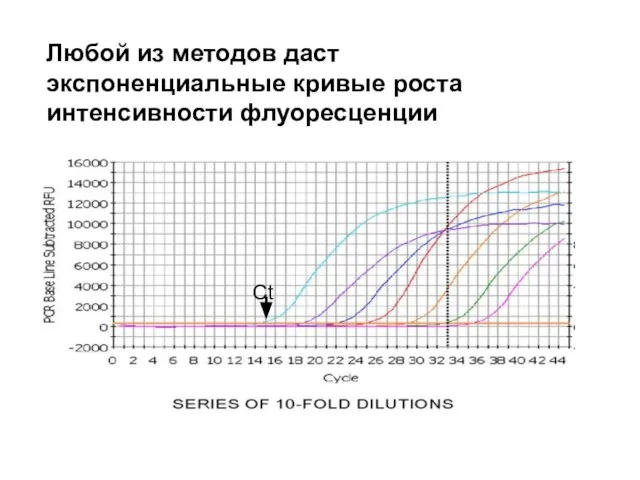
- 27. Количественный ПЦР – анализ данных В основе лежит флуоресценция, возрастающая по ходу ПЦР-эксперимента: С использованием флуоресцентного
- 28. Use of Taqman probes relies on a third primer (called the probe) labelled at the 5’
- 29. Любой из методов даст экспоненциальные кривые роста интенсивности флуоресценции Ct
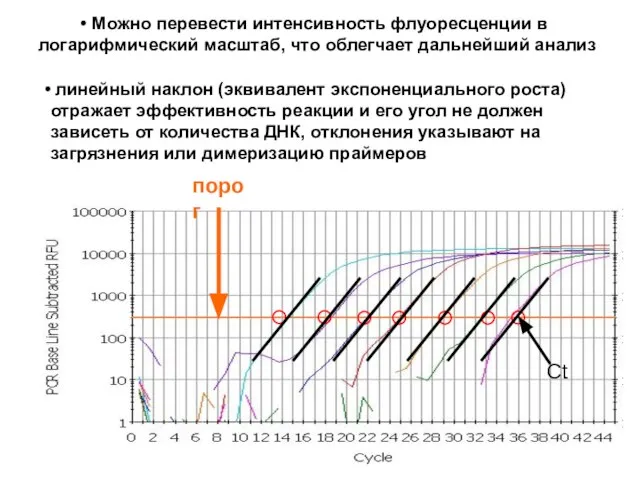
- 30. Можно перевести интенсивность флуоресценции в логарифмический масштаб, что облегчает дальнейший анализ
- 31. Методы нормализации Обычно это нормализация ампликона ДНК или мРНК относительно гена-стандарта Например, когда требуется подсчитать мРНК
- 32. Уровни ДНК и РНК тестируемого гена могут быть вычислены относительно двух различных условий (например, в контроле
- 33. The final test versus control level of a DNA or mRNA molecule normalised for a reference
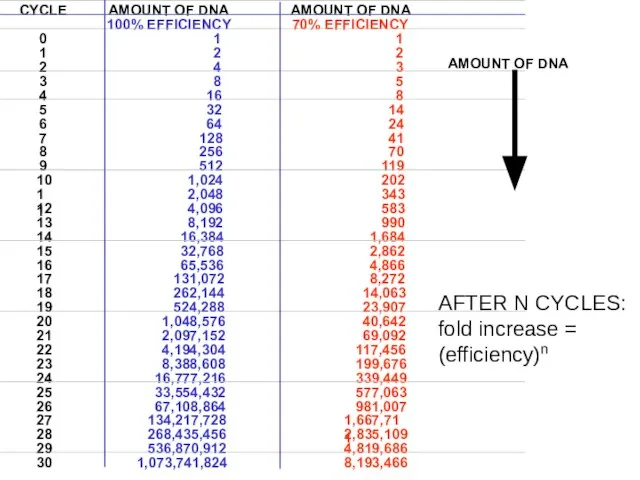
- 34. AFTER N CYCLES: fold increase = (efficiency)n CYCLE AMOUNT OF DNA AMOUNT OF DNA 100% EFFICIENCY
- 35. Cycle efficiency (E) for a primer pair can be calculated from the log of the slope
- 37. Скачать презентацию











![❺ Концентрация Mg2+ увеличение [Mg2+] приводит к: ? повышению стрингетности (четкости гибридизации)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/378026/slide-14.jpg)













 Магазин спортивной одежды и спортинвентаря для фабрики предпринимательства
Магазин спортивной одежды и спортинвентаря для фабрики предпринимательства Риск в производственном менеджменте
Риск в производственном менеджменте Мировые культуры и межкультурные коммуникации. Лекция 7
Мировые культуры и межкультурные коммуникации. Лекция 7 Нарушения углеводного обмена
Нарушения углеводного обмена Лекция_6 ЭТД ФТД.ppt
Лекция_6 ЭТД ФТД.ppt Особенности русской живописи XIX века
Особенности русской живописи XIX века Национальные костюмы народов России
Национальные костюмы народов России Тест по психологии
Тест по психологии Общество и культура
Общество и культура Презентация на тему Автограф
Презентация на тему Автограф Peter Paul Rubens (1577 -1640)
Peter Paul Rubens (1577 -1640) Русские народные праздники
Русские народные праздники Жизнь и творчество И.С.Тургенева 1818 -1883
Жизнь и творчество И.С.Тургенева 1818 -1883 курсач
курсач Угадай-ка по картинам. Для 5-7 классов
Угадай-ка по картинам. Для 5-7 классов Дипломная работа: «Учет и анализ оплаты труда и расчетов с рабочими и служащими (на материалах «УЗ 9-ая городская клиническая больн
Дипломная работа: «Учет и анализ оплаты труда и расчетов с рабочими и служащими (на материалах «УЗ 9-ая городская клиническая больн День отца
День отца Creetings nohg
Creetings nohg Презентация на тему Мир дельфинов
Презентация на тему Мир дельфинов Презентация на тему Развивающее обучение что это такое
Презентация на тему Развивающее обучение что это такое  Конструктивные схемы каркасных гражданских зданий. Область применения
Конструктивные схемы каркасных гражданских зданий. Область применения «Наши таланты».
«Наши таланты». Аудитория Интернета
Аудитория Интернета Электроустановки и электрические сети
Электроустановки и электрические сети 1
1 Круглый стол д.э.н., проф. Кузнецовой О.Д.
Круглый стол д.э.н., проф. Кузнецовой О.Д. Razvitie_ponyatia_o_chisle_Tselye_i_ratsionalnye_chisla_Deystvitelnye_chisla
Razvitie_ponyatia_o_chisle_Tselye_i_ratsionalnye_chisla_Deystvitelnye_chisla 1
1