Содержание
- 2. Атомы (или молекулы), примыкающие к поверхности, ограничивающей конденсированную фазу, отличаются от расположенных в объеме той же
- 3. Класс поверхностных явлений К классу поверхностных явлений относятся: адсорбция и гетерогенный катализ; образование двойного электрического слоя;
- 4. Понятие адсорбции и адсорбционная терминология Одной из важнейших особенностей поверхности раздела фаз, обусловленных наличием нескомпенсированного силового
- 5. Еще несколько терминов Адсорбентом называют вещество, на котором происходит адсорбция; Адсорбатом называют уже адсорбированное вещество, находящееся
- 6. Общая характеристика межмолекулярного взаимодействия при физадсорбции Адсорбированные молекулы взаимодействуют с молекулами или атомами поверхности и снижают
- 7. Адсорбционные силы При физической адсорбции между молекулами действуют молекулярные ван-дер-ваальсовы силы. Они могут быть трех видов:
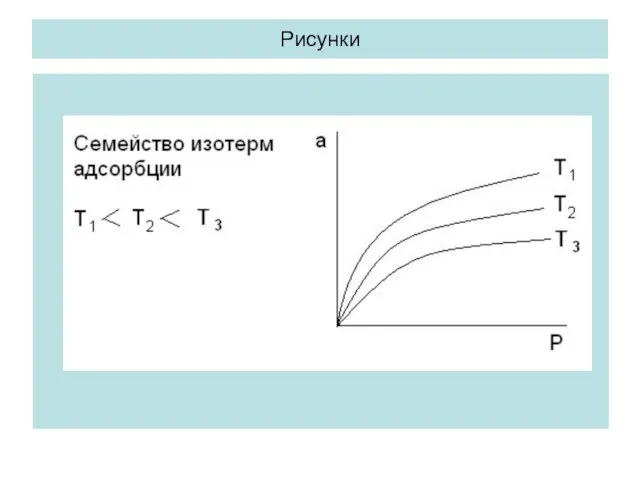
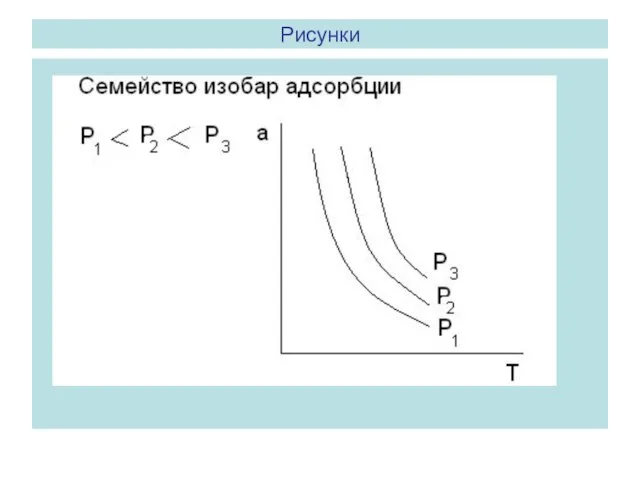
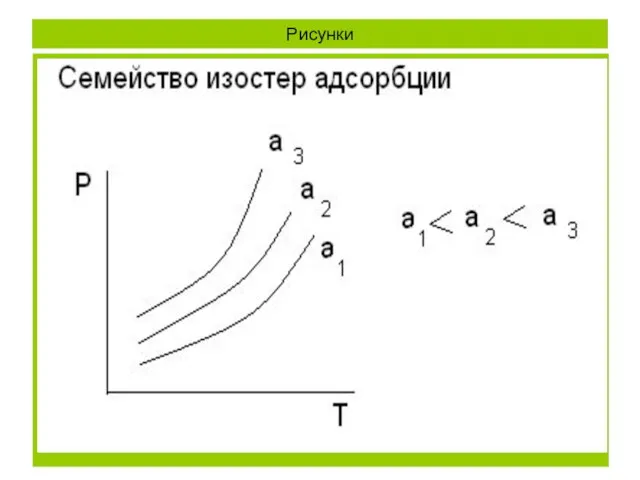
- 8. Адсорбция как функция 2-х переменных. Изотермы, изобары и изостеры адсорбции. Адсорбцию выражают обычно в моль/г адсорбента
- 9. Рисунки
- 10. Рисунки
- 11. Рисунки
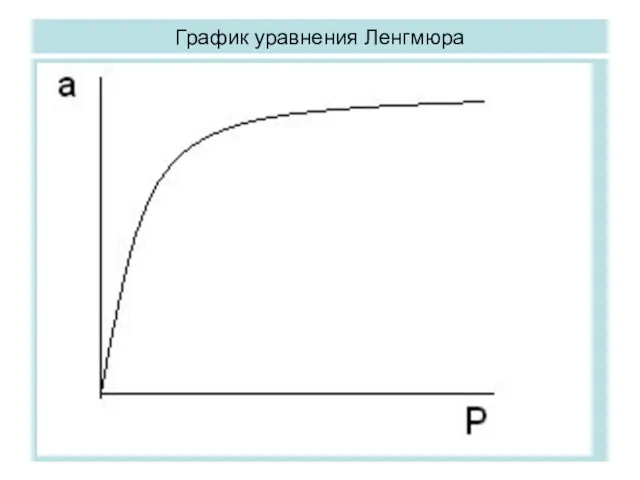
- 12. Уравнения изотермы адсорбции Ленгмюра Первое теоретическое уравнение изотермы адсорбции было предложено в 1914 г. Ирвингом Ленгмюром
- 13. Вывод уравнения изотермы адсорбции Ленгмюра На основе этих трех положений можно различными путями вывести уравнение ИА.
- 14. Вывод уравнения Ленгмюра (прдолжение) kad p (am – a) = kdesorb a Обозначим kad / kdesorb
- 15. График уравнения Ленгмюра
- 16. Термодинамика поверхностных избытков Гиббса. Уравнение адсорбции Гиббса. Существуют два принципиально разных подхода в построении термодинамики поверхностных
- 17. Адсорбция по Гиббсу (продолжение) концентрации в обеих сосуществующих фазах были бы постоянны вплоть до некоторой геометрической
- 19. Скачать презентацию












 Бессмертная комедия А. С. Грибоедова «Горе от ума»
Бессмертная комедия А. С. Грибоедова «Горе от ума» Урок коллективного посещения в 5 классе
Урок коллективного посещения в 5 классе ПЕДАГОГИЧЕСКИЙ СОВЕТОДАРЁННЫЕ ДЕТИ: реалии, проблемы, перспективы.
ПЕДАГОГИЧЕСКИЙ СОВЕТОДАРЁННЫЕ ДЕТИ: реалии, проблемы, перспективы. Ранения. Первая медицинская помощь
Ранения. Первая медицинская помощь Совершенствование сервисно-транспортной инфраструктуры придомовых территорий
Совершенствование сервисно-транспортной инфраструктуры придомовых территорий СТЕКЛЯННЫЕ ТОВАРЫ
СТЕКЛЯННЫЕ ТОВАРЫ Применение электролиза. Основная химическая промышленность
Применение электролиза. Основная химическая промышленность Маршрут прогулки по городу Борисоглебск
Маршрут прогулки по городу Борисоглебск Региональный студенческий хакатон ООО АИС город
Региональный студенческий хакатон ООО АИС город Берегите зрение
Берегите зрение Конкурентные преимущества и перспективы развития казахстанского фондового рынка
Конкурентные преимущества и перспективы развития казахстанского фондового рынка Древние восточные церкви. Православие за рубежом в xх – xxi вв
Древние восточные церкви. Православие за рубежом в xх – xxi вв Pro-психологов: психологическая служба образовательной организации
Pro-психологов: психологическая служба образовательной организации ST Main Page
ST Main Page Лекарственная аллергия
Лекарственная аллергия Знаковые модели. Моделирование и формализация
Знаковые модели. Моделирование и формализация Развитие координационных способностей у юных борцов вольного стиля
Развитие координационных способностей у юных борцов вольного стиля Диплом партнёра центра спортивного комплексного обучения по хоккею г. Сморгони
Диплом партнёра центра спортивного комплексного обучения по хоккею г. Сморгони МЕТОДИКА ПРОВЕДЕНИЯ КОРРЕКЦИОННЫХ ЗАНЯТИЙ
МЕТОДИКА ПРОВЕДЕНИЯ КОРРЕКЦИОННЫХ ЗАНЯТИЙ Политический конфликт
Политический конфликт Чемпионат и первенство города Ярославля по зимнему триатлону
Чемпионат и первенство города Ярославля по зимнему триатлону AI автомобиля в изменчивом мире на примере Ex Machina
AI автомобиля в изменчивом мире на примере Ex Machina Восприятие речи
Восприятие речи Конаково
Конаково Сударыня - Масленица
Сударыня - Масленица Візуальний контакт під час ділової комунікації
Візуальний контакт під час ділової комунікації Технологии проведения избирательной кампании
Технологии проведения избирательной кампании Общественная организацияг.Балаково Саратовской области«Попечительский совет средней школы №11»
Общественная организацияг.Балаково Саратовской области«Попечительский совет средней школы №11»