Содержание
- 2. 7.5. Закон Максвелла о распределении молекул идеального газа по скоростям Закон Максвелла описывает функцию f(v), которая
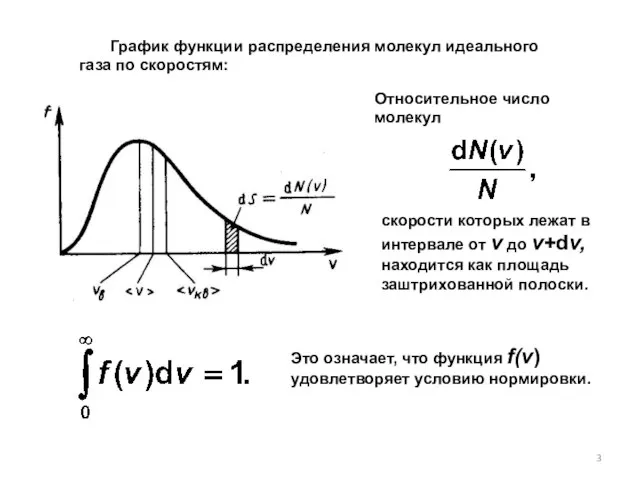
- 3. График функции распределения молекул идеального газа по скоростям: скорости которых лежат в интервале от v до
- 4. Наиболее вероятная скорость молекулы. При повышении температуры максимум функции распределения молекул по скоростям сместится вправо. Вероятной
- 5. Средняя скорость молекулы : Cредняя квадратичная скорость молекулы:
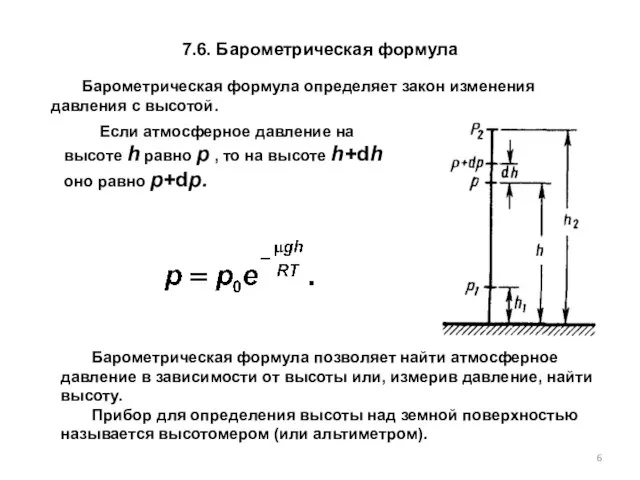
- 6. 7.6. Барометрическая формула Барометрическая формула позволяет найти атмосферное давление в зависимости от высоты или, измерив давление,
- 7. 7.7. Распределение Больцмана где n – концентрация молекул на высоте h, n0 – то же, на
- 8. 7.8. Средняя длина свободного пробега молекул Между столкновениями молекулы проходят некоторый путь l, который называется длиной
- 9. Среднее число столкновений за 1 с равно: п — концентрация молекул, V = π d2 ,
- 10. 7.9. Эксперименты, подтверждающие молекулярно-кинетическую теорию 1. Броуновское движение. Шотландский ботаник Роберт Броун (1773—1858). Интенсивность этого движения,
- 11. 2. Опыт Штерна. О. Штерн – немецкий физик (1888—1970). Вдоль оси внутреннего цилиндра с щелью натянута
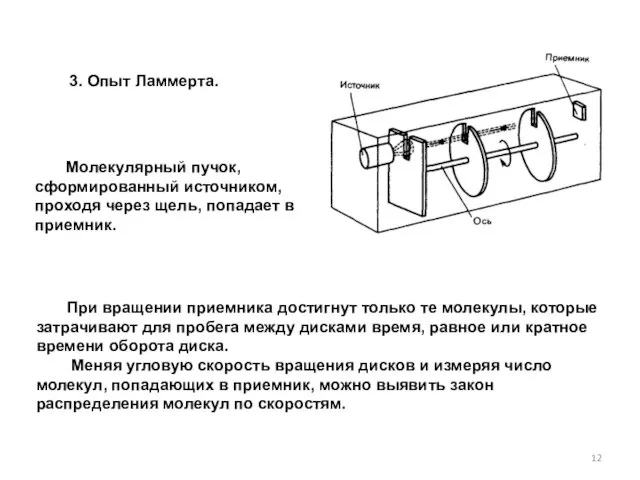
- 12. 3. Опыт Ламмерта. Молекулярный пучок, сформированный источником, проходя через щель, попадает в приемник. При вращении приемника
- 13. 7.10. Явления переноса в термодинамических неравновесных системах Явлениями переноса называют такие необратимые процессы в термодинамически неравновесных
- 14. 1. Теплопроводность. Если в одной области газа средняя кинетическая энергия молекул больше, чем в другой, то
- 15. — удельная теплоемкость газа при постоянном объеме (количество теплоты, необходимое для нагревания 1 кг газа на
- 16. 2. Диффузия. Диффузия – самопроизвольное проникновение и перемешивание частиц двух соприкасающихся газов, жидкостей или твердых тел.
- 17. Диффузия D численно равна плотности потока массы при градиенте плотности, равном единице. Согласно кинетической теории газов:
- 18. 3. Внутреннее трение (вязкость). Из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего
- 19. — градиент скорости. Знак минус указывает, что импульс переносится в направлении убывания скорости Динамическая вязкость η
- 20. 8. Основы термодинамики При переходе системы из одного состояния в другое изменение внутренней энергии определяется только
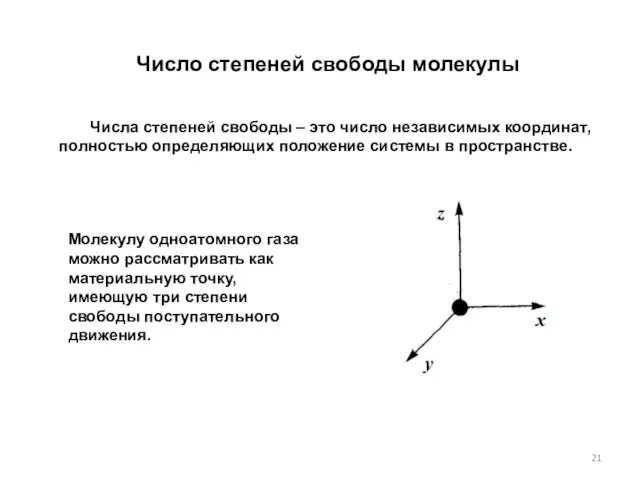
- 21. Число степеней свободы молекулы Числа степеней свободы – это число независимых координат, полностью определяющих положение системы
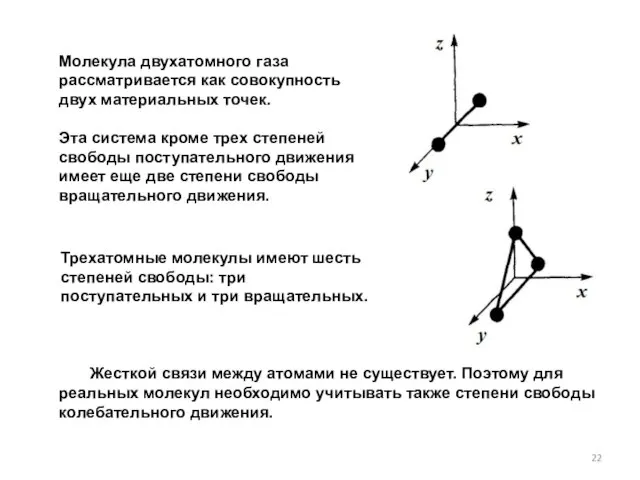
- 22. Молекула двухатомного газа рассматривается как совокупность двух материальных точек. Эта система кроме трех степеней свободы поступательного
- 23. Независимо от общего числа степеней свободы молекул три степени свободы всегда поступательные. На каждую из них
- 24. 8.2. Закон Больцмана о равномерном распределении энергии по степеням свободы молекул Cредняя энергия молекулы равна: i
- 25. Внутренняя энергия, отнесенная к одному молю газа, будет равна сумме кинетических энергий NA молекул: Внутренняя энергия
- 26. 8.3. Первое начало термодинамики Первое начало термодинамики характеризует закон сохранения энергии при изменении состояния системы. Существует
- 27. Первое начало термодинамики в дифференциальной форме: dU — бесконечно малое изменение внутренней энергии системы, δA —
- 28. т. е. «вечный двигатель первого рода — периодически действующий двигатель, который совершал бы большую работу, чем
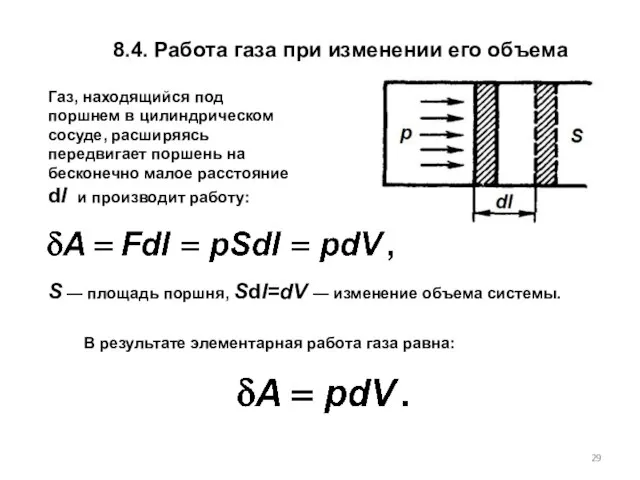
- 29. 8.4. Работа газа при изменении его объема Газ, находящийся под поршнем в цилиндрическом сосуде, расширяясь передвигает
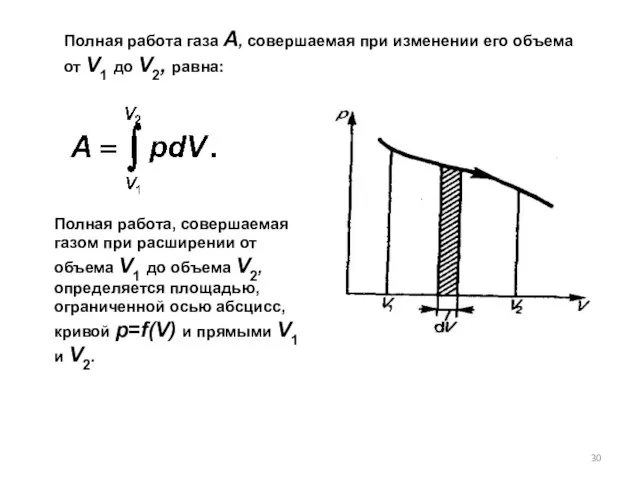
- 30. Полная работа газа А, совершаемая при изменении его объема от V1 до V2, равна: Полная работа,
- 31. 8.5. Теплоемкость Удельная теплоемкость вещества — величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества
- 32. Теплоемкости при постоянном объеме и постоянном давлении различны. Если газ нагревается при постоянном объеме, то работа
- 33. Если газ нагревается при постоянном давлении, то: — уравнение Майера. Дифференцируя уравнение Клапейрона — Менделеева pVm=RT
- 34. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на
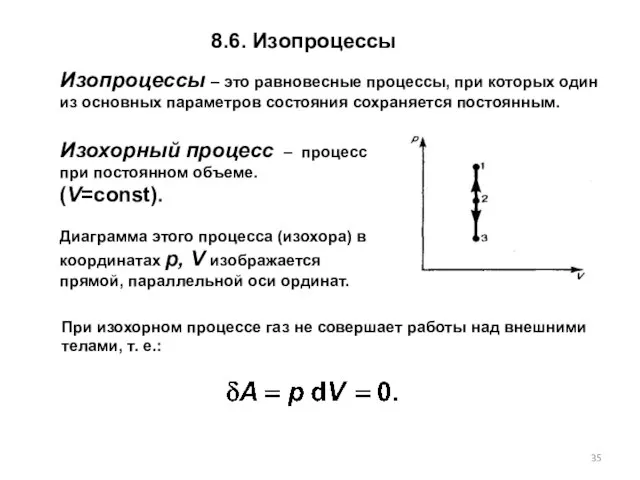
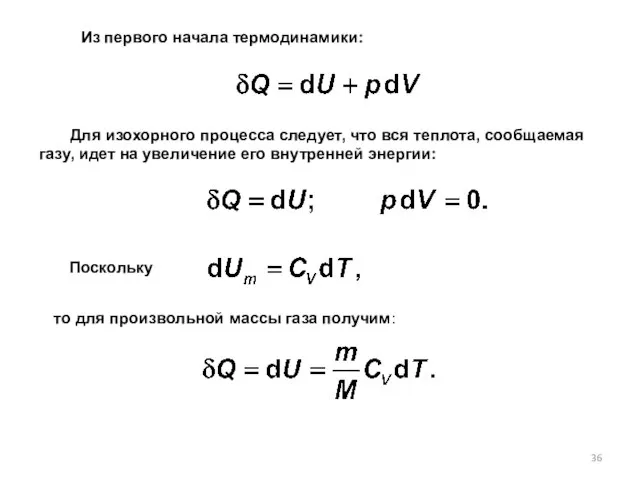
- 35. Изопроцессы – это равновесные процессы, при которых один из основных параметров состояния сохраняется постоянным. Изохорный процесс
- 36. Для изохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии: Поскольку
- 37. Изобарный процесс – процесс при постоянном давлении (p=const). Диаграмма этого процесса (изобара) в координатах р, V
- 38. Если использовать уравнение Клапейрона — Менделеева для выбранных нами двух состояний, то: откуда: Тогда выражение для
- 39. Из предыдущего выражения вытекает физический смысл молярной газовой постоянной R: «если T2 -T1 =1 К, то
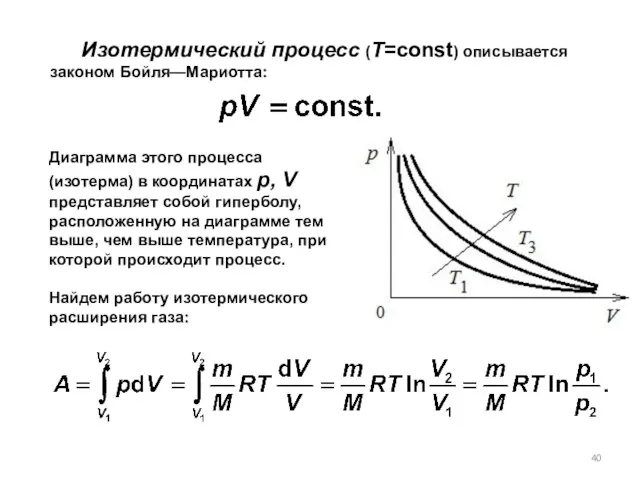
- 40. Изотермический процесс (T=const) описывается законом Бойля—Мариотта: Диаграмма этого процесса (изотерма) в координатах р, V представляет собой
- 41. Так как при Т= const внутренняя энергия идеального газа не изменяется: то из первого начала термодинамики
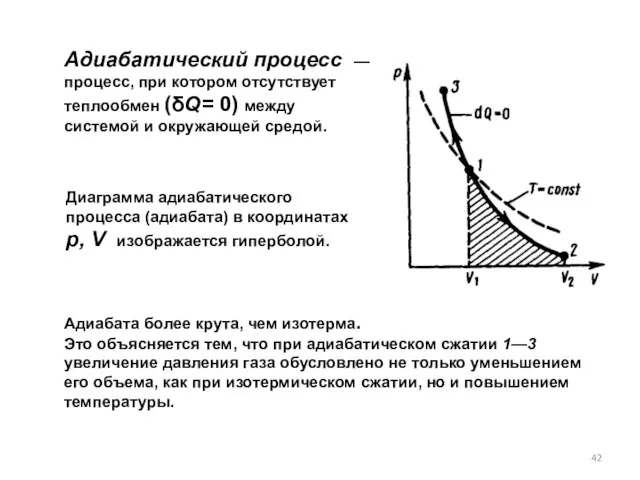
- 42. Адиабатический процесс — процесс, при котором отсутствует теплообмен (δQ= 0) между системой и окружающей средой. Диаграмма
- 43. Из первого начала термодинамики (δQ=dU+δA) для адиабатического процесса следует, что: т. е. внешняя работа совершается за
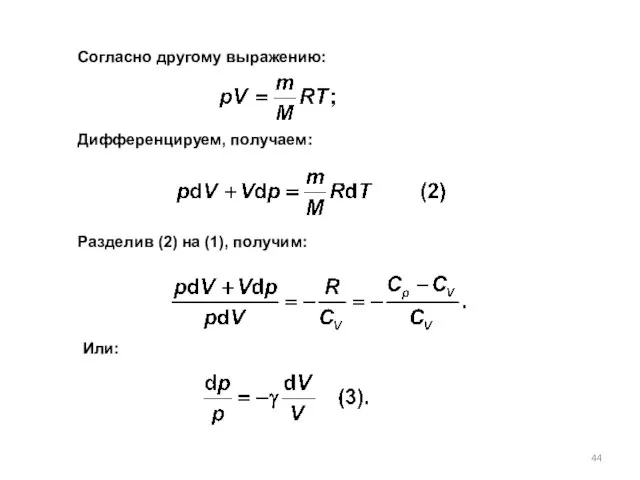
- 44. Разделив (2) на (1), получим: Согласно другому выражению: Дифференцируем, получаем: Или:
- 45. Интегрируя уравнение (3), получим: уравнение адиабатического процесса, уравнение Пуассона. Переходя к переменным Т, V или p
- 46. Рассмотренные процессы происходят при постоянной теплоемкости. В изобарном и изохорном процессах теплоемкости соответственно равны СV и
- 48. Скачать презентацию

































 Отчет
Отчет ГЕОГРАФИЯ
ГЕОГРАФИЯ Школа музыки GUITARDO
Школа музыки GUITARDO Презентация на тему Русская икона. Древнерусская живопись
Презентация на тему Русская икона. Древнерусская живопись Прочитай загадку, найди отгадку
Прочитай загадку, найди отгадку Два художника (Дружба Чехова и Левитана)
Два художника (Дружба Чехова и Левитана) Спирты
Спирты Презентация на тему Час общения «Времена года»
Презентация на тему Час общения «Времена года» Презентация на тему Платоники и Элидо-эритрийская школа
Презентация на тему Платоники и Элидо-эритрийская школа Стратегия муниципальных выборов в новой реальности
Стратегия муниципальных выборов в новой реальности Презентация на тему Этические правила служебного поведения и проф. служебной деятельности гос. гражданских служащих РФ
Презентация на тему Этические правила служебного поведения и проф. служебной деятельности гос. гражданских служащих РФ  НАИМЕНОВАНИЕ ОРГАНИЗАЦИИ КАК ПРЕДМЕТ Васильева Анна Сергеевна зав. сектором электронного каталога отдела научной обработки ф
НАИМЕНОВАНИЕ ОРГАНИЗАЦИИ КАК ПРЕДМЕТ Васильева Анна Сергеевна зав. сектором электронного каталога отдела научной обработки ф Презентация на тему Правила поведения на железной дороге (3 класс)
Презентация на тему Правила поведения на железной дороге (3 класс) ПОЛОЖЕНИЕ о выборах членовМолодежного парламентаМО «Увинский район»
ПОЛОЖЕНИЕ о выборах членовМолодежного парламентаМО «Увинский район» Мастер-класс Изготовление театральной куклы
Мастер-класс Изготовление театральной куклы The Family Law
The Family Law  Бойко Алесандра
Бойко Алесандра Elektron sənəd. Dövri̇yyəsi̇ si̇stemi̇
Elektron sənəd. Dövri̇yyəsi̇ si̇stemi̇ Правовые дебаты: «ЗА» и «ПРОТИВ»
Правовые дебаты: «ЗА» и «ПРОТИВ» Благотворительная программа «Подарим детям сказку»
Благотворительная программа «Подарим детям сказку» ЛУГАНСКАЯ ОБЛАСТЬ, УКРАИНА
ЛУГАНСКАЯ ОБЛАСТЬ, УКРАИНА Направления современной живописи
Направления современной живописи Натрий
Натрий Электронная физкультминутка boom-boom
Электронная физкультминутка boom-boom Царь Иван Грозный
Царь Иван Грозный Размещение рекламы в ВУЗах РФ
Размещение рекламы в ВУЗах РФ Психология общения Берн
Психология общения Берн «Моя математика» 1 класс
«Моя математика» 1 класс