Содержание
- 2. 1896 г. Анри Беккерель (франц.) открыл явление радиоактивности. Радиоактивность – способность атомов к самопроизвольному излучению. 1899
- 3. Опыты Резерфорда 1. В толстостенный свинцовый сосуд положили крупицу радия. Излучение радия обнаружили с помощью фотопластинки.
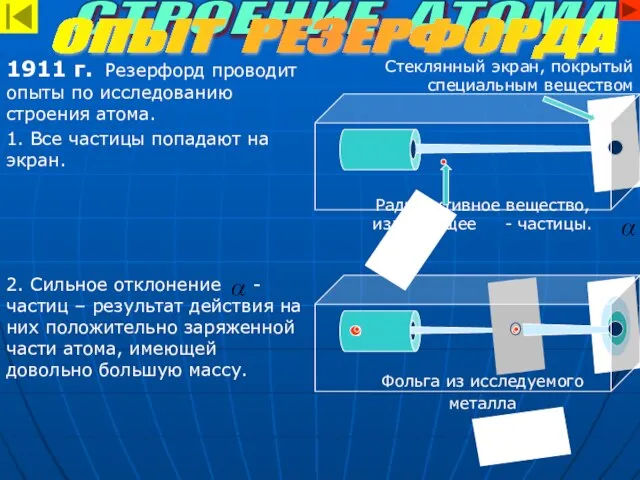
- 4. Стеклянный экран, покрытый специальным веществом Радиоактивное вещество, излучающее - частицы. Фольга из исследуемого металла 1911 г.
- 5. - частицы ядро По Резерфорду атом имеет планетарное строение. В центре находится положительно заряженное ядро. Вокруг
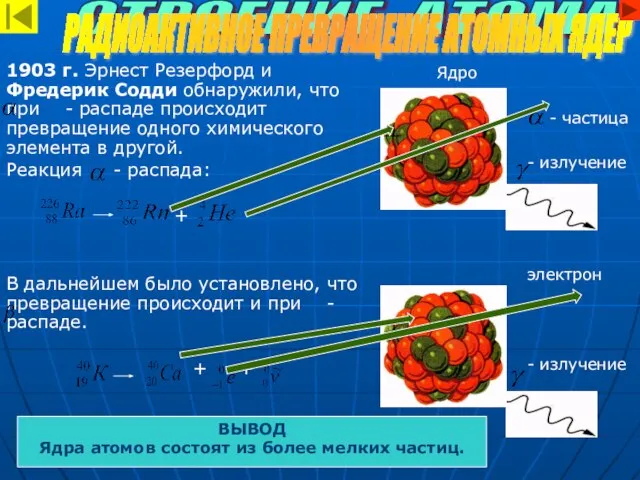
- 6. 1903 г. Эрнест Резерфорд и Фредерик Содди обнаружили, что при - распаде происходит превращение одного химического
- 7. 1919 г. Резерфорд исследовал взаимодействие - частиц с ядрами атомов азота. При этом, из ядра атома
- 8. 1920 г. Резерфорд предполагает существование в ядре нейтральной частицы с массой равной массе протона. В 30-х
- 9. N – число нейтронов 1932 г. Д.Д.Иваненко (рус.), В.Гейзенберг (нем.) предложили протонно-нейтронную модель строения ядра: ядро
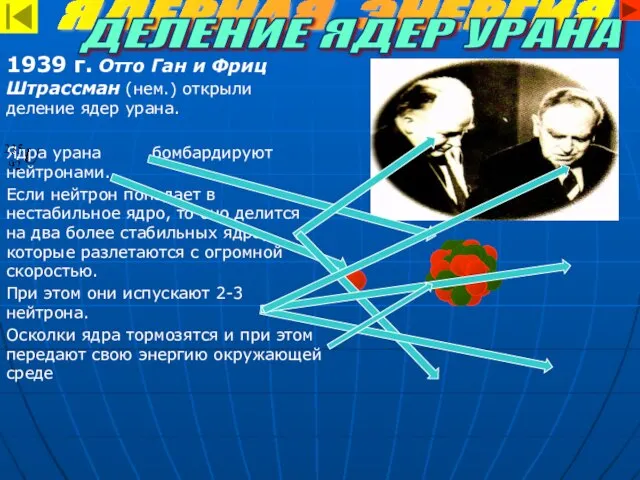
- 10. ЯДЕРНАЯ ЭНЕРГИЯ 1939 г. Отто Ган и Фриц Штрассман (нем.) открыли деление ядер урана. Ядра урана
- 11. ЯДЕРНАЯ ЭНЕРГИЯ ЦЕПНАЯ РЕАКЦИЯ
- 12. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПРОТЕКАНИЕ ЦЕПНОЙ РЕАКЦИИ 1. МАССА УРАНА. 2. НАЛИЧИЕ ОТРАЖАЮЩЕЙ ОБОЛОЧКИ (бериллий). 3. НАЛИЧИЕ
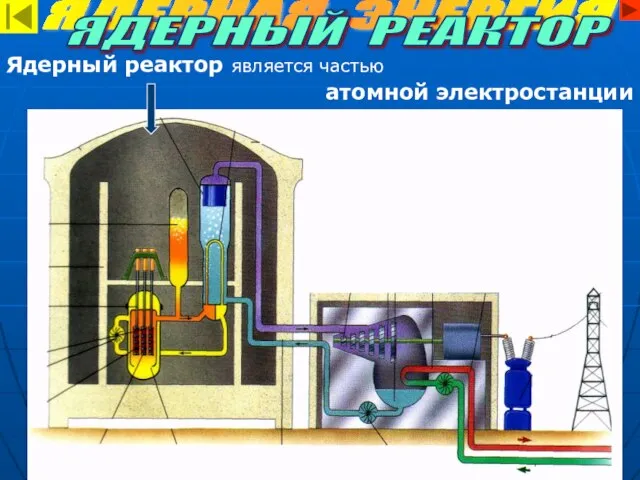
- 13. Ядерный реактор является частью атомной электростанции ЯДЕРНАЯ ЭНЕРГИЯ ЯДЕРНЫЙ РЕАКТОР
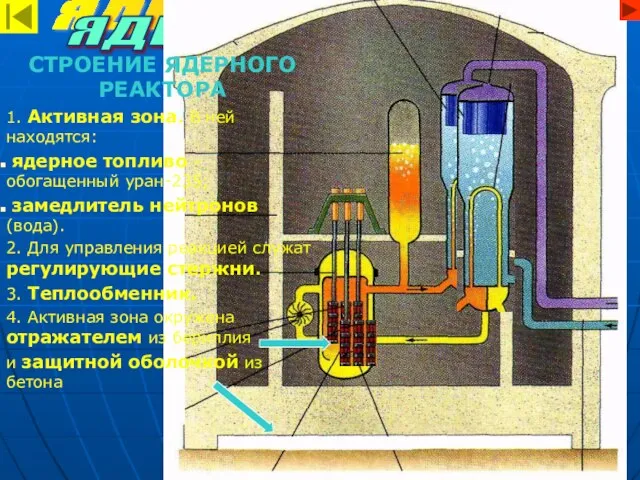
- 14. ЯДЕРНАЯ ЭНЕРГИЯ ЯДЕРНЫЙ РЕАКТОР СТРОЕНИЕ ЯДЕРНОГО РЕАКТОРА 1. Активная зона. В ней находятся: ядерное топливо –
- 15. ПРИНЦИП ДЕЙСТВИЯ ЯДЕРНОГО РЕАКТОРА 1. В активной зоне происходит управляемая ядерная реакция, в результате которой выделяется
- 16. 1. АТОМНЫЕ ЭЛЕКТРОСТАНЦИИ. 1942 г. Под руководством Э.Ферми в США был построен первый ядерный реактор. 1946
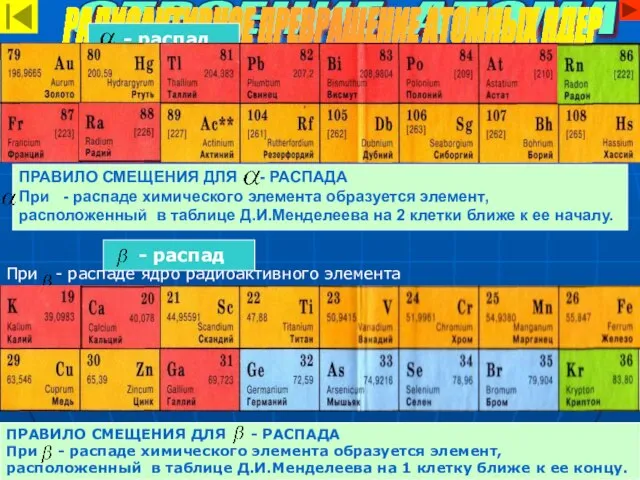
- 17. ПРАВИЛО СМЕЩЕНИЯ ДЛЯ - РАСПАДА При - распаде химического элемента образуется элемент, расположенный в таблице Д.И.Менделеева
- 18. Массовые числа химических элементов. Зарядовые числа химических элементов. СТРОЕНИЕ АТОМА РАДИОАКТИВНОЕ ПРЕВРАЩЕНИЕ АТОМНЫХ ЯДЕР 222 226
- 19. ИЗОТОПЫ –разновидности химического элемента, различающиеся по массе атомных ядер. СТРОЕНИЕ АТОМА ИЗОТОПЫ 234 92 U 235
- 21. Скачать презентацию












 Предквантум
Предквантум Старинные зимние обычаи и праздники, «Рождество», «Святки»
Старинные зимние обычаи и праздники, «Рождество», «Святки» ВИДЕО-СТЕНА DIBOSS LB-40
ВИДЕО-СТЕНА DIBOSS LB-40 Новый подход к интеграции календарно-сетевых графиков и смет
Новый подход к интеграции календарно-сетевых графиков и смет Областной конкурс Методическая разработка дистанционного урока - 2021
Областной конкурс Методическая разработка дистанционного урока - 2021 Музей путешествий. Поклонная гора. Парк Победы
Музей путешествий. Поклонная гора. Парк Победы Товары и услуги
Товары и услуги Техническое регулирование
Техническое регулирование 20140305_lekarstvennye_rasteniya_buturlinovskogo_rayona
20140305_lekarstvennye_rasteniya_buturlinovskogo_rayona Консолидация ритейла в Украине: роль логистики 1.Предпосылки для консолидации ритейла 2.Когда ритейлеру нужен 3PL-оператор? 3.Case study 4.
Консолидация ритейла в Украине: роль логистики 1.Предпосылки для консолидации ритейла 2.Когда ритейлеру нужен 3PL-оператор? 3.Case study 4. Project on the Indian Ocean
Project on the Indian Ocean  Портретная студийная съёмка
Портретная студийная съёмка Внешняя политика Советского государства 1920-х
Внешняя политика Советского государства 1920-х СТРОКА, ОБОРВАННАЯ ПУЛЕЙ
СТРОКА, ОБОРВАННАЯ ПУЛЕЙ ЕГЭ В 3 «Площади»
ЕГЭ В 3 «Площади» Цветовой контраст (хроматический)
Цветовой контраст (хроматический) Фотожурналист Владимир Вяткин
Фотожурналист Владимир Вяткин 26-27 апреля 2006 года Центр практической психологии РГУ имени С.А. Есенина Московский городской психолого-педагогический университе
26-27 апреля 2006 года Центр практической психологии РГУ имени С.А. Есенина Московский городской психолого-педагогический университе Кейс-стади для педагогов
Кейс-стади для педагогов Об аксиомах геометрии
Об аксиомах геометрии Презентация на тему Родная природа в стихотворениях поэтов xx века
Презентация на тему Родная природа в стихотворениях поэтов xx века  Каталог Атоми
Каталог Атоми Особенности организации и проведения школьного этапа Всероссийской олимпиады школьников по русскому языку Соловьева Т.В., предсе
Особенности организации и проведения школьного этапа Всероссийской олимпиады школьников по русскому языку Соловьева Т.В., предсе Создание новогодней открытки на основе пейзажа «Зимние россыпи»
Создание новогодней открытки на основе пейзажа «Зимние россыпи» Внесем порядок в хаос! ИЗО 7 класс
Внесем порядок в хаос! ИЗО 7 класс Космонавты, рожденные Украиной: космонавты Луганщины
Космонавты, рожденные Украиной: космонавты Луганщины Межрегиональный образовательный форум «Открытое образовательное пространство: живая праКтика тьюторства»
Межрегиональный образовательный форум «Открытое образовательное пространство: живая праКтика тьюторства» ДДК. Экскурсия
ДДК. Экскурсия