Презентация по теме«Физика атома»для профильного 11-го классаПодготовила учитель физики МОУ СОШ №43 г.ТвериГрекалова Галина Н
Содержание
- 2. Тема : «Физика атома»
- 3. Поурочное планирование Строение атома по Томсону и Резерфорду. Опыт Резерфорда Постулаты Бора. Атомные спектры Атом водорода
- 4. Цель: Познакомиться с теорией строения атома и атомного ядра Изучить две модели строения атома, их недостатки
- 5. Опыт Резерфорда В начале XX века было экспериментально доказано, что атом состоит из ядра и электронов.
- 6. Строение атома по Томсону и Резерфорду Планетарная модель атома Атом – наименьшая частица химического элемента, являющаяся
- 7. Компьютерная модель атома водорода Модель атома водорода 11Н. Это самый простой атом. Он состоит из протона
- 8. Атомное ядро Атомное ядро заряжено положительно. Его диаметр не превышает 10–14–10–15 м, а заряд Q равен
- 9. Постулаты Бора Поурочное планирование
- 10. Распределение вероятности нахождения электрона на различных расстояниях от ядра Боровских орбит в атоме в действительности не
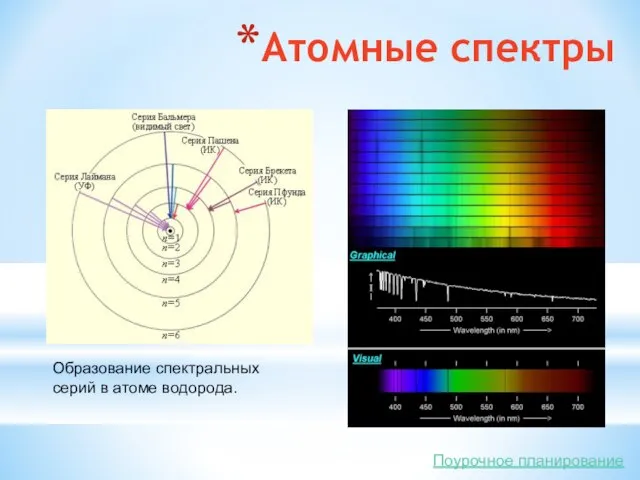
- 11. Атомные спектры Образование спектральных серий в атоме водорода. Поурочное планирование
- 12. Атом водорода Характеризуя водород по положению в периодической системе химических элементов Д. И. Менделеева, следует обратить
- 13. Водород занимает первое место в периодической системе (Z = 1). Он имеет простейшее строение атома: ядро
- 14. Поурочное планирование
- 15. Ядро дейтерия – дейтрон получается при столкновении двух протонов, обладающих большими кинетическими энергиями. Его мы рассмотрели
- 16. Образование дейтерия из двух атомов водорода Слова «дейтерий» и «тритий» напоминают нам о том, что сегодня
- 17. Водород в природе Поурочное планирование
- 19. Скачать презентацию















 Учебный курсдля учащихся 4 классов
Учебный курсдля учащихся 4 классов Теории творчества и креативности
Теории творчества и креативности Русская трапеза
Русская трапеза ?
? Экслибрис. Задание по прикладной композиции
Экслибрис. Задание по прикладной композиции Большие гонки
Большие гонки Умники и умницы
Умники и умницы Презентация на тему Внешнее и внутреннее строение насекомого
Презентация на тему Внешнее и внутреннее строение насекомого Формула сайта:Успешный интернет-магазин от А до Я
Формула сайта:Успешный интернет-магазин от А до Я Управление Росприроднадзора по Свердловской области ОАО Уральский центр энергосбережения и экологии Сохранение и обустройство
Управление Росприроднадзора по Свердловской области ОАО Уральский центр энергосбережения и экологии Сохранение и обустройство  Основы тайм-менеджмента
Основы тайм-менеджмента Экслибрис – искусство книжного знака
Экслибрис – искусство книжного знака Securities fraud
Securities fraud Цикл менеджмента. Планирование
Цикл менеджмента. Планирование История возникновения логарифмов
История возникновения логарифмов Was ist in Deutschland
Was ist in Deutschland  Особенности делового этикета в Японии
Особенности делового этикета в Японии Социально-значимая деятельность школьников
Социально-значимая деятельность школьников Добро пожаловать в наш Педагогический колледж! Университетский Педагогический колледж №16 – это авторитетное, современное, дина
Добро пожаловать в наш Педагогический колледж! Университетский Педагогический колледж №16 – это авторитетное, современное, дина Управление проектами Тема 1 – введение в управление проектами Проф., д.т.н. А.А. Дульзон
Управление проектами Тема 1 – введение в управление проектами Проф., д.т.н. А.А. Дульзон Метапредметный подход при преподавании математики: использование технологии метапредмета «Задача»
Метапредметный подход при преподавании математики: использование технологии метапредмета «Задача» Питание и органы пищеварения
Питание и органы пищеварения Презентация на тему Конструирование текстов, предложений (2 класс)
Презентация на тему Конструирование текстов, предложений (2 класс) Божественный идеал в религиях мира (Буддизм)
Божественный идеал в религиях мира (Буддизм) Организация и проведение мероприятий направленных на привлечение детей занятиями лыжным спортом
Организация и проведение мероприятий направленных на привлечение детей занятиями лыжным спортом Совы
Совы Вглядываясь в человека. Портрет
Вглядываясь в человека. Портрет Визитная карточка начальной школы ГУО «Гимназия №20 г.Минска»
Визитная карточка начальной школы ГУО «Гимназия №20 г.Минска»