Содержание
- 2. Получение гидроксида меди (II) I группа: CuCl2 + 2KOH = Cu(OH)2 + 2KCl 2 группа: CuBr2
- 3. ТЕМА УРОКА: «РЕАКЦИИ ИОННОГО ОБМЕНА»
- 4. ВЗАИМОДЕЙСТВИЕ РАСТВОРА ХЛОРИДА ЖЕЛЕЗА (III) С ГИДРОКСИДОМ НАТРИЯ
- 5. 1) ЗАПИСАТЬ УРАВНЕНИЕ РЕАКЦИИИ В МОЛЕКУЛЯРНОЙ ФОРМЕ FeCI3 + 3NaOH = Fe(OH)3 + 3 NaCI 2)
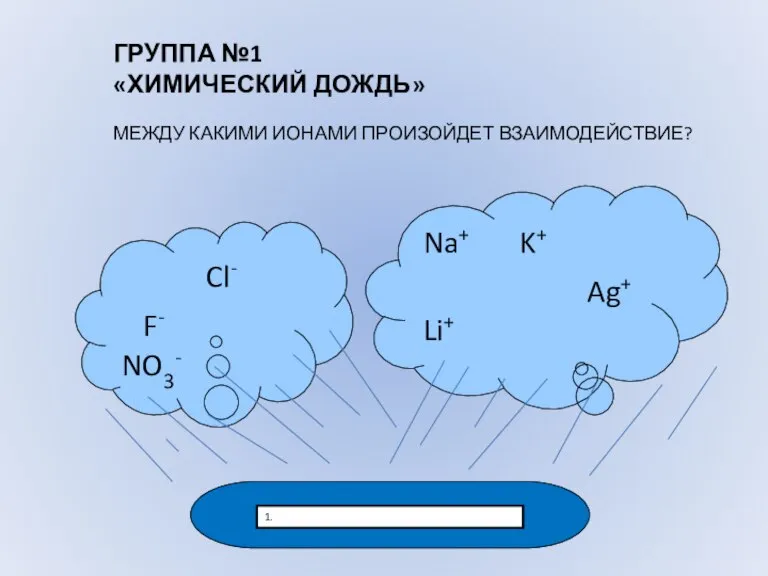
- 6. Cl- F- NO3- Na+ K+ Ag+ Li+ 1. ГРУППА №1 «ХИМИЧЕСКИЙ ДОЖДЬ» МЕЖДУ КАКИМИ ИОНАМИ ПРОИЗОЙДЕТ
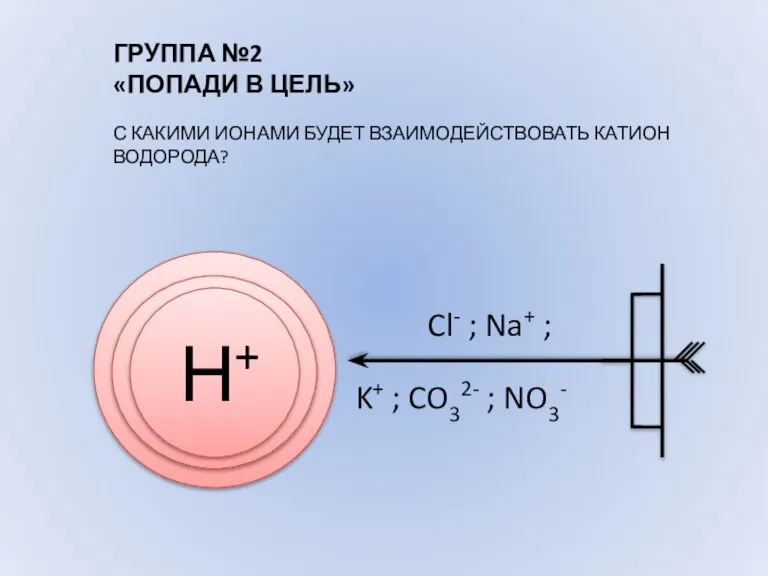
- 7. ГРУППА №2 «ПОПАДИ В ЦЕЛЬ» С КАКИМИ ИОНАМИ БУДЕТ ВЗАИМОДЕЙСТВОВАТЬ КАТИОН ВОДОРОДА? Н+ Cl- ; Na+
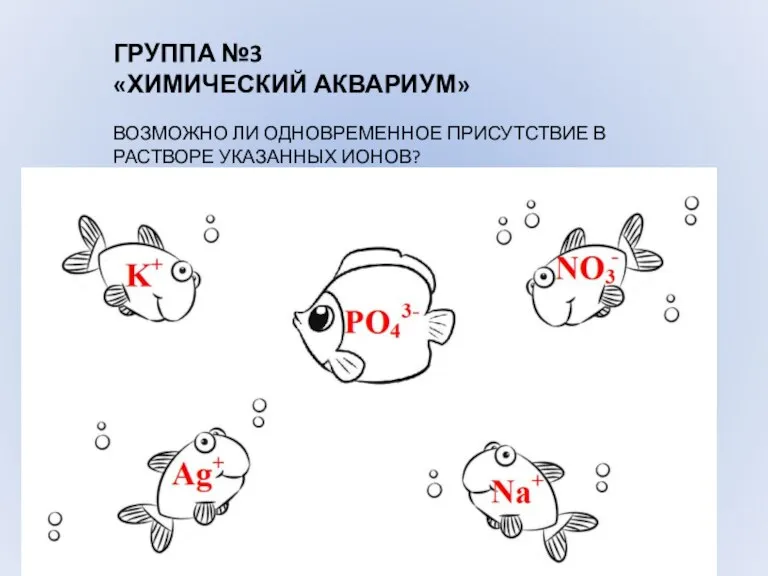
- 8. ГРУППА №3 «ХИМИЧЕСКИЙ АКВАРИУМ» ВОЗМОЖНО ЛИ ОДНОВРЕМЕННОЕ ПРИСУТСТВИЕ В РАСТВОРЕ УКАЗАННЫХ ИОНОВ?
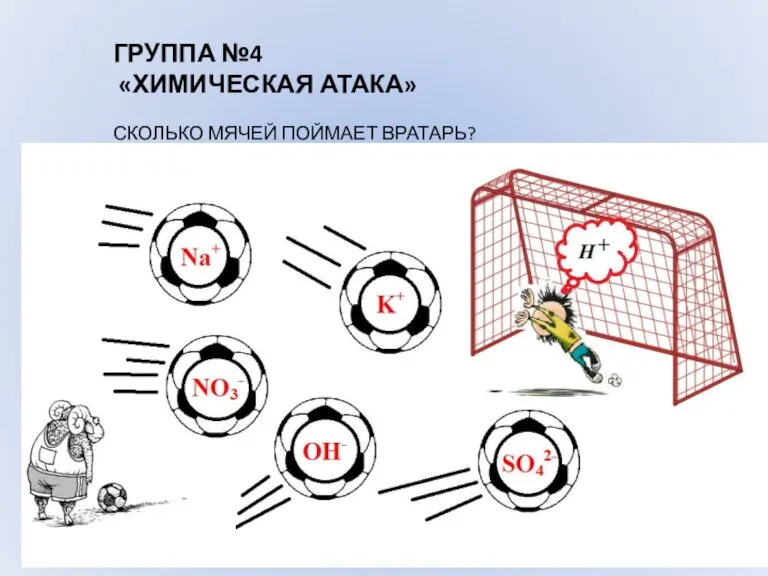
- 9. ГРУППА №4 «ХИМИЧЕСКАЯ АТАКА» СКОЛЬКО МЯЧЕЙ ПОЙМАЕТ ВРАТАРЬ?
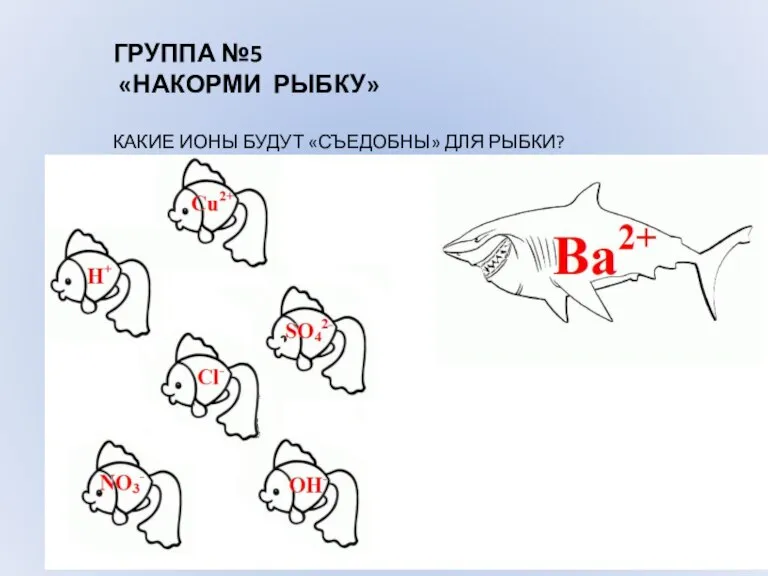
- 10. ГРУППА №5 «НАКОРМИ РЫБКУ» КАКИЕ ИОНЫ БУДУТ «СЪЕДОБНЫ» ДЛЯ РЫБКИ?
- 11. ПРИЗНАКИ НЕОБРАТИМОСТИ РЕАКЦИЙ ИОННОГО ОБМЕНА ОБРАЗОВАНИЕ ОСАДКА Cu 2++ 2OH- = Cu(OH)2 ОБРАЗОВАНИЕ ГАЗООБРАЗНОГО ВЕЩЕСТВА CO32-
- 12. Получение гидроксида меди (II) I группа: CuCl2 + 2KOH = Cu(OH)2 + 2KCl 2 группа: CuBr2
- 13. Краткое ионное уравнение получения гидроксида меди (II) из растворов солей меди Cu 2++ 2OH- = Cu(OH)2
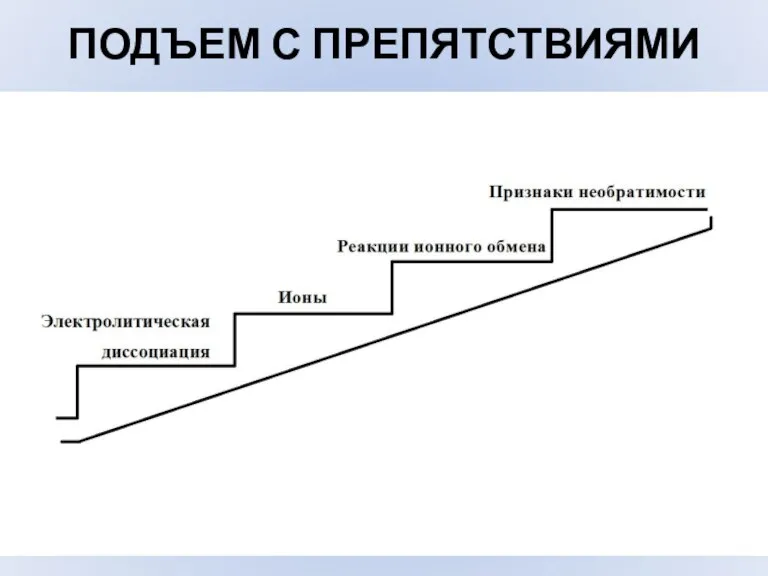
- 14. ПОДЪЕМ С ПРЕПЯТСТВИЯМИ
- 15. Самостоятельная работа
- 16. Домашнее задание Задачник по химии 9 класс Н.Е. Кузнецова, А.Н. Лёвкин №: 2-23 стр. 20 №:
- 18. Скачать презентацию









 Funny English
Funny English Основные представления ядерной физики
Основные представления ядерной физики Аккордеон
Аккордеон Проект "Школьная газета"
Проект "Школьная газета" Обучение плаванью
Обучение плаванью Дневник достижений капоэйра
Дневник достижений капоэйра Кадровая политика АК Алроса (ПАО)
Кадровая политика АК Алроса (ПАО) Виды штор
Виды штор Маркетинговое исследование предприятия розничной торговли
Маркетинговое исследование предприятия розничной торговли Просвещенный абсолютизм в России
Просвещенный абсолютизм в России Презентация по английскому языку Лондон
Презентация по английскому языку Лондон Уклонение от уплаты таможенных платежей
Уклонение от уплаты таможенных платежей Жемчуг
Жемчуг rod_sobranie_1 (1)
rod_sobranie_1 (1) Аренда помещения в городе Сосновый Бор
Аренда помещения в городе Сосновый Бор Сканирование ткани
Сканирование ткани Задачи для устного счета 3 класс
Задачи для устного счета 3 класс Употребление предлогов Упражнения
Употребление предлогов Упражнения Увлечение рыбалкой
Увлечение рыбалкой ГОЛУБОЙ ЦВЕТ
ГОЛУБОЙ ЦВЕТ Древний Китай
Древний Китай Фрагменты конкурсных материалов Приоритетного национального проекта «Образование» 2006 года
Фрагменты конкурсных материалов Приоритетного национального проекта «Образование» 2006 года Психология профессиональной карьеры
Психология профессиональной карьеры Машины для обработки мяса и рыбы
Машины для обработки мяса и рыбы Ofertă comercială
Ofertă comercială Некоторые примеры использования Ферментов в промышленности
Некоторые примеры использования Ферментов в промышленности Цветная металлургия
Цветная металлургия Кроссворд на английском языке
Кроссворд на английском языке