Содержание
- 2. Задачи урока: 1. Обучающие: обеспечить усвоение предметного содержания темы «Законы электролиза»: - на первом уровне отличать
- 3. Задачи урока: 2. Развивающая. Развитие основных способов мыслительной деятельности (сравнение, сопоставление, анализ, обобщение). Развивать память, познавательные
- 4. Задачи урока: 3. Воспитательная. Способствовать формированию коммуникативных качеств, трудолюбия, ответственности за порученное дело.
- 5. Методическая цель. Показать эффективность использования элементов технологии критического мышления.
- 6. Тип урока Комбинированный урок (использование элементов технологии критического мышления)
- 7. Изучать, открывать, удивлять, Верить в силу наук для людей И природы закон применять, Как его применял
- 8. Фаза вызова
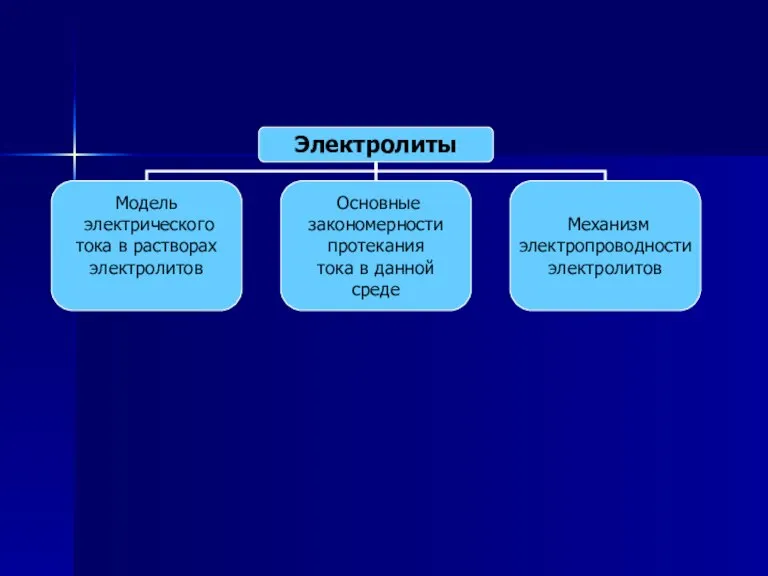
- 9. Вспомним, что мы знаем об электролитах. Для этого заполним кластер.
- 13. Проверим ваши знания. Для этого проведем физический диктант
- 14. Электролиты – это растворы неорганических солей, кислот, щелочей растворы органических солей, кислот, щелочей
- 15. Ответ правильный. Вы получаете 1 балл.
- 16. Ответ неправильный. Правильный ответ: Электролиты – это растворы неорганических солей, кислот, щелочей. Вы получаете 0 баллов.
- 17. Носителями зарядов в электролитах являются положительные и отрицательные ионы, которые образуются вследствие электролитической диссоциации молекулы входящих
- 18. Ответ правильный. Вы получаете 1 балл.
- 19. Ответ неправильный. Правильный ответ: Носителями зарядов в электролитах являются положительные и отрицательные ионы, которые образуются вследствие
- 20. Электролитическая диссоциация распад молекул электролитов на ионы соединение молекул электролитов из ионов
- 21. Ответ правильный. Вы получаете 1 балл.
- 22. Ответ неправильный. Правильный ответ: Электролитическая диссоциация - это распад молекул электролитов на ионы. Вы получаете 0
- 23. Рекомбинация – это процесс, противоположный диссоциации то же самое, что и диссоциация
- 24. Ответ правильный. Вы получаете 1 балл.
- 25. Ответ неправильный. Правильный ответ: Рекомбинация - это процесс, противоположный диссоциации. Вы получаете 0 баллов.
- 26. Электролиз - это окислительно-восстановительная реакция, протекающая на электродах при прохождении электрического тока через электролит химическая реакция,
- 27. Ответ правильный. Вы получаете 1 балл.
- 28. Ответ неправильный. Правильный ответ: Электролиз - это окислительно-восстановительная реакция, протекающая на электродах при прохождении электрического тока
- 29. Окислительно-восстановительная реакция - это реакция с изменением степени окисления элементов физическое явление с изменением массы элементов
- 30. Ответ правильный. Вы получаете 1 балл.
- 31. Ответ неправильный. Правильный ответ: Окислительно-восстановительная реакция - это реакция с изменением степени окисления элементов. Вы получаете
- 32. Проводимость электролитов называют ионной. молекулярной.
- 33. Ответ правильный. Вы получаете 1 балл.
- 34. Ответ неправильный. Правильный ответ: Проводимость электролитов называют ионной. Вы получаете 0 баллов.
- 35. Катод – это электрод, соединенный с отрицательным полюсом источника тока. электрод, соединенный с положительным полюсом источника
- 36. Ответ правильный. Вы получаете 1 балл.
- 37. Ответ неправильный. Правильный ответ: Катод – это электрод, соединенный с отрицательным полюсом источника тока. Вы получаете
- 38. Анод – это электрод, соединенный с отрицательным полюсом источника тока. электрод, соединенный с положительным полюсом источника
- 39. Ответ правильный. Вы получаете 1 балл.
- 40. Ответ неправильный. Правильный ответ: Анод – это электрод, соединенный с положительным полюсом источника тока. Вы получаете
- 41. Электролиз применяют для получения солей различных элементов и их растворов. для получения металлов (меди, алюминия) электролитическим
- 42. Ответ правильный. Вы получаете 1 балл.
- 43. Ответ неправильный. Правильный ответ: Электролиз применяют для получения металлов (меди, алюминия) электролитическим способом, в гальванопластике и
- 44. Посчитайте свои баллы и сообщите учителю.
- 45. Итог по фазе вызова. «Фишбон»
- 46. Фаза осмысления Продолжаем нашу работу. Следующая фаза осмысления. Попробуем установить основные закономерности протекания электрического тока в
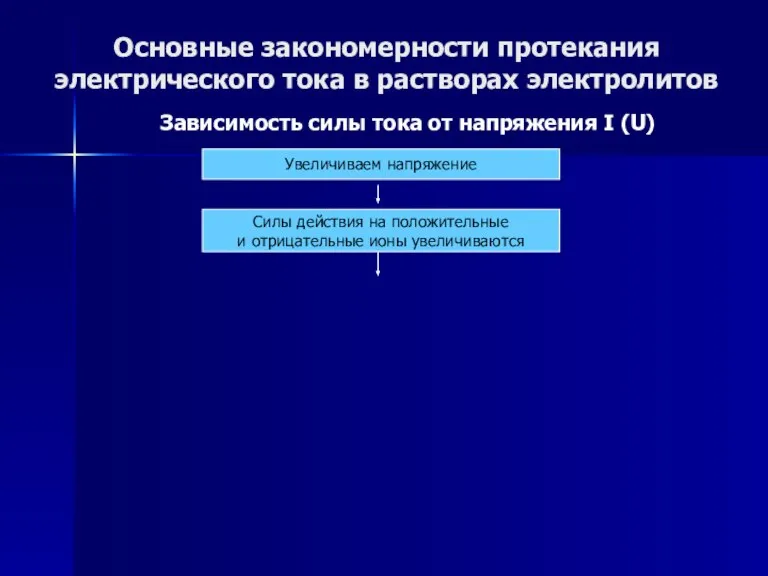
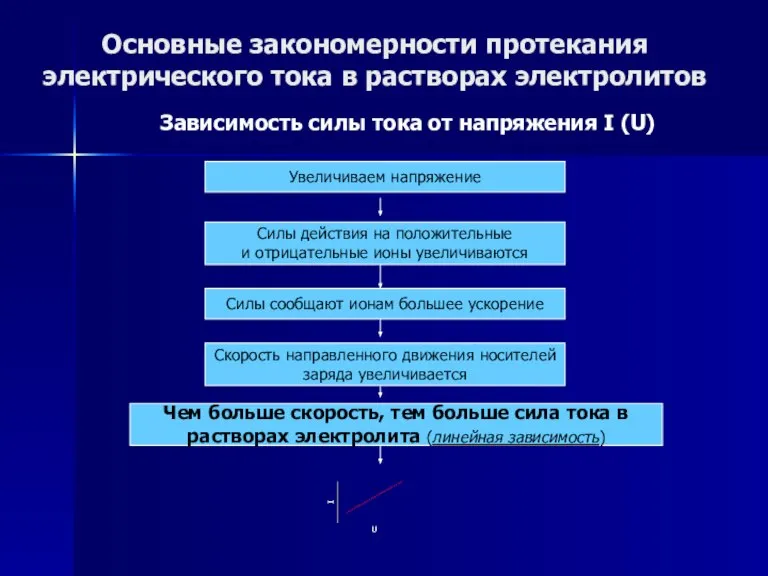
- 47. Основные закономерности протекания электрического тока в растворах электролитов Зависимость силы тока от напряжения I (U) Зависимость
- 48. Основные закономерности протекания электрического тока в растворах электролитов Зависимость силы тока от напряжения I (U) Увеличиваем
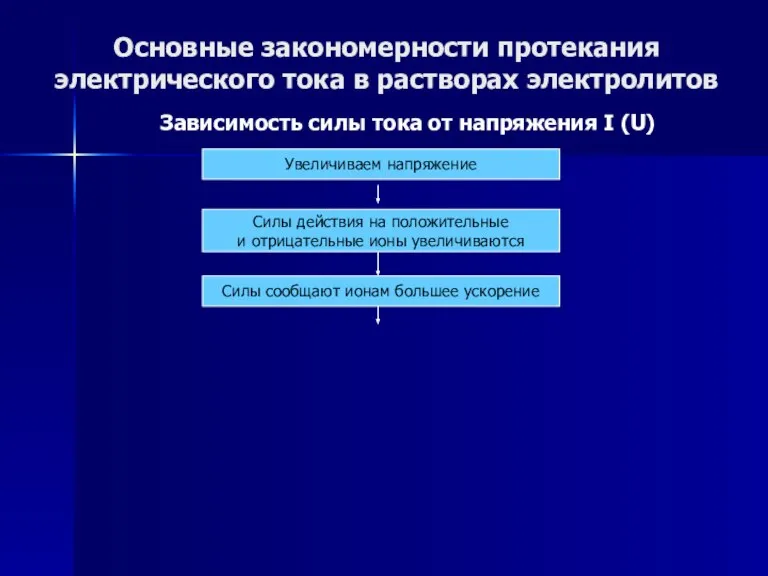
- 49. Основные закономерности протекания электрического тока в растворах электролитов Зависимость силы тока от напряжения I (U) Увеличиваем
- 50. Основные закономерности протекания электрического тока в растворах электролитов Зависимость силы тока от напряжения I (U) Увеличиваем
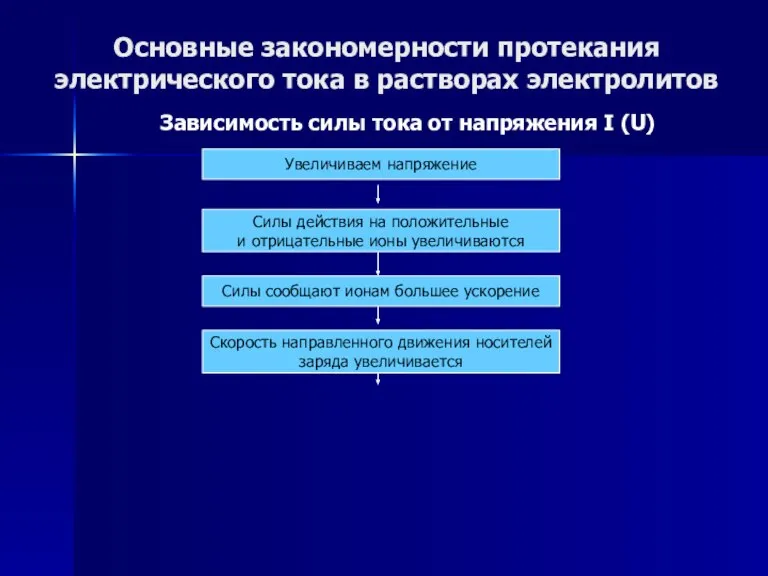
- 51. Основные закономерности протекания электрического тока в растворах электролитов Зависимость силы тока от напряжения I (U) Увеличиваем
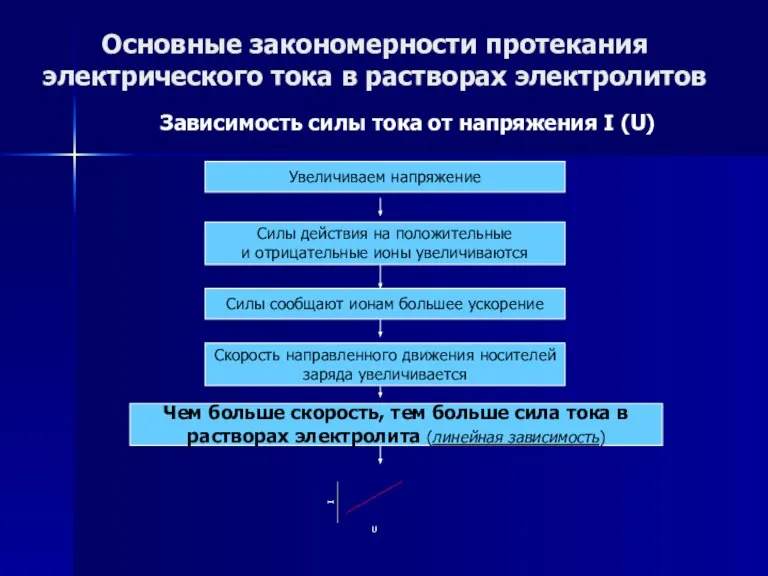
- 52. Основные закономерности протекания электрического тока в растворах электролитов Зависимость силы тока от напряжения I (U) Увеличиваем
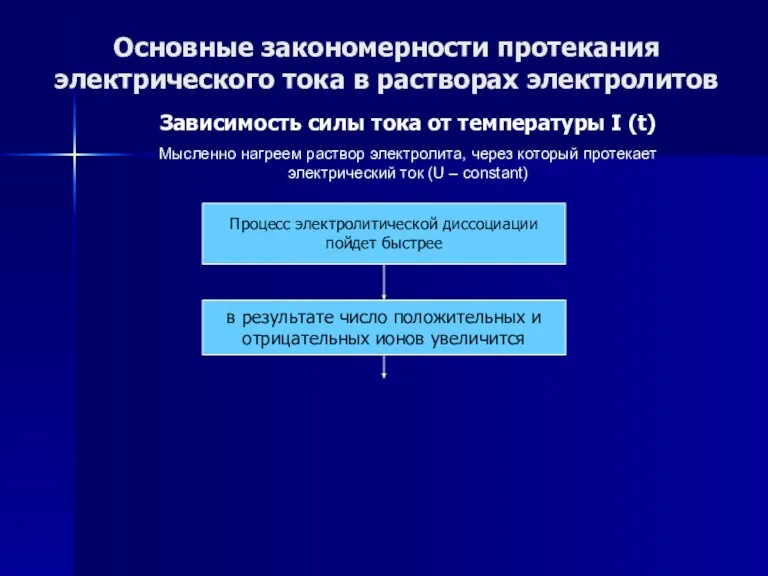
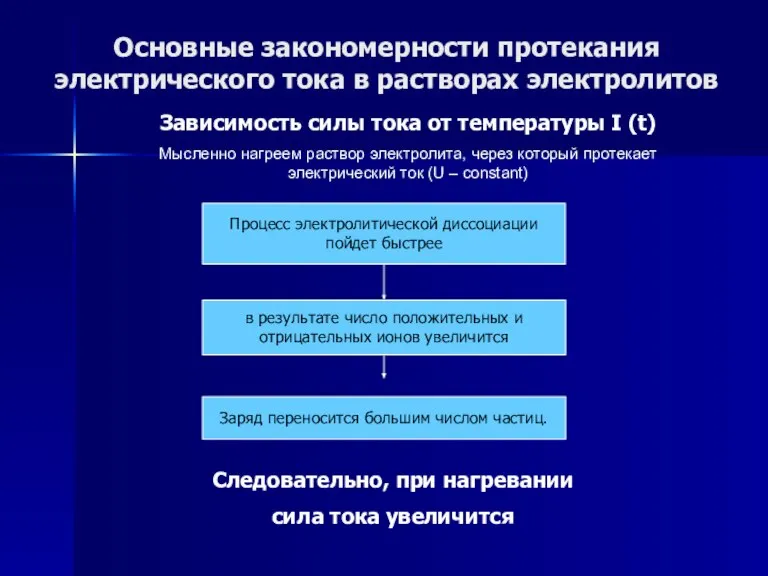
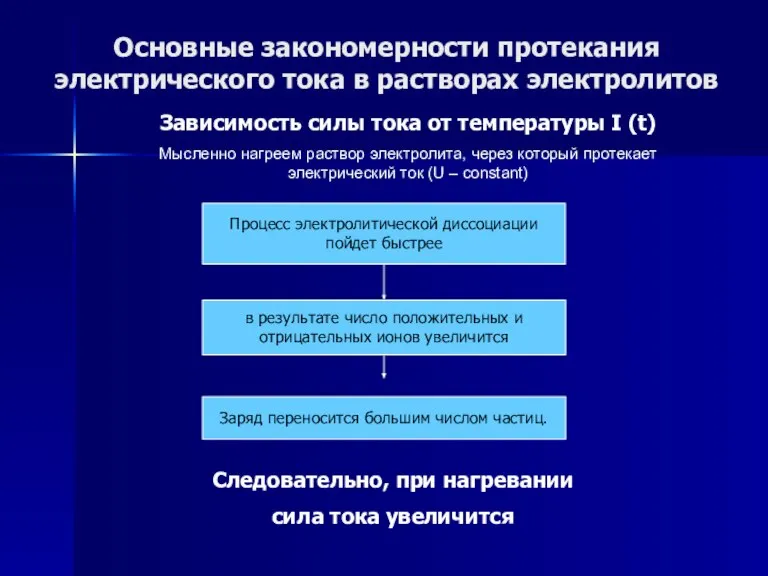
- 53. Основные закономерности протекания электрического тока в растворах электролитов Зависимость силы тока от температуры I (t) Мысленно
- 54. Основные закономерности протекания электрического тока в растворах электролитов Зависимость силы тока от температуры I (t) Мысленно
- 55. Основные закономерности протекания электрического тока в растворах электролитов Зависимость силы тока от температуры I (t) Мысленно
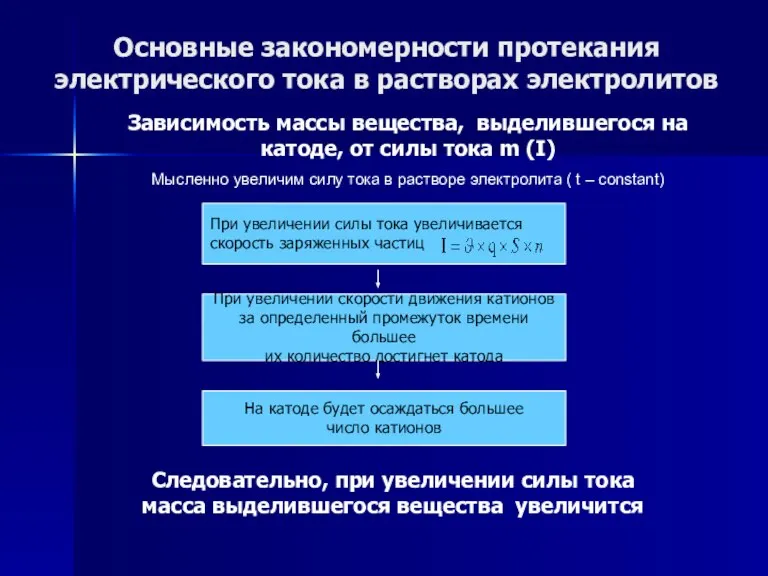
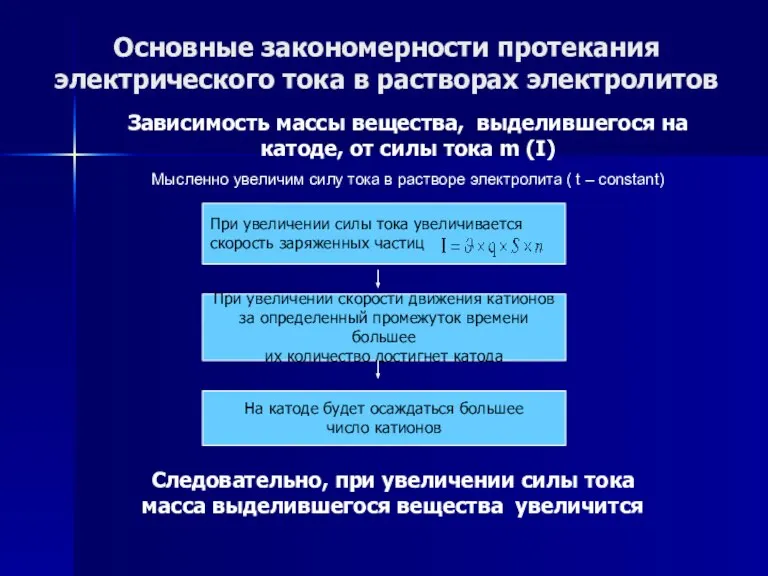
- 56. Основные закономерности протекания электрического тока в растворах электролитов Зависимость массы вещества, выделившегося на катоде, от силы
- 57. Основные закономерности протекания электрического тока в растворах электролитов Зависимость массы вещества, выделившегося на катоде, от силы
- 58. Основные закономерности протекания электрического тока в растворах электролитов Зависимость массы вещества, выделившегося на катоде, от силы
- 59. Повторим основные закономерности протекания электрического тока в растворах электролитов.
- 60. Основные закономерности протекания электрического тока в растворах электролитов Зависимость силы тока от напряжения I (U) Увеличиваем
- 61. Основные закономерности протекания электрического тока в растворах электролитов Зависимость силы тока от температуры I (t) Мысленно
- 62. Основные закономерности протекания электрического тока в растворах электролитов Зависимость массы вещества, выделившегося на катоде, от силы
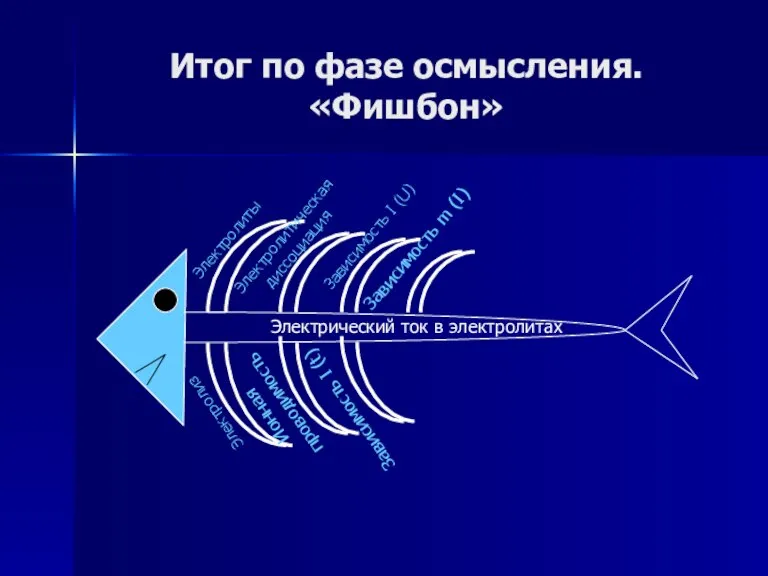
- 63. Итог по фазе осмысления. «Фишбон»
- 64. Фаза осмысления (продолжение) Зная механизм проводимости электролитов можно определить массу вещества, выделившегося при электролизе. Чтобы решить
- 65. Самостоятельная работа с учебником I закон Фарадея. Алгоритм.
- 66. 1. Запишите формулу массы вещества m0 – масса атома N – число ионов
- 67. 2. Свяжите массу атома с молярной массой. тогда (1)
- 68. 3. Находим N – число ионов, проходящих через раствор электролитов. а) Каждый одновалентный ион несет заряд,
- 69. 3. Находим N – число ионов, проходящих через раствор электролитов. г) так как в выражении (2)
- 70. 4. Электрохимический эквивалент Физический смысл электрохимического эквивалента к – это масса вещества в кг, выделившаяся при
- 71. Самостоятельная работа с учебником II закон Фарадея. Алгоритм.
- 72. 1. Дайте определение химического эквивалента. Химический эквивалент - это отношение атомной (А) массы вещества к его
- 73. 2. Запишите второй закон Фарадея. Второй закон Фарадея: электрохимический эквивалент пропорционален химическому эквиваленту данного вещества. где
- 74. 3. Дайте определение постоянной Фарадея. Постоянная Фарадея F – численно равна заряду, который должен пройти через
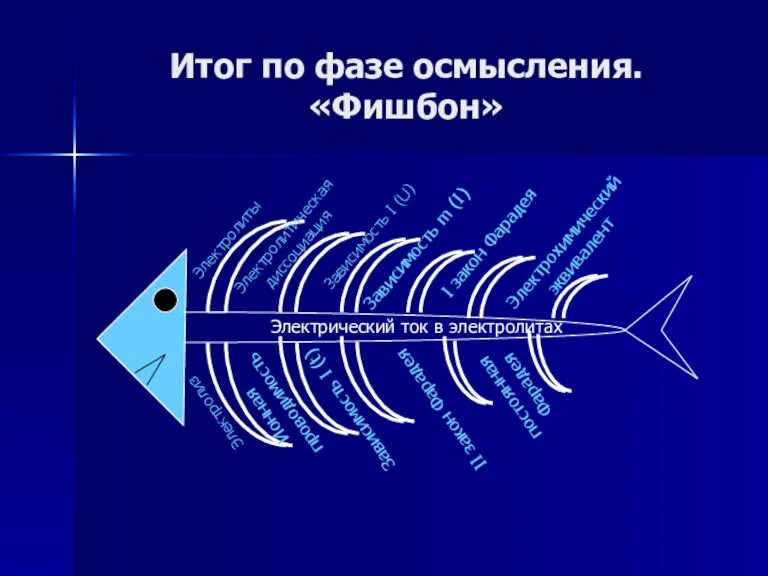
- 75. Итог по фазе осмысления. «Фишбон»
- 76. Фаза практического осмысления (работа с дополнительной литературой) Законы Фарадея нашли практическое применение в науке и технике,
- 77. Мозговая атака (мысли по кругу) Как решать задачи, используя законы электролиза (памятка). 1. Для электролитов справедлив
- 78. Мозговая атака (мысли по кругу) Последовательность решения задач. 1. Установить сущность процесса, связанного с прохождением электрического
- 79. Фаза практического осмысления (работа с дополнительной литературой) Применение законов Фарадея при решении качественных и количественных задач.
- 80. Рефлексия Подведем итоги урока. Перед вами Фарадеево дерево, где можно проследить процесс восхождения на него. Определите
- 81. Рефлексия Подведем итоги урока. Электролиты Электролиз Ионная проводимость Механизм электропроводности Зависимость I (U) Зависимость m (I)
- 82. Рефлексия Подведем итоги урока. Электролиты Электролиз Ионная проводимость Механизм электропроводности Зависимость I (U) Зависимость m (I)
- 83. Рефлексия Подведем итоги урока. Электролиты Электролиз Ионная проводимость Механизм электропроводности Зависимость I (U) Зависимость m (I)
- 84. Рефлексия Подведем итоги урока. Электролиты Электролиз Ионная проводимость Механизм электропроводности Зависимость I (U) Зависимость m (I)
- 86. Скачать презентацию



































































 ОБМАНИ МЕНЯ ЕСЛИ СМОЖЕШЬ
ОБМАНИ МЕНЯ ЕСЛИ СМОЖЕШЬ Пришкольный лагерь «Солнышко»
Пришкольный лагерь «Солнышко» МОУ СОШ № 4 . г. Всеволожск Ленинградская область Тема. Дисциплина Ученица 7 класса «Б» Матвейчук Антонина Учитель Потапова О.Н.
МОУ СОШ № 4 . г. Всеволожск Ленинградская область Тема. Дисциплина Ученица 7 класса «Б» Матвейчук Антонина Учитель Потапова О.Н. Презентация на тему Оплодотворение и развитие зародыша
Презентация на тему Оплодотворение и развитие зародыша математический диктантпроверь себя и оцени
математический диктантпроверь себя и оцени Мониторинг комплексных проектов модернизации образования: отслеживать ход реализации
Мониторинг комплексных проектов модернизации образования: отслеживать ход реализации The Art of Delegation_How to Increase Manager's Efficiency_Marharyta Kotelevets
The Art of Delegation_How to Increase Manager's Efficiency_Marharyta Kotelevets наречие
наречие Галогены
Галогены Физкультура и спорт
Физкультура и спорт Презентация к уроку истории России 9 кл.
Презентация к уроку истории России 9 кл. Инвестиционная стратегия ПАО ФК Открытие
Инвестиционная стратегия ПАО ФК Открытие Казань в судьбе Сергея Тимофеевича Аксакова
Казань в судьбе Сергея Тимофеевича Аксакова Crown Jewels
Crown Jewels Развитие у школьников умений исследовательской деятельности
Развитие у школьников умений исследовательской деятельности Румыния и Венгрия во второй половине 20 в
Румыния и Венгрия во второй половине 20 в Комплексне рішення по датацентрам від компанії Інком. Проект в ПАТ «Кредобанк»
Комплексне рішення по датацентрам від компанії Інком. Проект в ПАТ «Кредобанк» Профилактика кризисных ситуаций в подростковом возрасте
Профилактика кризисных ситуаций в подростковом возрасте butterflies
butterflies Шрифт надписи
Шрифт надписи Командитне підприємство
Командитне підприємство Деревянная архитектура
Деревянная архитектура Лесные и торфяные пожары
Лесные и торфяные пожары Корзиночки, тарталетки
Корзиночки, тарталетки Транспортная безопасность
Транспортная безопасность Предлагаем услуги следующих видов наружной рекламы: - Термоформовка - Ателье (пошив униформы, палаток, тентов и т.д.)
Предлагаем услуги следующих видов наружной рекламы: - Термоформовка - Ателье (пошив униформы, палаток, тентов и т.д.) 1
1 Канада
Канада