Содержание
- 2. Часть 1 Мутации и мутагены
- 3. Основные термины Мутации – это явления скачкообразного, прерывистого изменения наследственного признака. (определение Г. Де Фриза) Мутации
- 4. Мутационная теория Основные положения мутационной теории Г. Де Фриза сводятся к следующему: Мутации возникают внезапно, как
- 5. Классификация мутаций В зависимости от факторов, вызывающих мутации, их разделяют на спонтанные и индуцированные. Спонтанные мутации
- 6. Классификация мутаций В зависимости от размеров сегментов генома, подвергающихся преобразованиям, мутации разделяют на геномные, хромосомные и
- 7. Классификация мутаций При хромосомных мутациях происходят как изменение числа отдельных хромосом в геноме (анеуплоидия), так и
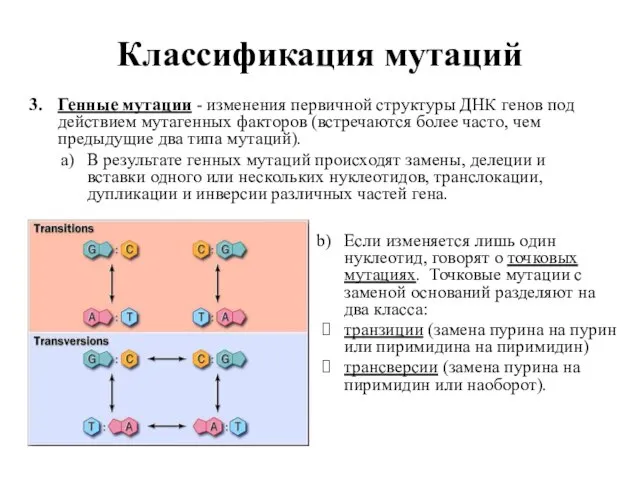
- 8. Классификация мутаций Генные мутации - изменения первичной структуры ДНК генов под действием мутагенных факторов (встречаются более
- 9. Классификация мутаций Из-за вырожденности генетического кода могут быть три генетических последствия точковых мутаций: Синонимическая замена нуклеотида
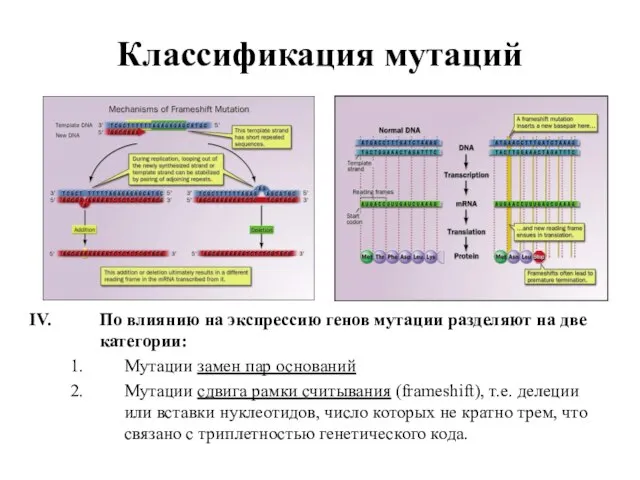
- 10. Классификация мутаций По влиянию на экспрессию генов мутации разделяют на две категории: Мутации замен пар оснований
- 11. Классификация мутаций Первичную мутацию называют прямой мутацией, а мутацию, восстанавливающую исходную структуру гена – обратной мутацией
- 12. Основные источники мутаций В основе мутаций на молекулярном уровне лежат две основные причины: Ошибки репликации Мутагенные
- 13. Ошибки репликации Точность процесса репликации определяется: Различиями в свободной энергии у канонических или ошибочных пар азотистых
- 14. Мутагенные воздействия Усилий систем репликации становится недостаточно в стрессовых ситуациях, когда организм подвергается массированному мутагенному воздействию.
- 15. Ионизирующее излучение Ярко выраженным мутагенным действием обладают: Коротковолновое электромагнитное излучение (УФ-свет, рентгеновские лучи) Элементарные частицы, образующиеся
- 16. Химические мутагены Многие химические соединения обладают способностью взаимодействовать с ДНК или с ее низкомолекулярными предшественниками и
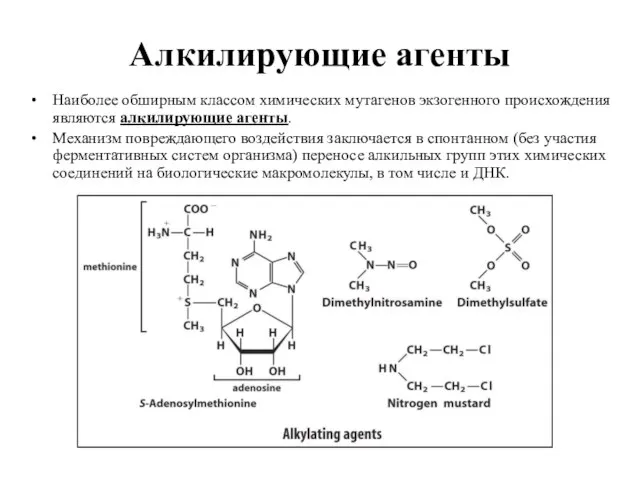
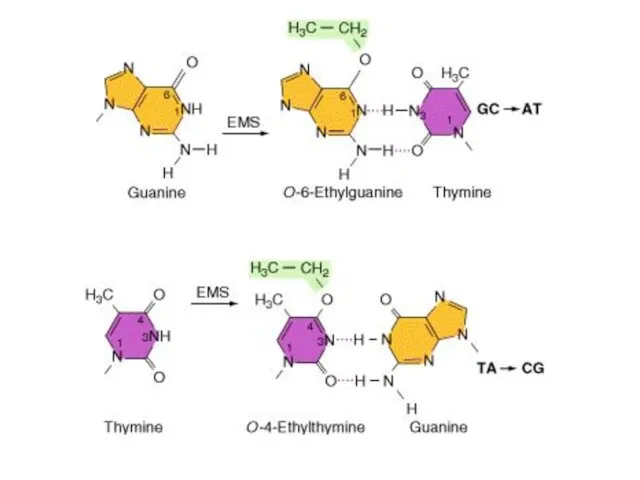
- 17. Алкилирующие агенты Наиболее обширным классом химических мутагенов экзогенного происхождения являются алкилирующие агенты. Механизм повреждающего воздействия заключается
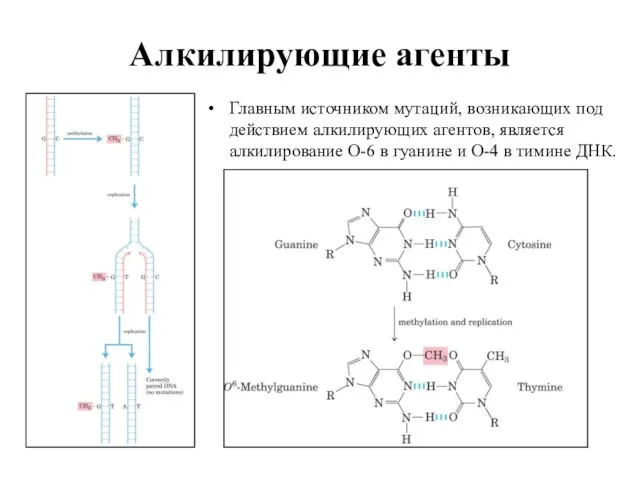
- 18. Алкилирующие агенты Главным источником мутаций, возникающих под действием алкилирующих агентов, является алкилирование O-6 в гуанине и
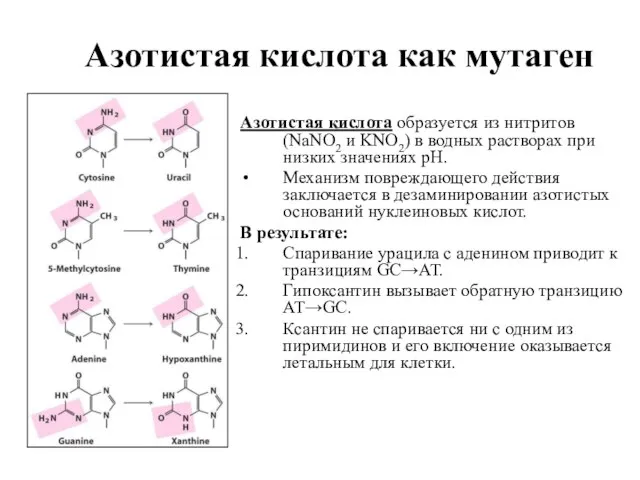
- 20. Азотистая кислота как мутаген Азотистая кислота образуется из нитритов (NaNO2 и KNO2) в водных растворах при
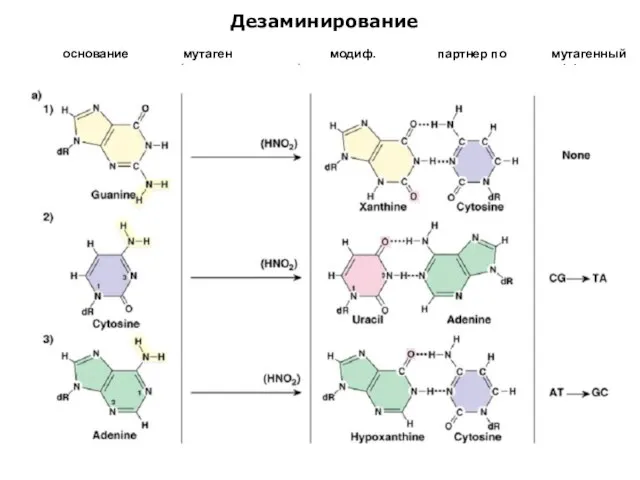
- 21. Дезаминирование основание мутаген (азотистая кислота) модиф. основание партнер по спариванию мутагенный эффект
- 22. Органические перекиси как мутагены Мутагенным действием обладают различные органические перекиси. Азид натрия – мощный ингибитор дыхания,
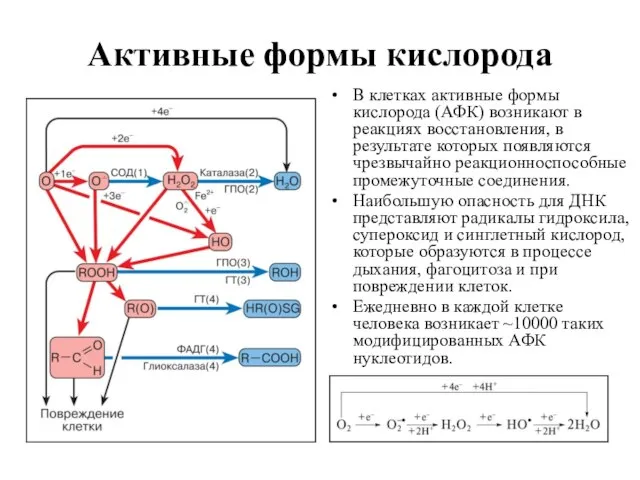
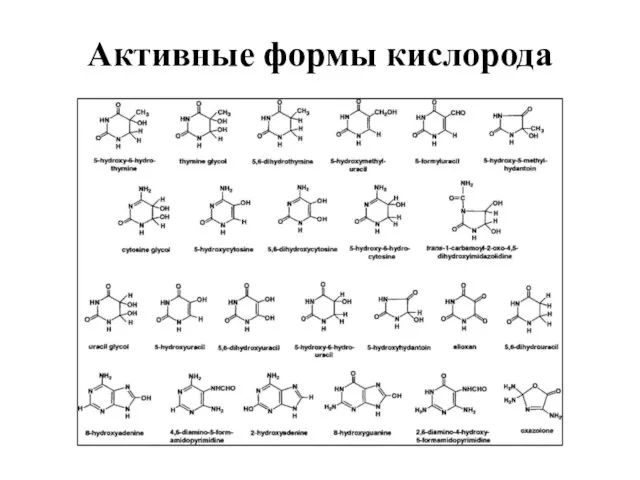
- 23. Активные формы кислорода В клетках активные формы кислорода (АФК) возникают в реакциях восстановления, в результате которых
- 24. Активные формы кислорода
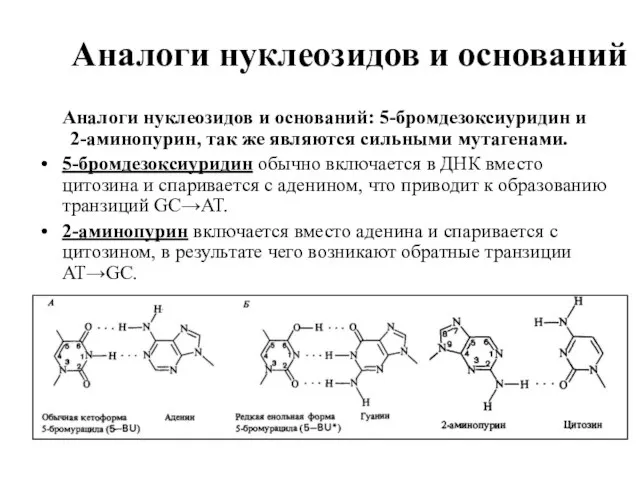
- 25. Аналоги нуклеозидов и оснований Аналоги нуклеозидов и оснований: 5-бромдезоксиуридин и 2-аминопурин, так же являются сильными мутагенами.
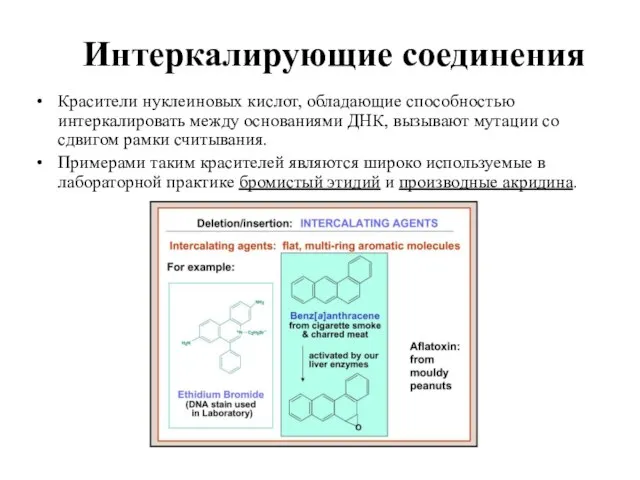
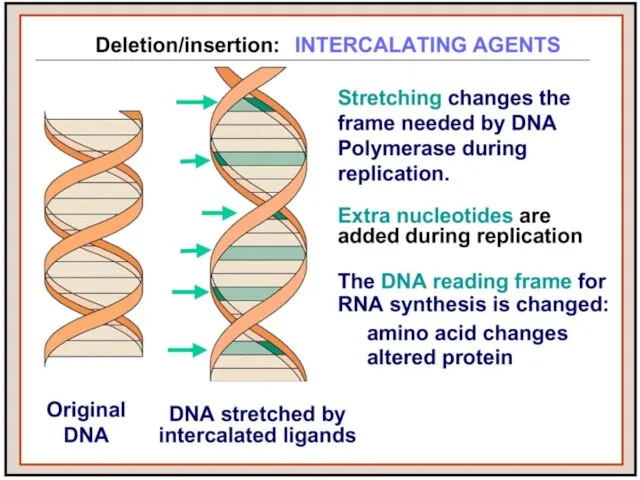
- 26. Интеркалирующие соединения Красители нуклеиновых кислот, обладающие способностью интеркалировать между основаниями ДНК, вызывают мутации со сдвигом рамки
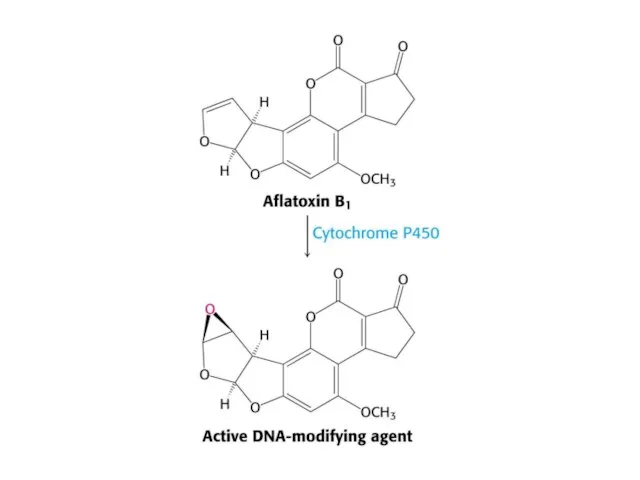
- 28. Метаболическая активация проканцерогенов Для защиты от накопления экзогенных чужеродных химических соединений (ксенобиотиков) у каждого живого организма
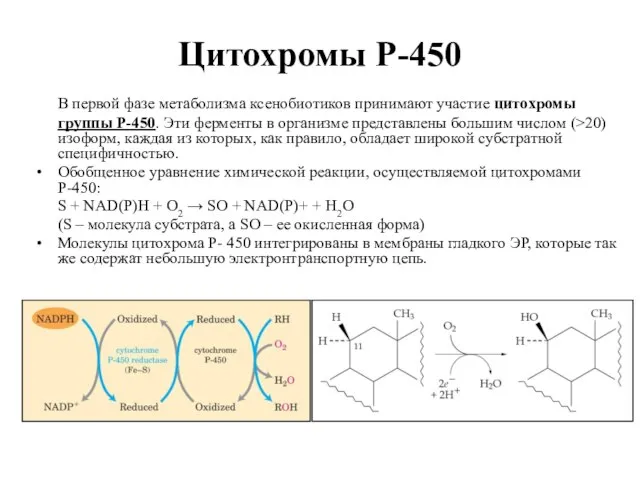
- 29. Цитохромы Р-450 В первой фазе метаболизма ксенобиотиков принимают участие цитохромы группы Р-450. Эти ферменты в организме
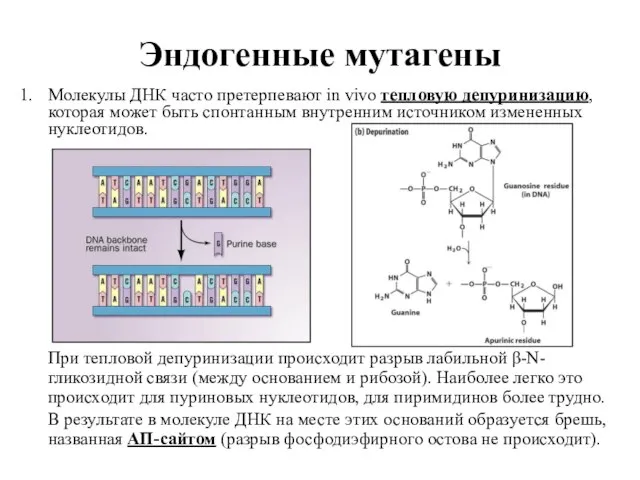
- 31. Эндогенные мутагены Молекулы ДНК часто претерпевают in vivo тепловую депуринизацию, которая может быть спонтанным внутренним источником
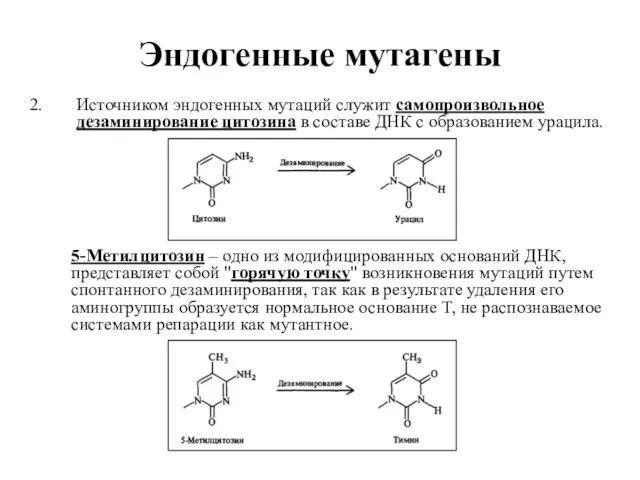
- 32. Эндогенные мутагены Источником эндогенных мутаций служит самопроизвольное дезаминирование цитозина в составе ДНК с образованием урацила. 5-Метилцитозин
- 33. Эндогенные мутагены Источником эндогенных мутагенов в организме является метаболизм нормальной микрофлоры. Некоторые промежуточные соединения, возникающие при
- 34. Часть 2 Механизмы репарации
- 35. Репарация генетических повреждений – это свойство живых организмов восстанавливать повреждения, возникшие в ДНК в результате ошибок
- 36. Общие сведения В настоящее время описано множество различных систем репарации, часто принципиально отличных друг от друга.
- 37. Основной принцип репарации Основан на двуспиральном строении ДНК. В большинстве случаев поврежденной оказывается только одна цепь
- 38. Повреждения ДНК Появление различно модифицированных оснований: Пиримидиновые димеры. Алкилированые производные. Дезаминированые основания. Различные таутомерные формы. Появление
- 39. Основные повреждающие факторы Ионизирующие агенты: Ультрафиолетовый свет. Радиоактивные вещества. Активные формы кислорода. Химические мутагены (например алкилирующие
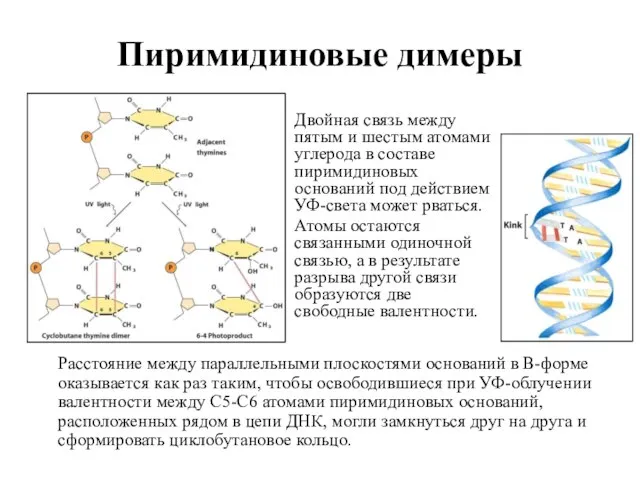
- 40. Пиримидиновые димеры Расстояние между параллельными плоскостями оснований в В-форме оказывается как раз таким, чтобы освободившиеся при
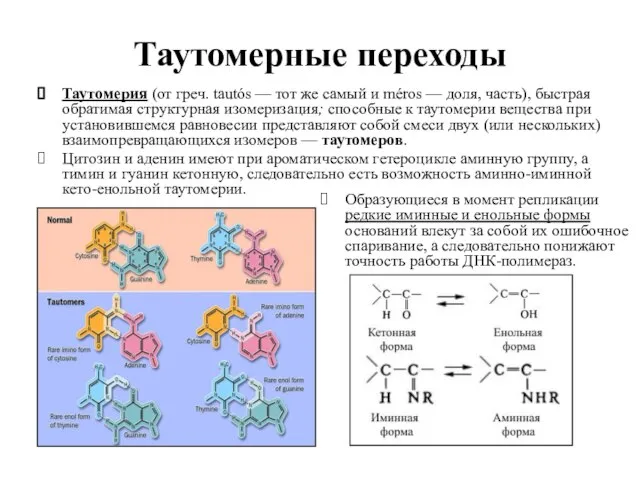
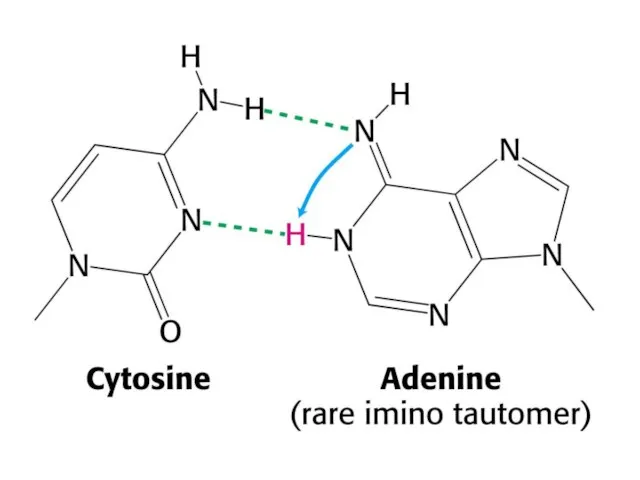
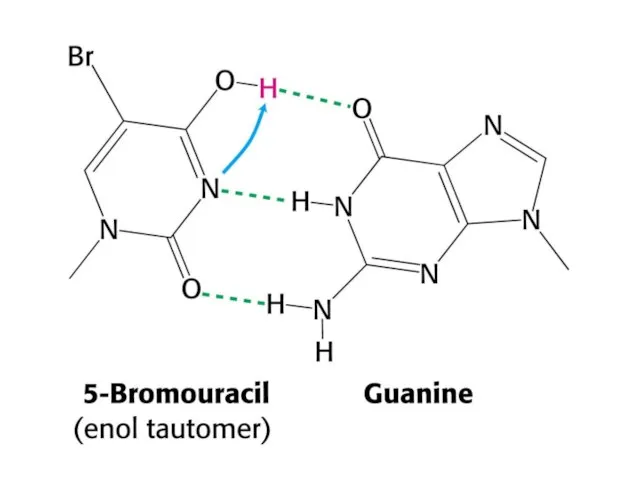
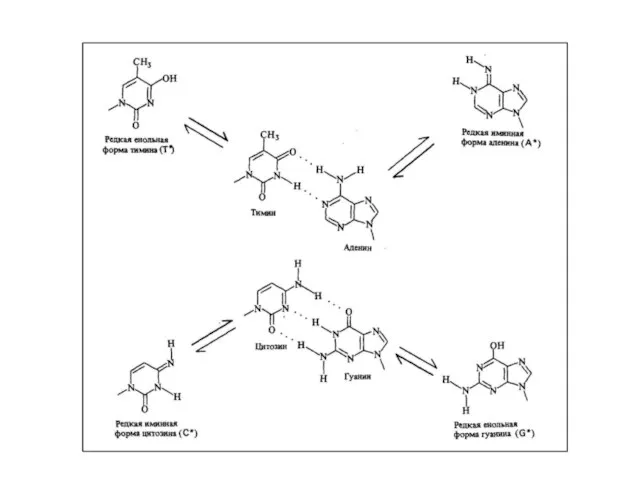
- 41. Таутомерные переходы Таутомерия (от греч. tautós — тот же самый и méros — доля, часть), быстрая
- 45. Разнообразие систем репарации Существует огромное количество самых различных систем репарации. Все эти системы появлялись в эволюции
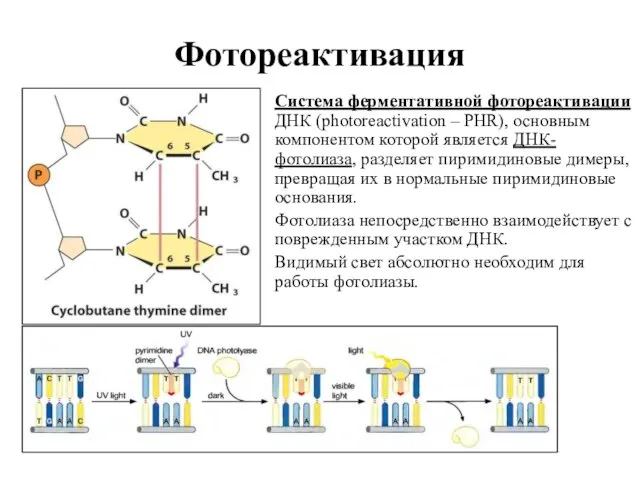
- 46. Разнообразие систем репарации Прямая репарация: Фотореактивация. Дезалкилирование модифицированных нуклеотидов. Сшивание однонитевых разрывов. Прямая вставка оснований в
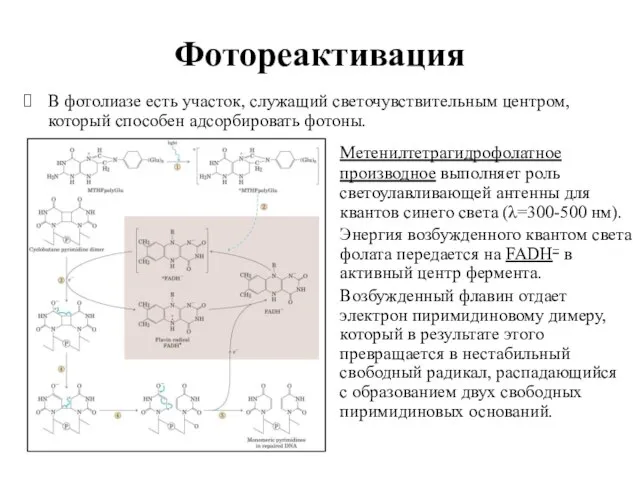
- 47. Фотореактивация В фотолиазе есть участок, служащий светочувствительным центром, который способен адсорбировать фотоны. Метенилтетрагидрофолатное производное выполняет роль
- 48. Фотореактивация Система ферментативной фотореактивации ДНК (photoreactivation – PHR), основным компонентом которой является ДНК-фотолиаза, разделяет пиримидиновые димеры,
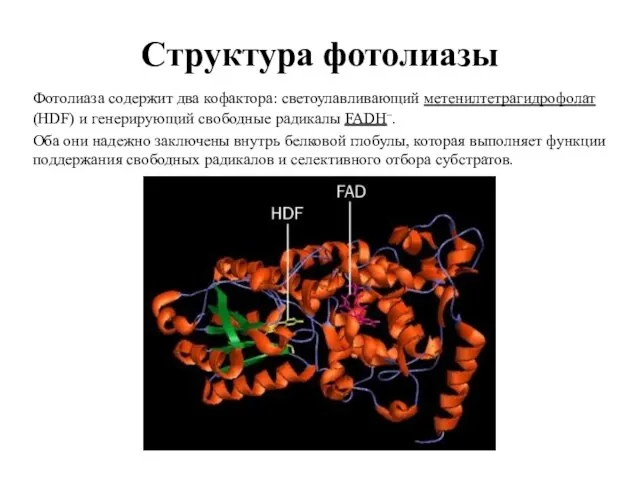
- 49. Структура фотолиазы Фотолиаза содержит два кофактора: светоулавливающий метенилтетрагидрофолат (HDF) и генерирующий свободные радикалы FADH–. Оба они
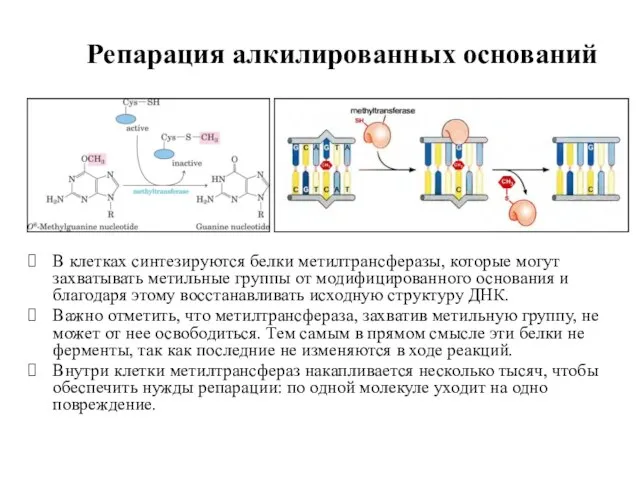
- 50. Репарация алкилированных оснований В клетках синтезируются белки метилтрансферазы, которые могут захватывать метильные группы от модифицированного основания
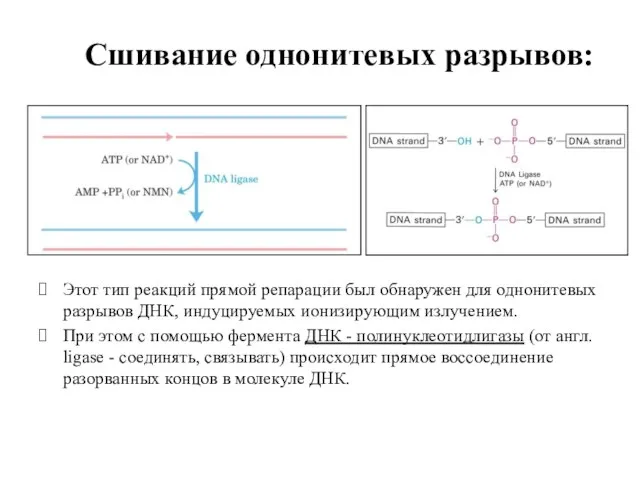
- 51. Сшивание однонитевых разрывов: Этот тип реакций прямой репарации был обнаружен для однонитевых разрывов ДНК, индуцируемых ионизирующим
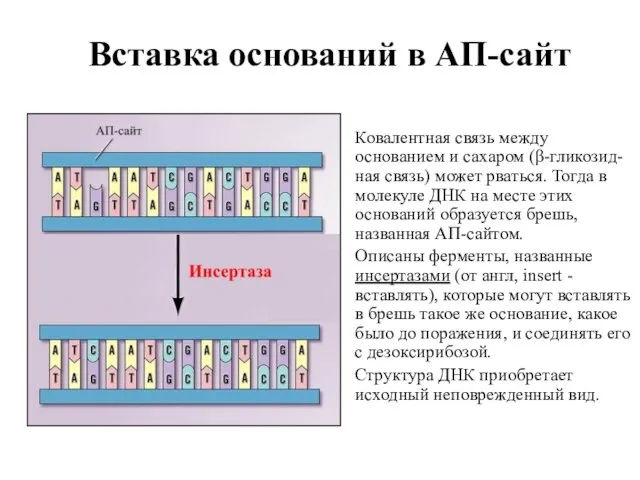
- 52. Вставка оснований в АП-сайт Ковалентная связь между основанием и сахаром (β-гликозид-ная связь) может рваться. Тогда в
- 53. Эксцизионная репарация ДНК путем удаления поврежденных азотистых оснований (BER)
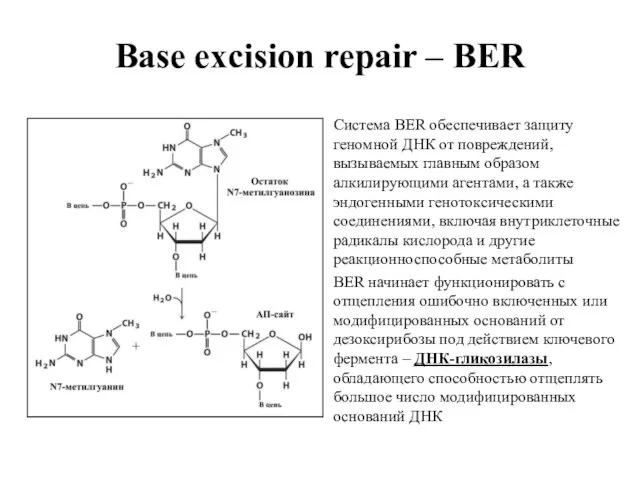
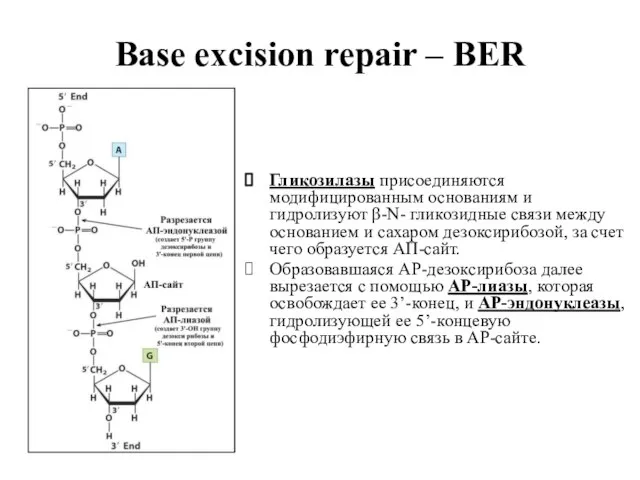
- 54. Base excision repair – BER Система BER обеспечивает защиту геномной ДНК от повреждений, вызываемых главным образом
- 55. Разнообразие гликозилаз
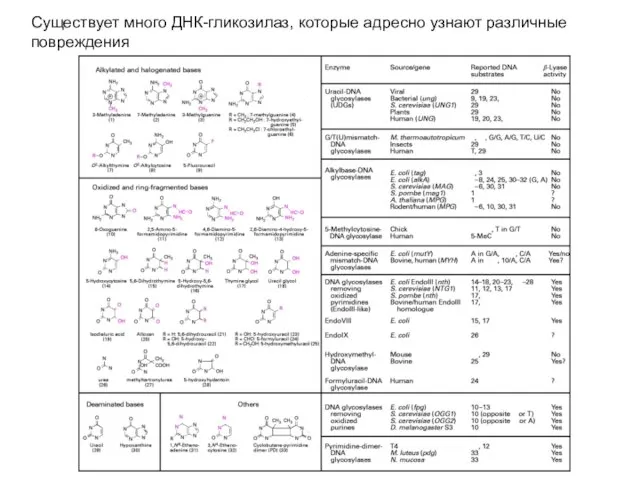
- 56. Существует много ДНК-гликозилаз, которые адресно узнают различные повреждения
- 57. Структура гликозилаз
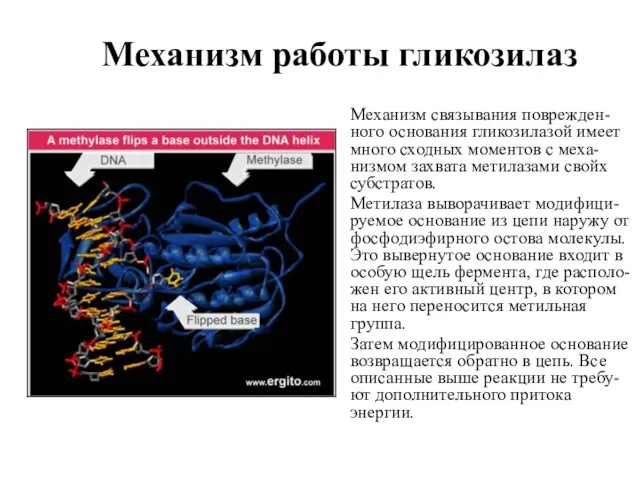
- 58. Механизм работы гликозилаз Механизм связывания поврежден-ного основания гликозилазой имеет много сходных моментов с меха-низмом захвата метилазами
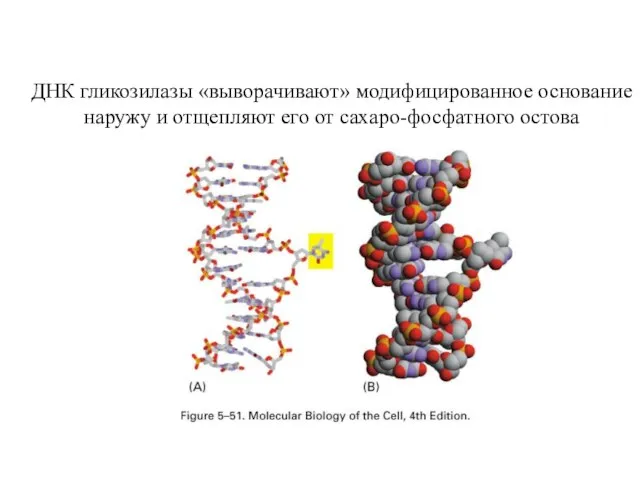
- 59. ДНК гликозилазы «выворачивают» модифицированное основание наружу и отщепляют его от сахаро-фосфатного остова
- 60. Base excision repair – BER Гликозилазы присоединяются модифицированным основаниям и гидролизуют β-N- гликозидные связи между основанием
- 61. Base excision repair – BER Появившаяся брешь в одной цепи ДНК размером в один нуклеотид застраивается
- 62. Эксцизионная репарация ДНК путем удаления нуклеотидов (NER)
- 63. Nucleotide excision repair – NER Процесс NER условно можно разделить на четыре этапа: Распознавание поврежденного участка
- 64. Nucleotide excision repair – NER В отличии от BER, субстратами системы NER являются не только поврежденные
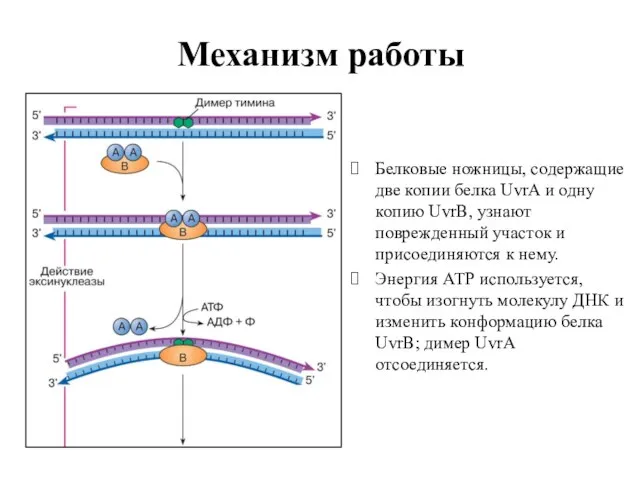
- 65. Механизм работы Белковые ножницы, содержащие две копии белка UvrA и одну копию UvrB, узнают поврежденный участок
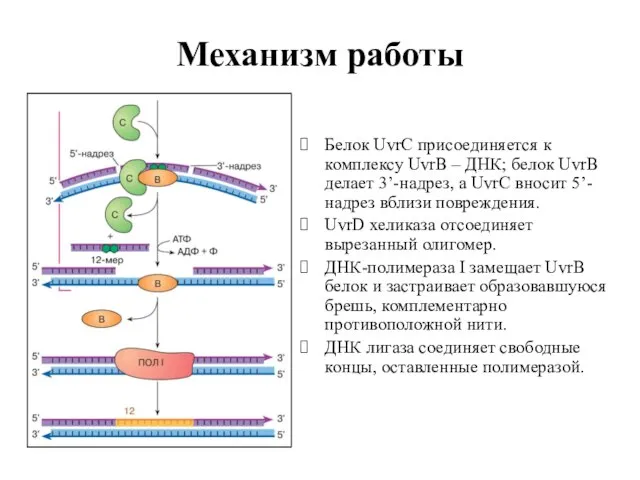
- 66. Механизм работы Белок UvrC присоединяется к комплексу UvrВ – ДНК; белок UvrВ делает 3’-надрез, а UvrC
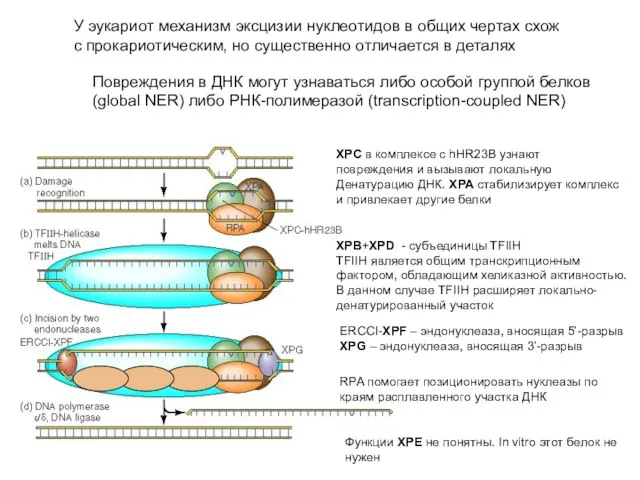
- 67. У эукариот механизм эксцизии нуклеотидов в общих чертах схож с прокариотическим, но существенно отличается в деталях
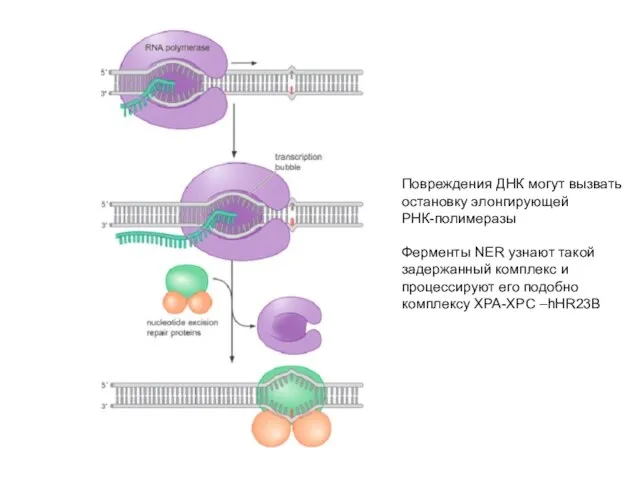
- 68. Повреждения ДНК могут вызвать остановку элонгирующей РНК-полимеразы Ферменты NER узнают такой задержанный комплекс и процессируют его
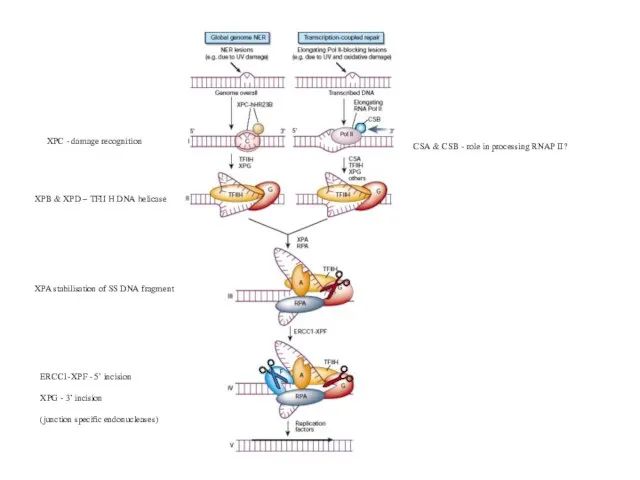
- 69. XPB & XPD – TFII H DNA helicase XPC - damage recognition XPA stabilisation of SS
- 70. Различия NER у про- и эукариот Гены NER у E. coli uvrA, uvrB и uvrC не
- 71. Репарация ошибочно спаренных нуклеотидов (MMR)
- 72. Mismatch repair - MMR В отличие от NER, так же удаляющей неправильно спаренные основания, MMR может
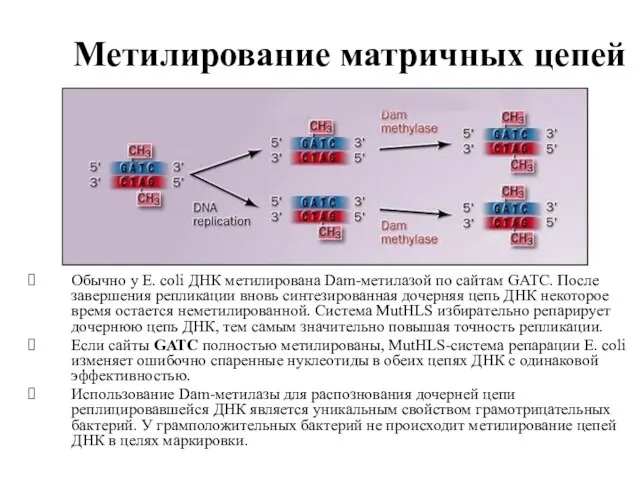
- 73. Метилирование матричных цепей Обычно у E. coli ДНК метилирована Dam-метилазой по сайтам GATC. После завершения репликации
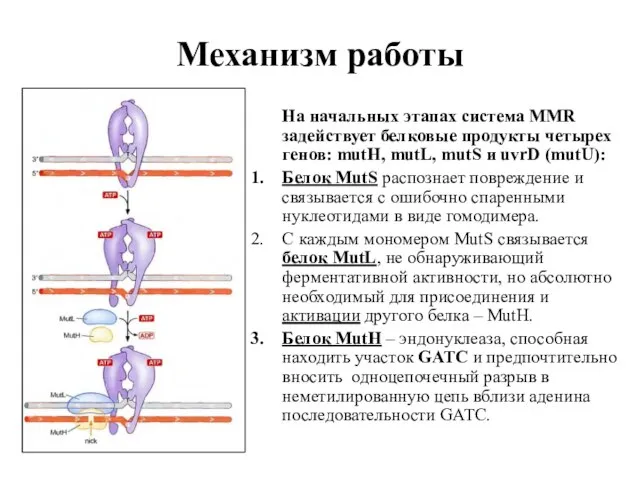
- 74. Механизм работы На начальных этапах система MMR задействует белковые продукты четырех генов: mutH, mutL, mutS и
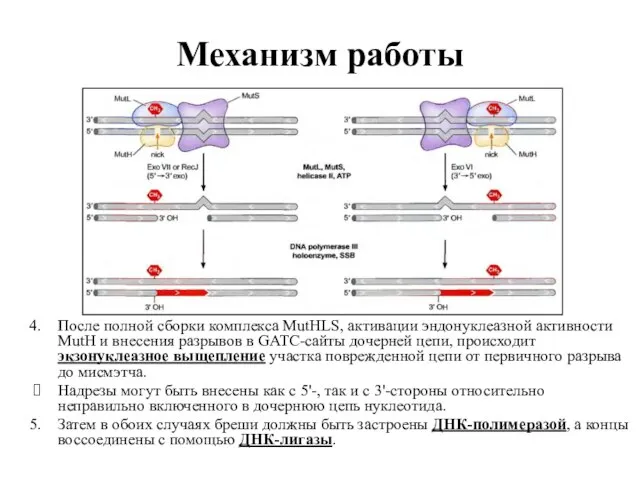
- 75. Механизм работы После полной сборки комплекса MutHLS, активации эндонуклеазной активности MutH и внесения разрывов в GATC-сайты
- 76. Другие системы У E. coli существуют два других специфических пути репарации ошибочно спаренных нуклеотидов: Система VSP
- 77. гомологи MutS (MSH — MutS homolog) образуют два гетеродимерных комплекса -- MSH2-MSH6 (MutSα) узнает неспаренные нуклеотиды
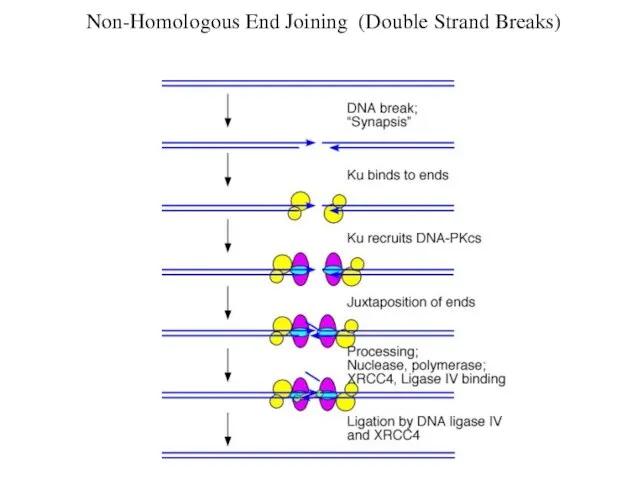
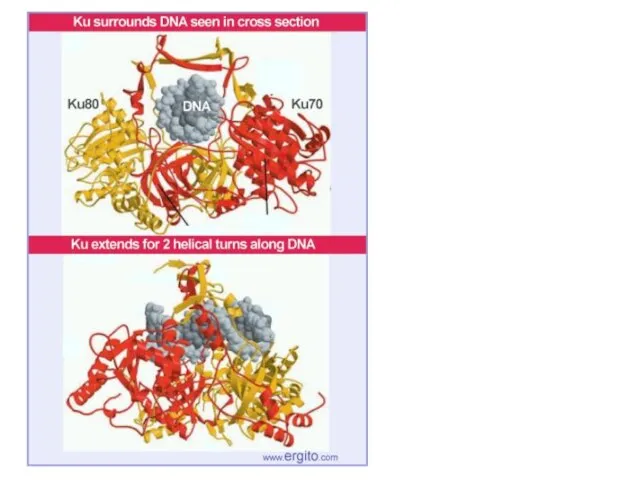
- 78. Non-Homologous End Joining (Double Strand Breaks)
- 80. Пострепликативная (рекомбинационная) репарация
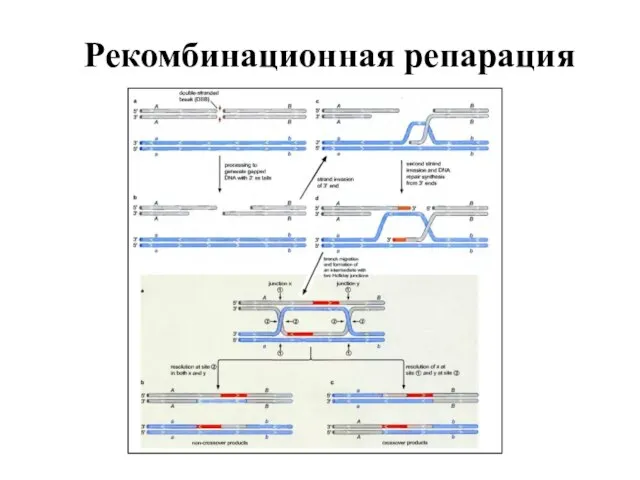
- 81. Рекомбинационная репарация Быстро делящиеся бактериальные клетки, содержащие несколько репликонов, образованных недореплицированными хромосомами, более устойчивы к действию
- 82. Рекомбинационная репарация Рекомбинационная репарация необходима в случае, когда повреждены обе цепи ДНК, что может быть результатом:
- 83. Рекомбинационная репарация Второй дуплекс ДНК, полученный в результате репликации, не содержит в себе разрывов или модифицированных
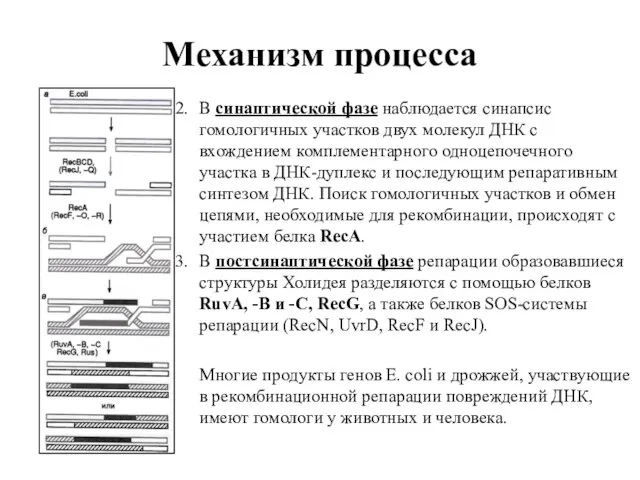
- 84. Механизм процесса Главный этап рекомбинационной репарации заключается в активации генов rec, участвующих так же и в
- 85. Механизм процесса В синаптической фазе наблюдается синапсис гомологичных участков двух молекул ДНК с вхождением комплементарного одноцепочечного
- 86. Рекомбинационная репарация
- 87. Часть 3 SOS-репарация и SOS-мутагенез
- 88. SOS-репарация В клетках организма, подвергнутого сильному мутагенному воздействию, образование мутаций происходит в основном по механизму SOS-мутагенеза.
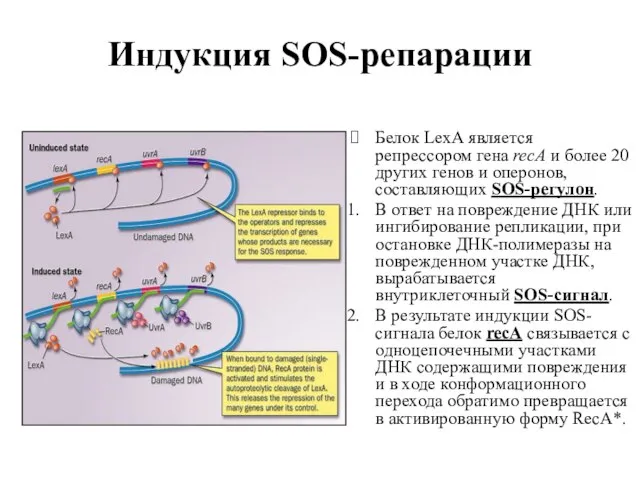
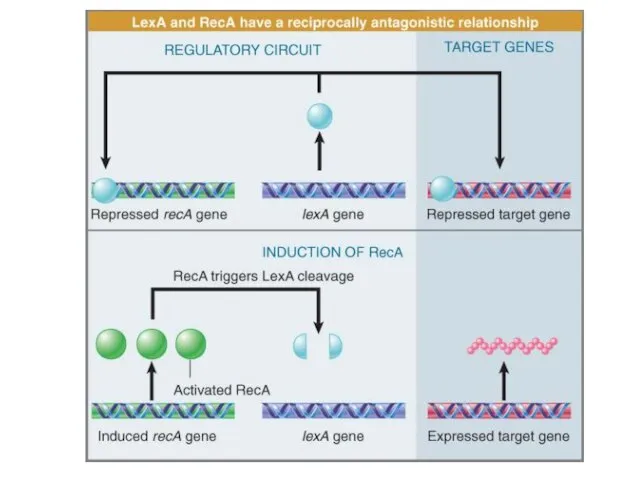
- 89. Индукция SOS-репарации Белок LexA является репрессором гена recA и более 20 других генов и оперонов, составляющих
- 90. Активация белка RecA Точно еще не выяснено как индукции SOS-сигнала, как и его природа, влияет на
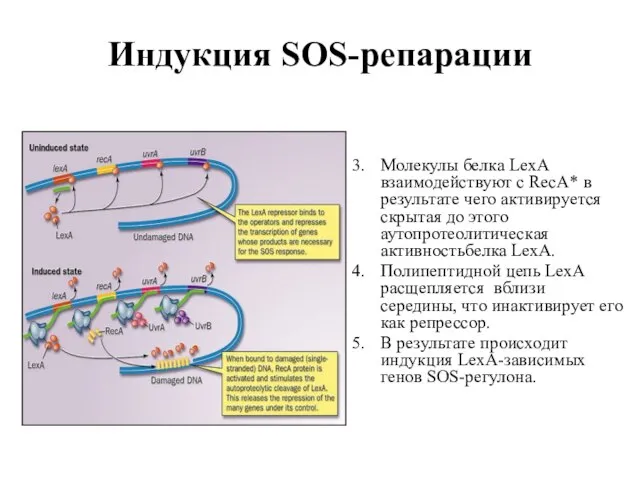
- 91. Индукция SOS-репарации Молекулы белка LexA взаимодействуют с RecA* в результате чего активируется скрытая до этого аутопротеолитическая
- 92. Основные термины SOS-репарация (мутагенез) – это согласованная индукция множества ферментов, включая ферменты репарации, в ответ на
- 93. Индукция SOS-репарации Ключевыми белками, задействоваными в процессе введения ошибок ДНК-полимеразой, являются продукты двух генов – umuD
- 94. ДНК-полимераза 5 Настоящая роль белкового комплекса (UmuD’)2–UmuC в процессе SOS-репарации неизвестна. Существует две основных концепции: Комплекс
- 95. Индукция SOS-репарации Когда репликаза (ДНК-полимераза 3) доходит до некоторого повреждения, например тиминового димера, она останавливается. Белок
- 96. Таким образом белок RecA играет ключевую роль в индукции SOS-репарации, выполняя следующие важные функции: Взаимодействует с
- 97. ДНК-полимераза 4 ДНК-полимераза IV E. coli, кодируемая геном dinB, также участвует в SOS-ответе бактерий: Она не
- 98. После того, как весь геном был успешно реплицирован, путем введения мутации в последовательности, которые блокировали продвижение
- 99. Вырезание профагов Активация RecA так же может являться причиной расщепления и других репрессорных белков, например репрессоров
- 100. Прежде всего об остановке репликации надо сообщить Rec A Cвязывается с однонитевой ДНК и образует ДНК-белковые
- 101. lexA, recA, uvrA, uvrB, and uvrD Филаменты Rec A стимулируют аутопротеолиз Lex A При снижении концентрации
- 103. UmuD повергается автопротеолитическому расщеплению с образованием активного фрагмента UmuD’ UmuD’ активирует черезблоковую полимеразу UmuC комплекс (UmuD’)2-UmuC
- 106. Скачать презентацию
























































 Социальная стратификация и мобильность
Социальная стратификация и мобильность ФормЫ обращений в английском языке как компоненты эмоциональности речи
ФормЫ обращений в английском языке как компоненты эмоциональности речи Malsharuashylyq
Malsharuashylyq Диод КД103. Диод кремниевый диффузионный
Диод КД103. Диод кремниевый диффузионный ВЫЕЗДНОЕ ЗАСЕДАНИЕ СТУДЕНЧЕСКОГО СОВЕТА 16-18 октября 2009
ВЫЕЗДНОЕ ЗАСЕДАНИЕ СТУДЕНЧЕСКОГО СОВЕТА 16-18 октября 2009 Организационный менеджмент
Организационный менеджмент Банковская система. Функции банков
Банковская система. Функции банков Фразеологизмите
Фразеологизмите Шолохов
Шолохов Реформа электроэнергетики: Финишная прямая
Реформа электроэнергетики: Финишная прямая Микрофинансирование в банковском секторе РоссииБанк развития KfW
Микрофинансирование в банковском секторе РоссииБанк развития KfW Политические партии
Политические партии Основы конституционного строя России. Конституционный строй и его принципы
Основы конституционного строя России. Конституционный строй и его принципы Интеграционные процессы в Африке
Интеграционные процессы в Африке Процессоры фирмы Intel до Pentium III
Процессоры фирмы Intel до Pentium III Восточные единоборства
Восточные единоборства Игрушки Агния Барто
Игрушки Агния Барто Автомобилестроение, авиастроение. Легкая и мебельная промышленность
Автомобилестроение, авиастроение. Легкая и мебельная промышленность Team System - фреймворк для автоматизации тестирования от Microsoft
Team System - фреймворк для автоматизации тестирования от Microsoft МОДУЛЬ «БРОНИРОВАНИЕ»
МОДУЛЬ «БРОНИРОВАНИЕ»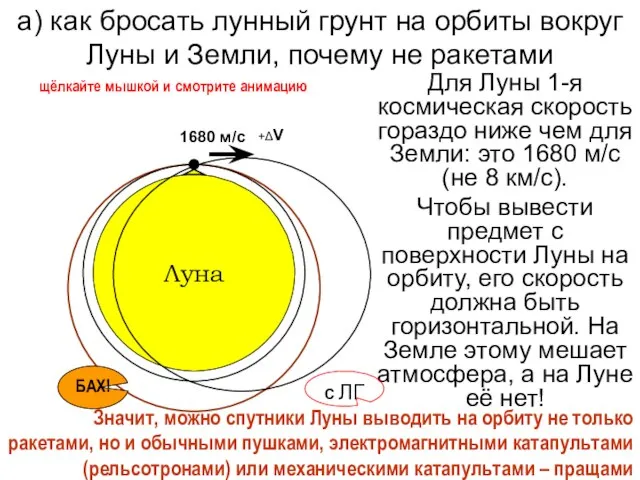 а) как бросать лунный грунт на орбиты вокруг Луны и Земли, почему не ракетами
а) как бросать лунный грунт на орбиты вокруг Луны и Земли, почему не ракетами О Т Ч Е То работе Управления записи актов гражданского состояния за 2004 год
О Т Ч Е То работе Управления записи актов гражданского состояния за 2004 год Українська мова. 4 клас
Українська мова. 4 клас PHIL 1- Lecture 3 - Week 3 moodle
PHIL 1- Lecture 3 - Week 3 moodle Эвены
Эвены Что такое предпринимательство и бизнес + конспект
Что такое предпринимательство и бизнес + конспект © МОУ СОШ №6, г.Тутаев, 2006
© МОУ СОШ №6, г.Тутаев, 2006 ТЕАТР XIX ВЕКА Западноевропейский театр романтизма и реализма Русский театр романтизма и реализма
ТЕАТР XIX ВЕКА Западноевропейский театр романтизма и реализма Русский театр романтизма и реализма