Содержание
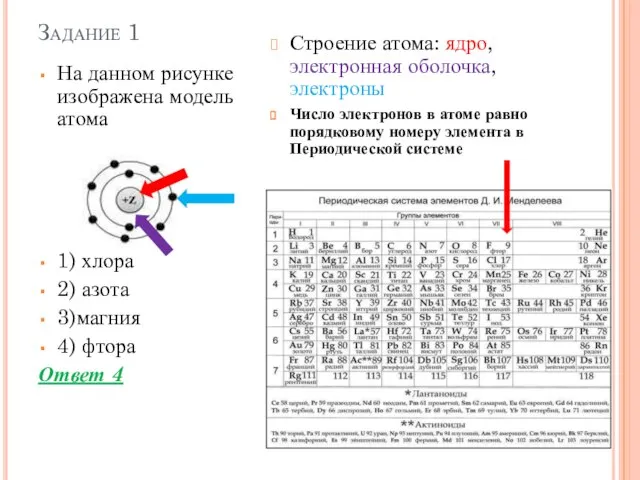
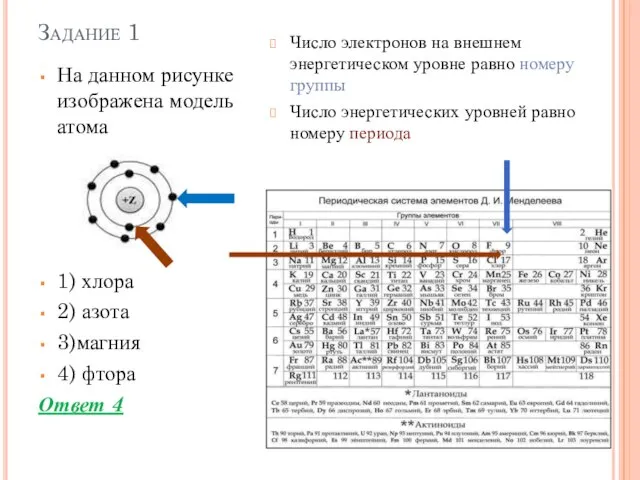
- 2. Задание 1 На данном рисунке изображена модель атома 1) хлора 2) азота 3)магния 4) фтора Ответ
- 3. Задание 1 На данном рисунке изображена модель атома 1) хлора 2) азота 3)магния 4) фтора Ответ
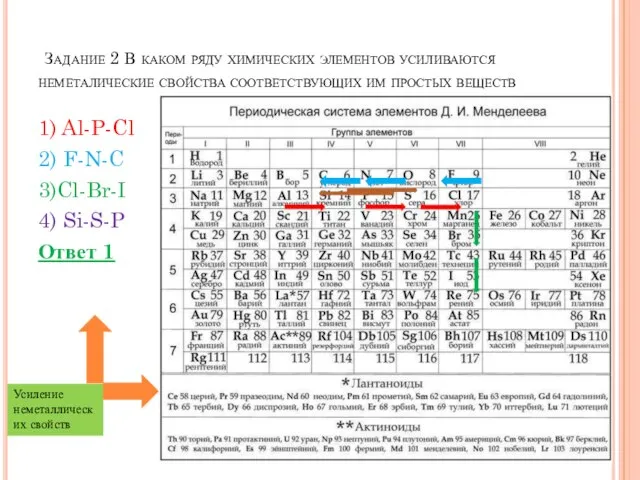
- 4. Задание 2 В каком ряду химических элементов усиливаются неметалические свойства соответствующих им простых веществ 1) Al-P-Cl
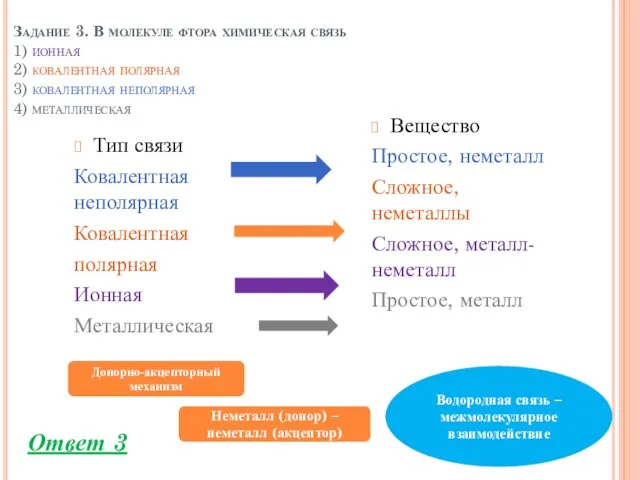
- 5. Задание 3. В молекуле фтора химическая связь 1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4)
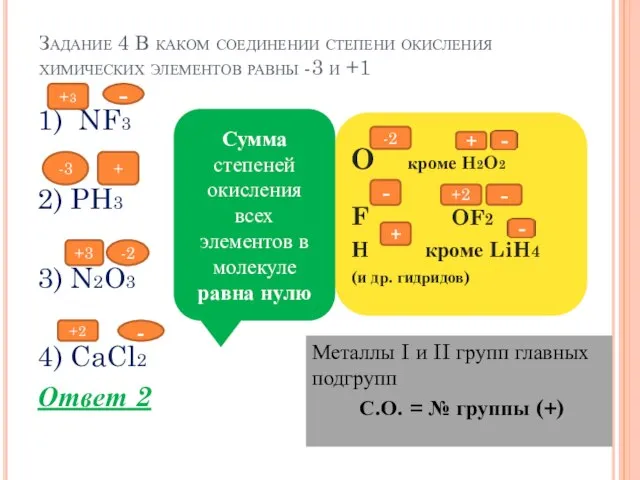
- 6. Задание 4 В каком соединении степени окисления химических элементов равны -3 и +1 Металлы I и
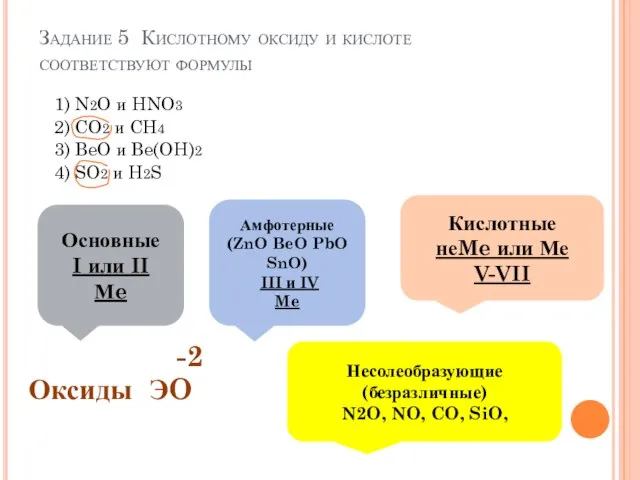
- 7. Задание 5 Кислотному оксиду и кислоте соответствуют формулы 1) N2O и HNO3 2) CO2 и CH4
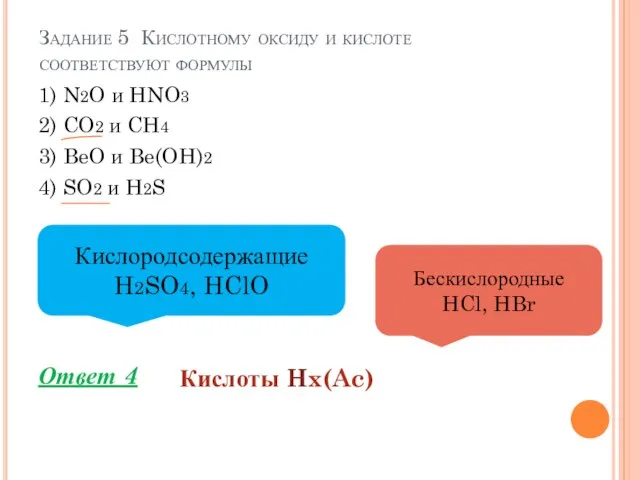
- 8. Задание 5 Кислотному оксиду и кислоте соответствуют формулы 1) N2O и HNO3 2) CO2 и CH4
- 9. Задание 6 Признаком протекания химической реакции между гидроксидом меди (II) и хлороводородной кислотой является Cu(OH)2+HCl =CuCl2+H2O
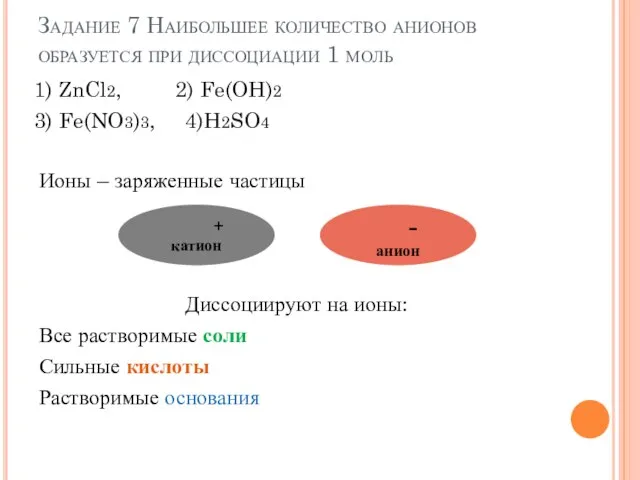
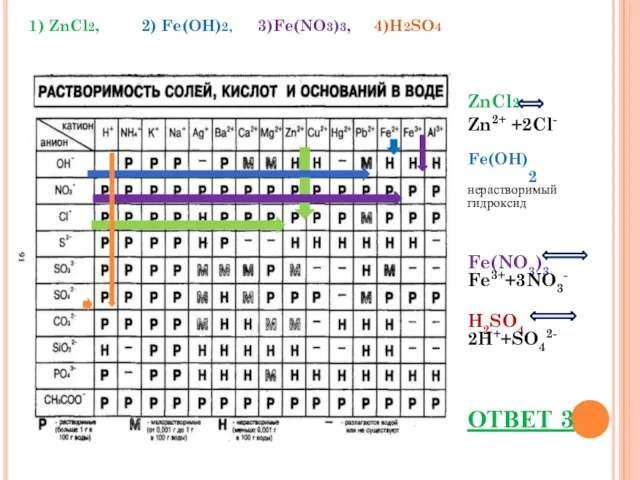
- 10. Задание 7 Наибольшее количество анионов образуется при диссоциации 1 моль 1) ZnCl2, 2) Fe(OH)2 3) Fe(NO3)3,
- 11. ZnCl2 Zn2+ +2Cl- Fe(OH)2 нерастворимый гидроксид Fe(NO3)3 Fe3++3NO3- H2SO4 2H++SO42- ОТВЕТ 3 1) ZnCl2, 2) Fe(OH)2,
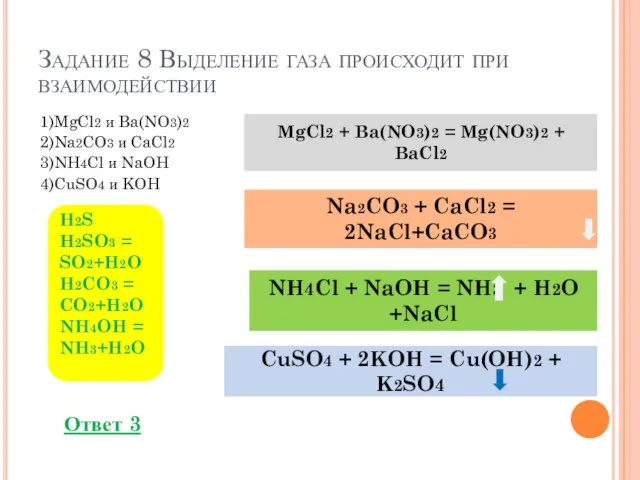
- 12. Задание 8 Выделение газа происходит при взаимодействии 1)MgCl2 и Ba(NO3)2 2)Na2CO3 и CaCl2 3)NH4Cl и NaOH
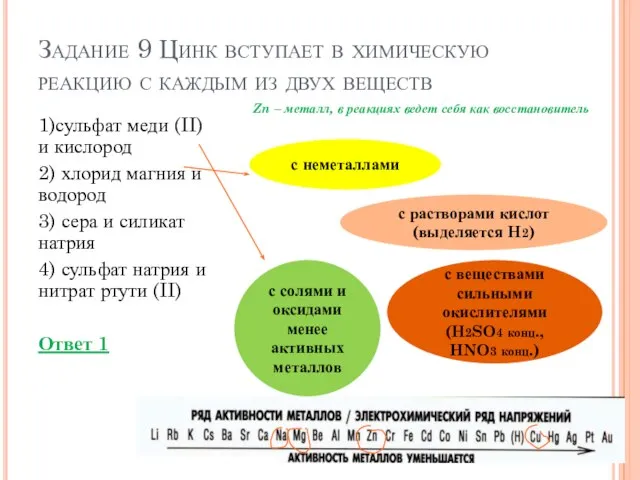
- 13. Задание 9 Цинк вступает в химическую реакцию с каждым из двух веществ 1)сульфат меди (II) и
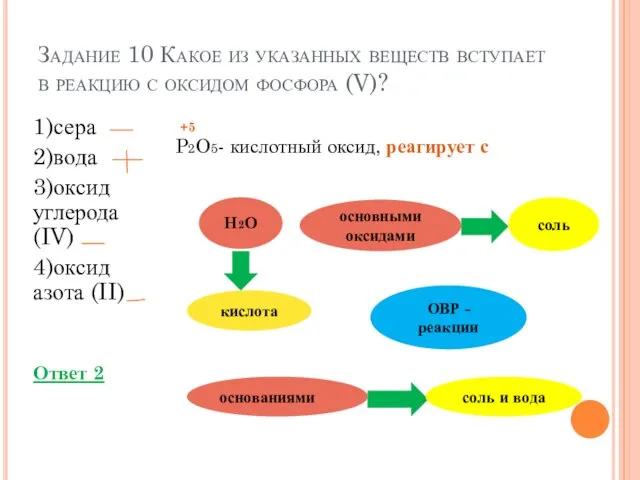
- 14. Задание 10 Какое из указанных веществ вступает в реакцию с оксидом фосфора (V)? 1)сера 2)вода 3)оксид
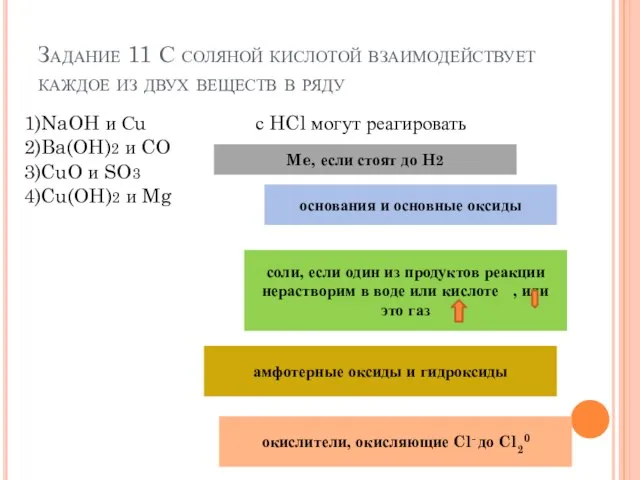
- 15. Задание 11 С соляной кислотой взаимодействует каждое из двух веществ в ряду 1)NaOH и Сu 2)Ba(OH)2
- 16. Задание 11 С соляной кислотой взаимодействует каждое из двух веществ в ряду 1)NaOH и Сu 2)Ba(OH)2
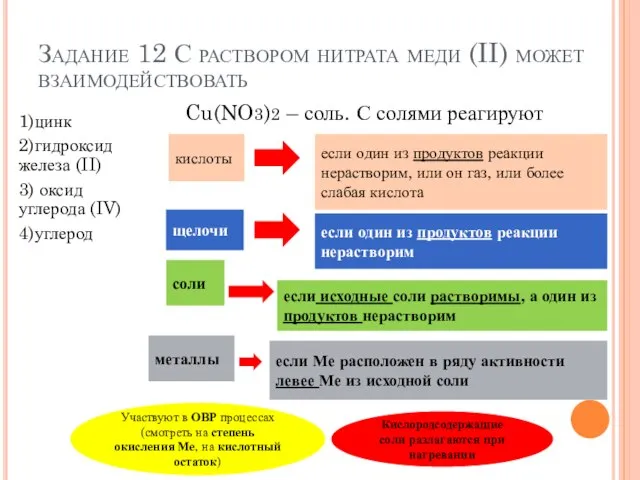
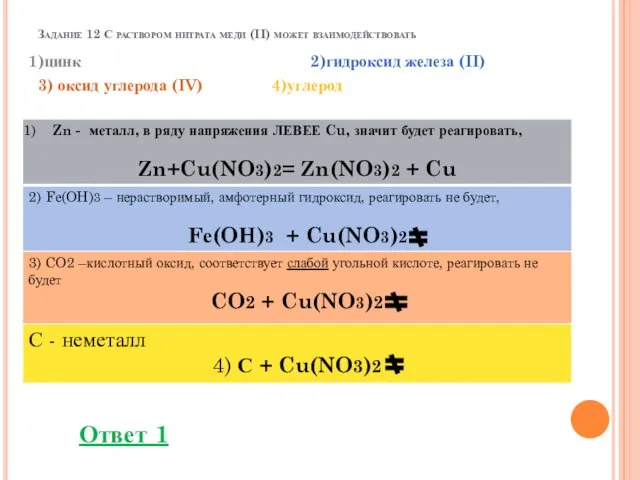
- 17. Задание 12 С раствором нитрата меди (II) может взаимодействовать 1)цинк 2)гидроксид железа (II) 3) оксид углерода
- 18. Задание 12 С раствором нитрата меди (II) может взаимодействовать 1)цинк 2)гидроксид железа (II) 3) оксид углерода
- 19. Задание 13 Отделить бензин от воды можно с помощью 1)фильтрования 2)делительной воронки 3) магнита 4)отстаивания Ответ
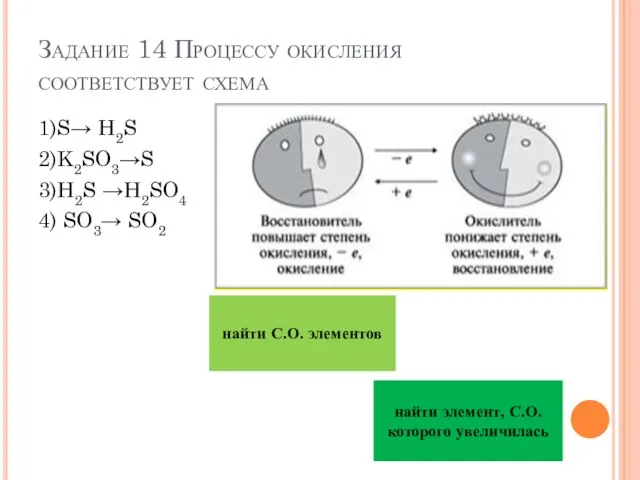
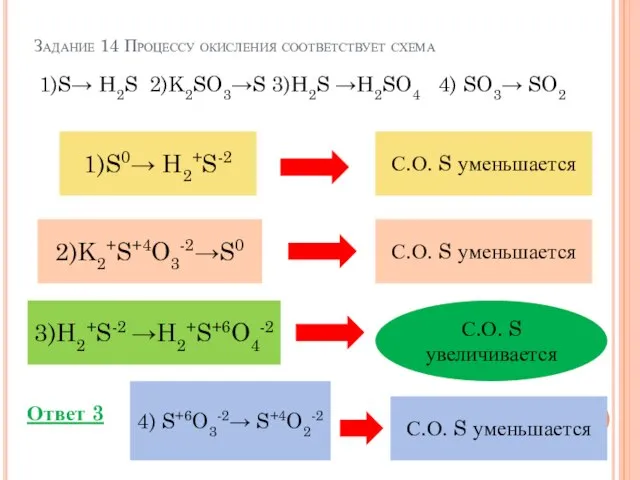
- 20. Задание 14 Процессу окисления соответствует схема 1)S→ H2S 2)K2SO3→S 3)H2S →H2SO4 4) SO3→ SO2 найти С.О.
- 21. Задание 14 Процессу окисления соответствует схема 1)S→ H2S 2)K2SO3→S 3)H2S →H2SO4 4) SO3→ SO2 Ответ 3
- 22. Задание 15 Массовая доля хлора в оксиде хлора (VII) равна 1)19,4% 2)24.0% 3)30,5% 4)38,8% Формула оксида
- 24. Скачать презентацию




 Логические упражнения для развития речи
Логические упражнения для развития речи Новинки. Линолеум 2018. Tarkett для ГК Монарх
Новинки. Линолеум 2018. Tarkett для ГК Монарх Масштаб. История масштаба в чертежах
Масштаб. История масштаба в чертежах Продавец-консультант
Продавец-консультант Тип Хордовые. Общие признаки
Тип Хордовые. Общие признаки День учителя (1)
День учителя (1) Презентация на тему Микеланджело Буонаррооти
Презентация на тему Микеланджело Буонаррооти Ждущий мультивибратор
Ждущий мультивибратор Орфоэпический словарик русского языка
Орфоэпический словарик русского языка СОВРЕМЕННЫЙ ОФИЦИАЛЬНЫЙ ПОРТАЛ ОРГАНОВ ГОСУДАРСТВЕННОЙ ВЛАСТИ СУБЪЕКТА РФ – УПРАВЛЕНЧЕСКИЕ ЗАДАЧИ И ТЕХНИЧЕСКИЕ АСПЕКТЫ РЕАЛИЗ
СОВРЕМЕННЫЙ ОФИЦИАЛЬНЫЙ ПОРТАЛ ОРГАНОВ ГОСУДАРСТВЕННОЙ ВЛАСТИ СУБЪЕКТА РФ – УПРАВЛЕНЧЕСКИЕ ЗАДАЧИ И ТЕХНИЧЕСКИЕ АСПЕКТЫ РЕАЛИЗ Партийный проект «500 БАССЕЙНОВ»
Партийный проект «500 БАССЕЙНОВ» Игры и игровые ситуации на уроках биологии
Игры и игровые ситуации на уроках биологии 2 фауст
2 фауст Фотоальбом
Фотоальбом Процедурное программирование
Процедурное программирование  Презентация на тему Сезонные изменения в лесу
Презентация на тему Сезонные изменения в лесу  Психокоррекционные занятия Игры со средней мозаикой
Психокоррекционные занятия Игры со средней мозаикой Псалом 117, мессианский
Псалом 117, мессианский Сценарий театрализованного представления. Структура и форма записи
Сценарий театрализованного представления. Структура и форма записи Что такое государство
Что такое государство ОиНТ_
ОиНТ_ Флористический дизайн
Флористический дизайн Пнемокониозы: классификация. Силикоз: этиология, патогенез, клиника, диагностика, терапия, экспертиза трудоспособности, профилак
Пнемокониозы: классификация. Силикоз: этиология, патогенез, клиника, диагностика, терапия, экспертиза трудоспособности, профилак Тема урока:«Момент силы»
Тема урока:«Момент силы» Безопасность электронного бизнеса: от пользователя до виртуальной инфраструктуры
Безопасность электронного бизнеса: от пользователя до виртуальной инфраструктуры УСТРОЙСТВО АВТОМАТИЧЕСКОГО ОГРАНИЧЕНИЯ ПЕРЕГРУЗКИ ЛИНИЙ :ТЕОРИЯ И ПРАКТИКА
УСТРОЙСТВО АВТОМАТИЧЕСКОГО ОГРАНИЧЕНИЯ ПЕРЕГРУЗКИ ЛИНИЙ :ТЕОРИЯ И ПРАКТИКА Презентация на тему Алфавит
Презентация на тему Алфавит  Цифровое фото и видео
Цифровое фото и видео