Содержание
- 2. Что мы узнаем? (план урока) Как классифицируют вещества? Как отличить оксиды от других веществ? Какие бывают
- 3. Классификация неорганических веществ
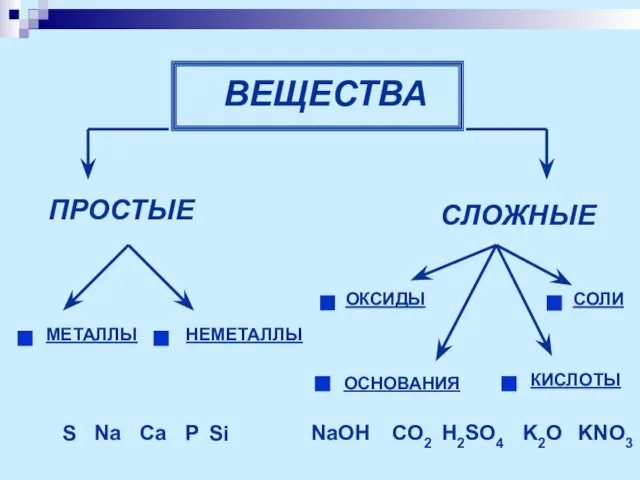
- 4. ВЕЩЕСТВА ПРОСТЫЕ СЛОЖНЫЕ ОКСИДЫ ОСНОВАНИЯ КИСЛОТЫ СОЛИ S Na Ca P Si NaOH CO2 H2SO4 K2O
- 5. Оксиды Оксиды – бинарные соединения элементов с кислородом в степени окисления -2. Задание: составьте формулы и
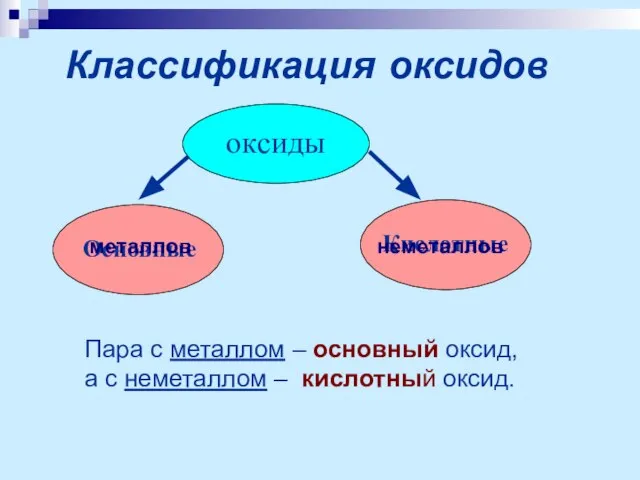
- 6. Классификация оксидов оксиды Основные Кислотные Пара с металлом – основный оксид, а с неметаллом – кислотный
- 7. Основные оксиды – оксиды металлов, которым соответствуют основания. Кислотные оксиды – оксиды неметаллов, которым соответствуют кислоты.
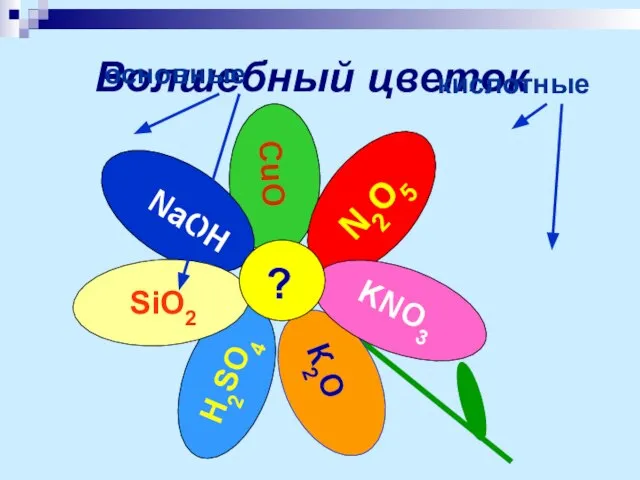
- 8. Волшебный цветок ? основные кислотные
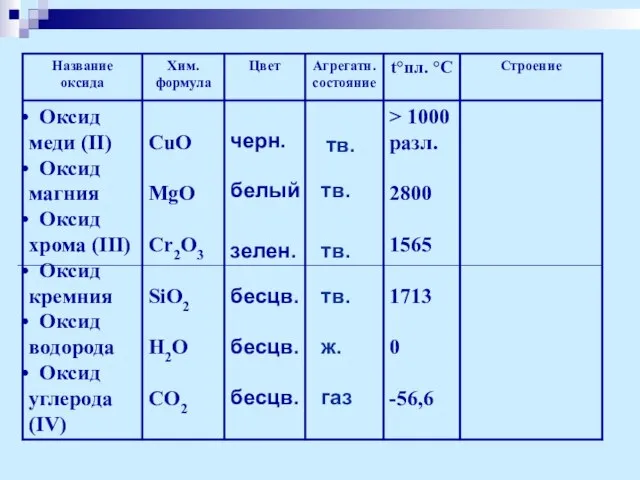
- 9. Физические свойства оксидов
- 10. черн. белый зелен. бесцв. бесцв. бесцв. тв. тв. тв. тв. ж. газ
- 11. Получение оксидов
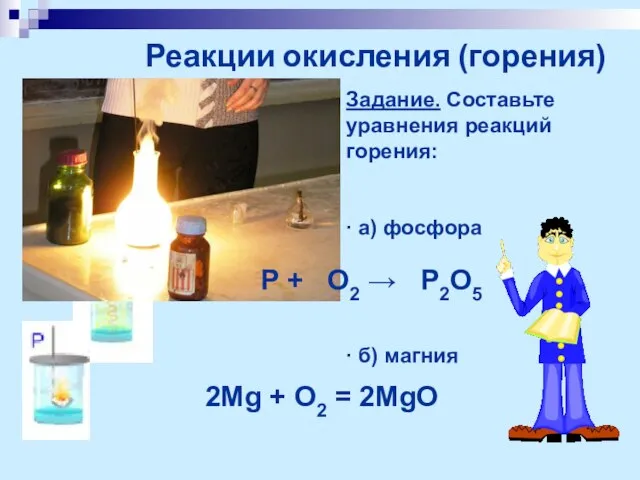
- 12. Реакции окисления (горения) Задание. Составьте уравнения реакций горения: ∙ а) фосфора ∙ б) магния 2Mg +
- 13. Применение оксидов
- 14. Единственное вещество, которое встречается на Земле во всех трех агрегатных состояниях Твердый лед можно увидеть и
- 15. Содержание воды в природе Запасы воды на Земле 1млн 454тыс м3 из них менее 2% относится
- 16. Расход воды в мире (в м3 на человека в сутки)
- 17. Оксид кремния (IV) SiO2 Кварц, кремень, горный хрусталь, аметист, яшма, опал — все это оксид кремния
- 18. ОКСИД ХРОМА (III) - Cr2O3 Используют как пигмент при изготовлении декоративного зеленого стекла , керамики, зеленой
- 19. Проверь себя: Исключи лишнее: 1.CO2 2.NaOH 3.CaO 4.SiO2 2.P2O5 1.К2О 4.CuO 2.OF2 3.N2O5 Составь уравнения реакций
- 21. Скачать презентацию













 Налоговая задолженность
Налоговая задолженность Проектирование автоматизированной системы управления охранной и пожарной безопасности на территории склада
Проектирование автоматизированной системы управления охранной и пожарной безопасности на территории склада Древнейшие цивилизации
Древнейшие цивилизации Тестовые задания
Тестовые задания Основные этапы работы над проектом
Основные этапы работы над проектом Волейбол. Техника приема мяча снизу двумя руками
Волейбол. Техника приема мяча снизу двумя руками Royal Society for the Prevention of Cruelty to Animals
Royal Society for the Prevention of Cruelty to Animals Современные подходы к подготовке содержимого онлайн-курсов в системе Blackboard
Современные подходы к подготовке содержимого онлайн-курсов в системе Blackboard Презентация на тему Семь дней недели
Презентация на тему Семь дней недели Виды выносливости и методика её развития
Виды выносливости и методика её развития Художественно-техническое оформление изданий
Художественно-техническое оформление изданий Рогатые насекомые
Рогатые насекомые Seasons of the year
Seasons of the year Салон красоты Medeo
Салон красоты Medeo Информационные технологии в дизайне
Информационные технологии в дизайне Моя библиотека
Моя библиотека Реализация приоритетного национального проекта «Образование»
Реализация приоритетного национального проекта «Образование» Исследование систем управления на ОАО АвиоСар
Исследование систем управления на ОАО АвиоСар Презентация
Презентация  Волонтеры наследия Северо-Запада
Волонтеры наследия Северо-Запада Нормирование оборотных средств
Нормирование оборотных средств Мастерская. Изготовление дубликатов ключей. Ремонт обуви
Мастерская. Изготовление дубликатов ключей. Ремонт обуви Некоторые проблемы и итоги Великой Отечественной войны
Некоторые проблемы и итоги Великой Отечественной войны Предприниматель. Предпринимательская деятельность
Предприниматель. Предпринимательская деятельность ПЕРСПЕКТИВЫ РАЗВИТИЯ ИНСТИТУТА СТРАХОВОГО ОМБУДСМАНА РЕСПУБЛИКИ КАЗАХСТАН Алматы 2008г.
ПЕРСПЕКТИВЫ РАЗВИТИЯ ИНСТИТУТА СТРАХОВОГО ОМБУДСМАНА РЕСПУБЛИКИ КАЗАХСТАН Алматы 2008г. Заболевания кожи
Заболевания кожи LR5_1ch__Stoimostnye_kharakteristiki_informatsionnoy_deyatelnosti
LR5_1ch__Stoimostnye_kharakteristiki_informatsionnoy_deyatelnosti Процессуальные документы. Уголовное судопроизводство
Процессуальные документы. Уголовное судопроизводство