Содержание
- 2. Обсудим следующие вопросы: Зачем нужны знания о скорости химических реакций? Какими примерами можно подтвердить то, что
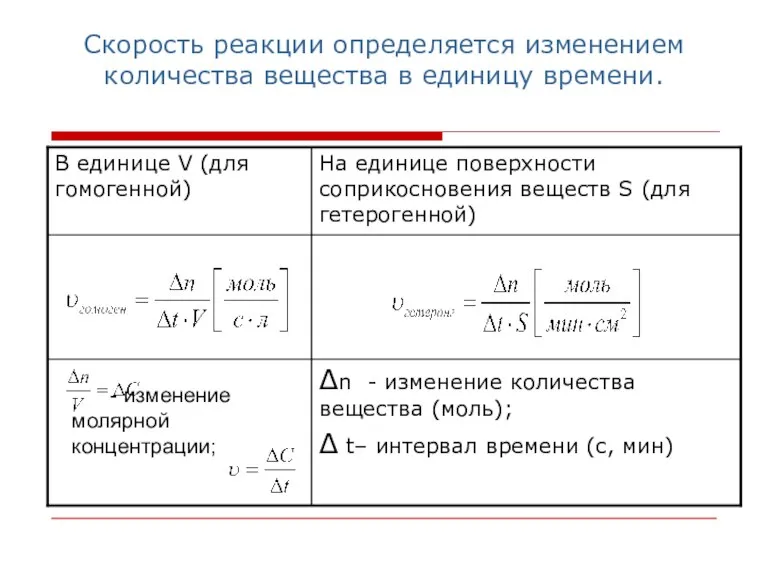
- 3. Скорость реакции определяется изменением количества вещества в единицу времени. - изменение молярной концентрации;
- 4. Анализ таблицы, выводы: по приведённым формулам можно рассчитать лишь некоторую среднюю скорость данной реакции в выбранном
- 5. Задача на применение знаний по «Скорости химических реакций» Химическая реакция протекает в растворе, согласно уравнению: А+В
- 6. Самопроверка.
- 7. Факторы, влияющие на скорость химической реакции природа реагирующих веществ; температура; концентрация реагирующих веществ; действие катализаторов; поверхность
- 8. Теория столкновений. Основная идея теории: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией. Выводы:
- 9. 1. Природа реагирующих веществ. Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в
- 10. Задание на применение знаний Объясните разную скорость взаимодействия цинка и магния с уксусной кислотой; цинка с
- 11. 2. Температура При увеличении температуры на каждые 10° С общее число столкновений увеличивается только на ~
- 12. Задача на применение знаний: Определите, как изменится скорость некоторой реакции: а) при повышении температуры от 10°
- 13. Самопроверка а) подставить данные задачи в формулу: скорость реакции увеличится в 81 раз. б) Скорость реакции
- 14. 3. Концентрации реагирующих веществ. На основе большого экспериментального материала в 1867 г. норвежские учёные К. Гульдберг,
- 15. Математическое выражение закона действующих масс. По закону действующих масс скорость реакции, уравнение которой А+В=С может быть
- 16. Задача на применение знаний: 1. Составьте кинетические уравнения для следующих реакций: А) H2+I2=2HI; Б) 2 Fe
- 17. Самопроверка. Решение. Подставим соответствующие данные в кинетическое уравнение, сравним скорости реакций. а) скорость реакции увеличится в
- 18. 4. Действие катализатора Обсуждение вопросов: 1.Что такое катализатор и каталитические реакции? 2. Приведите примеры известных вам
- 19. 5.Поверхность соприкосновения реагирующих веществ. Скорость реакции увеличивается благодаря: -увеличению площади поверхности соприкосновения реагентов (измельчение); -повышению реакционной
- 20. Выводы по теме урока Химические реакции протекают с различными скоростями. Величина скорости реакции не зависит от
- 22. Скачать презентацию


















 Денежные переводы физических лиц: состояние и тенденции развития (на примере ПАО Сбербанк)
Денежные переводы физических лиц: состояние и тенденции развития (на примере ПАО Сбербанк) Особенности истории информатики
Особенности истории информатики Мотивирование топ-менеджеров в банковской сфере: подходы и инструменты
Мотивирование топ-менеджеров в банковской сфере: подходы и инструменты = 1
= 1 Изустная среда мордовского села
Изустная среда мордовского села Показатели рыночной активности
Показатели рыночной активности Выхухоль. Красная книга
Выхухоль. Красная книга Обработка текстовой и графической информации. Создаём комбинированный документ
Обработка текстовой и графической информации. Создаём комбинированный документ Телевидение: я выбираю или меня выбирают. Автор и руководитель проекта: Симонова Ольга Владимировна 2004 год
Телевидение: я выбираю или меня выбирают. Автор и руководитель проекта: Симонова Ольга Владимировна 2004 год Что я сделаю, чтобы доверенный мне магазин стал лучшим на рынке
Что я сделаю, чтобы доверенный мне магазин стал лучшим на рынке Туалетная вода для мужчин Faberlic Intense
Туалетная вода для мужчин Faberlic Intense Межпроцедурные анализы и оптимизации
Межпроцедурные анализы и оптимизации Внешняя политика СССР в 1930-е гг. и накануне Великой Отечественной войны
Внешняя политика СССР в 1930-е гг. и накануне Великой Отечественной войны Урок 3 Человек и Бог в православии-повторение
Урок 3 Человек и Бог в православии-повторение 17 век
17 век ПЕРЕГОВОРЫ
ПЕРЕГОВОРЫ Изготовление вечернего платья
Изготовление вечернего платья Теорiя iгор
Теорiя iгор  Презентация на тему Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс
Презентация на тему Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс аня хочет санчо панчо
аня хочет санчо панчо Создание таблиц в Microsoft Word
Создание таблиц в Microsoft Word Teenagers’ society problems
Teenagers’ society problems Воля познавать
Воля познавать Любимое блюдо моей семьи
Любимое блюдо моей семьи Ладья. Урок №8
Ладья. Урок №8 Описательные характеристики распределения тестовых результатов
Описательные характеристики распределения тестовых результатов Презентация на тему Одиночество
Презентация на тему Одиночество Ich gehe mit meine Laterne
Ich gehe mit meine Laterne