Содержание
- 2. До галогенів належать Флуор F, Хлор СІ, Бром Вr, Йод І і Астат At. Це ще
- 3. Галогени — найактивніші неметали Ці елементи утворюють прості речовини, які також називаються галогенами. Реагують майже з
- 4. Загальні властивості галогенів: Мають різкий запах Взаємодіють з Н2 Добре розчинні у Н2О ( крім Фтору)
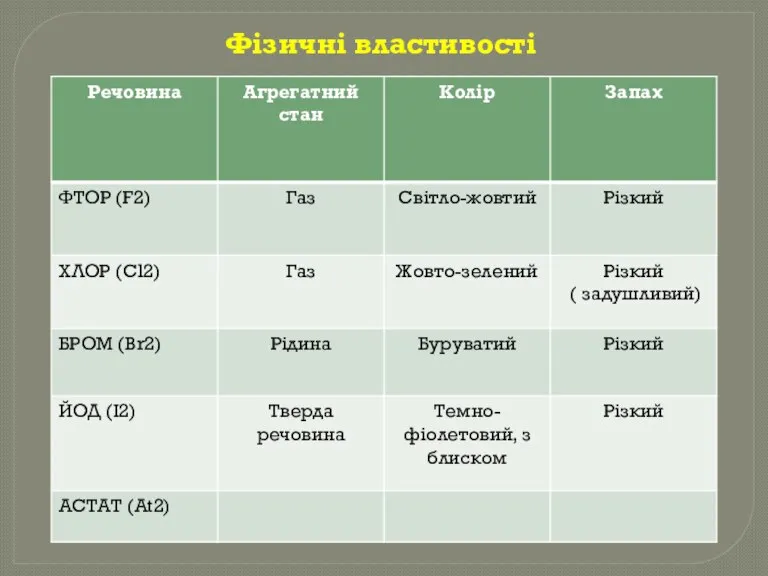
- 5. Фізичні властивості
- 6. Історія відкриття Історія відкриття Флору У 1886 році французький хімік А. Муассан, використовуючи електроліз рідкого фтороводню,
- 7. Історія відкриття Хлору У 1774 році шведський вчений К. Шееле відкрив хлор, який прийняв за складну
- 8. Історія відкриття Йоду У 1811 році французький хімік Бернар Куртуа відкрив йод шляхом перегонки маткових розчинів
- 9. Історія відкриття Астату У 1869 р Д.І.Менделєєв передбачив його існування і можливість відкриття в майбутньому (як
- 10. Будова простої речовини Молекули усіх галогенів складаються з двох атомів F2 Cl2 Br2 J2. Зв'язок в
- 11. Схожість і відмінність у будові атома Фтор-F… +9 )2 )7 Хлор-Cl… +17)2 )8)7 Бром-Br… +35)2 )8)8
- 12. F2 -найбільш реакційноздатний , реакції йдуть на холоді, при нагріванні – навіть з участю Au, Pt.
- 13. Cl2 - сильно реакційноздатний З простими речовинами: З металами З неметалами 2Fe + 3Cl2 → 2FeCl3
- 14. Br2 - реакційноздатний З простими речовинами: З металами З неметалами 2Al + 3Br2 → 2AlBr3 H2
- 15. I2 - хімічно найменш активний З простими речовинами: З металами З неметалами Hg + I2 →
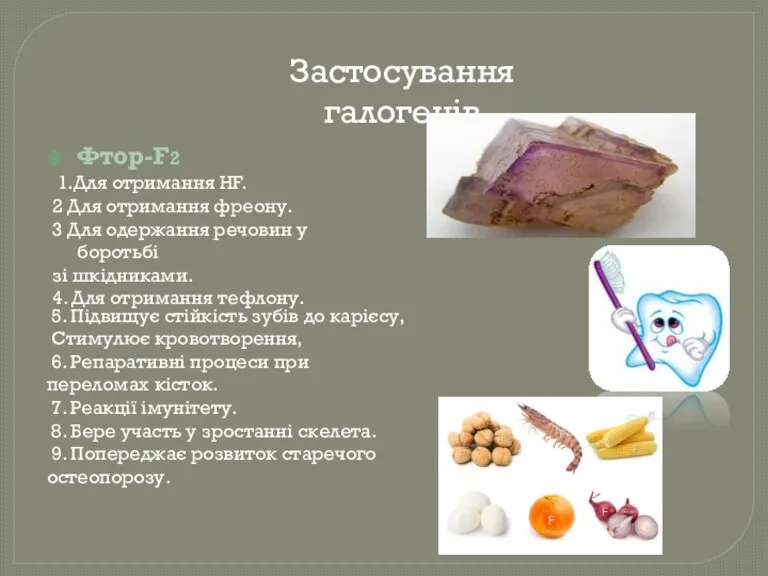
- 16. Застосування галогенів Фтор-F2 1.Для отримання HF. 2 Для отримання фреону. 3 Для одержання речовин у боротьбі
- 17. Хлор-Cl2 1 Для отримання медикаментів, пластмас, барвників. 2.Для відбілювання тканин і паперу 3. Для знезараження питної
- 18. Бром-Br2 1.Для отримання різних ліків, використаних при лікуванні нервових захворювань. 2.Для виготовлення фотопаперу. 3. NaBr і
- 20. Скачать презентацию















 Курсовая работа. Создание декоративного натюрморта с передачей фактур в графике
Курсовая работа. Создание декоративного натюрморта с передачей фактур в графике England
England Формы работы, помогающие понять текст по стихотворению А.Блока «Летний вечер»
Формы работы, помогающие понять текст по стихотворению А.Блока «Летний вечер» Культура и традиции мордовского народа
Культура и традиции мордовского народа Почему нельзя не проветривать кабинет?
Почему нельзя не проветривать кабинет? Новый взгляд на экономическую географию
Новый взгляд на экономическую географию Презентация на тему Внутреннее строение млекопитающих
Презентация на тему Внутреннее строение млекопитающих Оживший Бог войны Арес - неукротимый бог войны
Оживший Бог войны Арес - неукротимый бог войны Гендерная статистика ЕГЭ по техническим предметам
Гендерная статистика ЕГЭ по техническим предметам Законы сохранения в механике
Законы сохранения в механике РДУ-99. Его значение и применение
РДУ-99. Его значение и применение India - English Transit
India - English Transit Презентация на тему Драгоценные камни
Презентация на тему Драгоценные камни  4. карта позиционирования, конкуренты_Шашина_3ГИВ13
4. карта позиционирования, конкуренты_Шашина_3ГИВ13 Cтратегия пенсионного обеспечения граждан в условиях ухудшающейся демографии: неизбежность или вызов
Cтратегия пенсионного обеспечения граждан в условиях ухудшающейся демографии: неизбежность или вызов Профессиональная ориентация в контексте постсовременности Опыт реализации компьютерно-опосредованных средств профессиональн
Профессиональная ориентация в контексте постсовременности Опыт реализации компьютерно-опосредованных средств профессиональн Конкурс среди молодых семей «Семь Я»
Конкурс среди молодых семей «Семь Я» Ваше название
Ваше название Изготовление аксессуара Цветок
Изготовление аксессуара Цветок Intelligent efficiency. Готовый набор инструментов для анализа и принятия решений
Intelligent efficiency. Готовый набор инструментов для анализа и принятия решений Президентские состязания 2011-2012 учебный год МБОУ «Кваркенская СОШ»
Президентские состязания 2011-2012 учебный год МБОУ «Кваркенская СОШ» Информация о регулируемой деятельности ООО Томскводоканал в сфере водоснабжения и водоотведения
Информация о регулируемой деятельности ООО Томскводоканал в сфере водоснабжения и водоотведения Специальность «Режиссер шоу-программ и театрализованных представлений»
Специальность «Режиссер шоу-программ и театрализованных представлений» Врачебный диагноз
Врачебный диагноз Привлечение средств от приносящей доход деятельности
Привлечение средств от приносящей доход деятельности Кукольный театр
Кукольный театр Большой, красивый, уютный.
Большой, красивый, уютный. Париж
Париж