Содержание
- 2. знать и уметь называть соли азотной кислоты, определять какие свойства окислительные или и восстановительные характерны для
- 3. Игра «КРЕСТИКИ- НОЛИКИ Раствор азотной кислоты реагирует с каждым из веществ.
- 4. К каким классам неорганических веществ принадлежат эти вещества? 1.Назовите соли - продукты этих реакций 2. Составьте
- 5. Закончите уравнения реакций и объясните, какие классы соединений при взаимодействии могут давать нитраты. ВаО + НNO3→
- 6. Даны пары веществ, составьте возможные уравнения реакций а) гидроксид натрия и азотная кислота, б) гидроксид калия
- 7. Перечислите соли полученные в результате возможных реакций. Нитраты калия, натрия, кальция и аммония называют селитрами KNO3
- 8. Нитраты – твердые кристаллические вещества, тугоплавки, определите по таблице растворимости, к каким электролитам они относятся -
- 9. Физические свойства нитратов Какие вещества называют солями? Нужно построить логическую цепочку: вид химической связи – тип
- 10. Химические свойства нитратов Взаимодействие нитратов с металлами, кислотами, щелочами, солями Cu(NO3)2 + Zn … , AgNO3
- 11. Занимательная история Любознательный химик изучил типы химических реакций и заметил, что нерастворимые карбонаты (CaCO3) , сульфиты
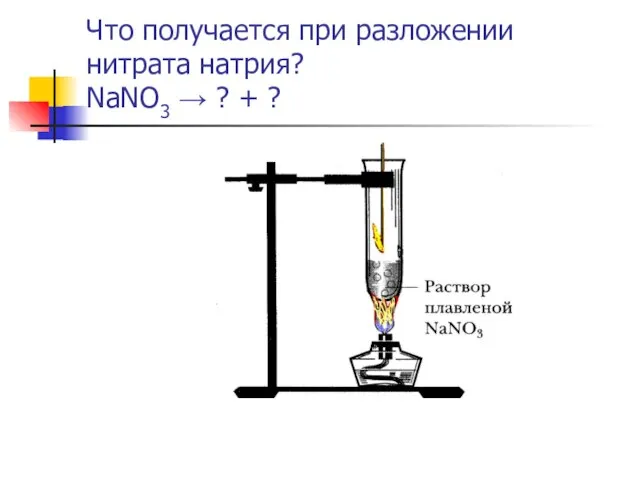
- 12. Что получается при разложении нитрата натрия? NaNO3 → ? + ?
- 13. После первого опыта юный химик решил проверить, как будут разлагаться другие соли, например, нитрат меди(II) ,
- 14. Cu(NO3)2 → А + В +? Cu(NO3)2 → … + ...+ …
- 15. Разложение нитрата меди (II)
- 17. Скачать презентацию













 Ху Цзисян
Ху Цзисян Гласные и согласные звуки и буквы
Гласные и согласные звуки и буквы Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Електронна реєстрація фізичних осіб в якості підприємців
Електронна реєстрація фізичних осіб в якості підприємців 8
8 Презентация на тему Площадь параллелограмма, треугольника, трапеции
Презентация на тему Площадь параллелограмма, треугольника, трапеции Образ жизни народов мира. Королевство Испания
Образ жизни народов мира. Королевство Испания Легкая атлетика
Легкая атлетика Социальная значимость библиотеки и критерии оценки качества её деятельности
Социальная значимость библиотеки и критерии оценки качества её деятельности Перестрахование ипотечных обязательств по стандартам СК АИЖК
Перестрахование ипотечных обязательств по стандартам СК АИЖК математика
математика Файловая система
Файловая система Монетарная политика
Монетарная политика Слайд-шоу ГТО. Регистрация на сайте
Слайд-шоу ГТО. Регистрация на сайте Windows Movie Maker
Windows Movie Maker Итоги третьей четверти
Итоги третьей четверти Буква Ж
Буква Ж Опыт Австралии по освоению месторождений полезных ископаемых на территориях с трудными природными условиями
Опыт Австралии по освоению месторождений полезных ископаемых на территориях с трудными природными условиями Включение учащихся в познавательную и научно-исследовательскую деятельность – действенный путь развития устойчивой мотивации в
Включение учащихся в познавательную и научно-исследовательскую деятельность – действенный путь развития устойчивой мотивации в  Детство, опалённое войной
Детство, опалённое войной © Толоконникова С.В., учитель английского языка, школа 92.
© Толоконникова С.В., учитель английского языка, школа 92. Интеллектуальный турнир "Юные знатоки филологии"
Интеллектуальный турнир "Юные знатоки филологии" Что такое симметрия? Как получить симметричные детали?
Что такое симметрия? Как получить симметричные детали? Привалова Татьяна Николаевна
Привалова Татьяна Николаевна Презентация на тему:«Наш класс – самый спортивный класс!»
Презентация на тему:«Наш класс – самый спортивный класс!» Жизненный путь новомученицы Татианы Гримблит (1903-1937)
Жизненный путь новомученицы Татианы Гримблит (1903-1937) Гуманистические воспитательные системы: опыт построения и развития
Гуманистические воспитательные системы: опыт построения и развития Личностно-ориентированное обучение в начальной школе
Личностно-ориентированное обучение в начальной школе