Слайд 2Положение в ПС Менделеева
Сурьма́ (лат. Stibium; обозначается символом Sb)
Химический элемент 15-й группы, главной подгруппы пятого периода
Имеет

порядковый номер 51
Атомная масса 121,75
Слайд 3История
В странах Востока она употреблялась примерно за 3000 лет до н. э. для изготовления

сосудов.
В Древнем Египте уже в 19 в. до н. э. порошок сурьмяного блеска (природный Sb2S3) применялся для чернения бровей.
Слайд 4Нахождение в природе
Месторождения сурьмы известны в ЮАР, Алжире, Армении, Таджикистане, Болгарии, Якутии, Финляндии,

Китае, Киргизии, Читинской области
Слайд 5Физические свойства
полуметалл серебристо-белого цвета с синеватым оттенком
грубозернистое строение
плотность 6,68 г/см³
Температура плавления=6305°С
Температура кипения - 1634°C
при застывании расширяется

Слайд 6Сурьма известна в кристаллической и трех аморфных формах: взрывчатая, черная и желтая.
Взрывчатая

Сурьма (плотность 5,64-5,97 г/см3) взрывается при любом соприкосновении; образуется при электролизе раствора SbCl3.
Черная (плотность 5,3 г/см3) - при быстром охлаждении паров Сурьмы;
Желтая - при пропускании кислорода в сжиженный SbH3
Желтая и черная Сурьма неустойчивы, при пониженных температурах переходят в обыкновенную Сурьму.
Слайд 7Химические свойства
В соединениях проявляет степени окисления главным образом +5, +3 и -3
С

кислородом взаимодействует при температуре выше 630 °С с образованием Sb2О3
Гидроксид сурьмы:
SbCl3 + 3NаОН = Sb (OH)3 +3NaCl
При сплавлении с серой получаются сульфиды сурьмы, так же взаимодействует с фосфором и мышьяком.
Слайд 8Получение сурьмы
Существует два метода:
Сплавление сульфида с железом (метод вытеснения) Sb2S3 + 3Fe =

2Sb + 3FeS
Обжиг сульфида и восстановление полученной четырехокиси сурьмы углем (метод обжига - восстановления) Sb2S3 + 5O2 = Sb2O4 + 3SO2
Sb2O4 + 4C = 2Sb + 4CO.
Слайд 9Применение
Батареи
Типографские сплавы
Стрелковое оружие и трассирующие пули
Оболочки кабелей
Спички
Лекарства, противопротозойные средства









 The geography of the USA
The geography of the USA  20140604_antarktida
20140604_antarktida EVENT-АЛЬБОМ
EVENT-АЛЬБОМ Творческий проект Лопатка кухонная
Творческий проект Лопатка кухонная Коварные Е
Коварные Е Huawei P30 lite vs Samsung А50
Huawei P30 lite vs Samsung А50 Презентация на тему Во времена Древней Руси
Презентация на тему Во времена Древней Руси  Request Reply The main aims of the writing
Request Reply The main aims of the writing Роль физической культуры и спорта в нашей жизни
Роль физической культуры и спорта в нашей жизни Влияние электромагнитного излучения на здоровье человека
Влияние электромагнитного излучения на здоровье человека Первое родительское собрание
Первое родительское собрание Автосцепка
Автосцепка «Теория и методика музыкального развития с практикумом»
«Теория и методика музыкального развития с практикумом» Технология педагогического общения
Технология педагогического общения Христианская церковь в раннее средневековье
Христианская церковь в раннее средневековье Бесплатный курс АвтоПраво
Бесплатный курс АвтоПраво 2b
2b Тепловые насосы BROS
Тепловые насосы BROS Участие центров правовой информации библиотек в профилактике наркомании и пропаганде здорового образа жизни
Участие центров правовой информации библиотек в профилактике наркомании и пропаганде здорового образа жизни Кто его раздевает, тот слёзы проливает
Кто его раздевает, тот слёзы проливает Эковожатый. Социальная сфера
Эковожатый. Социальная сфера Рациональное пользование полезных ископаемых Пермского края
Рациональное пользование полезных ископаемых Пермского края 571 В вышине под небесами
571 В вышине под небесами Какие бывают финансовые риски
Какие бывают финансовые риски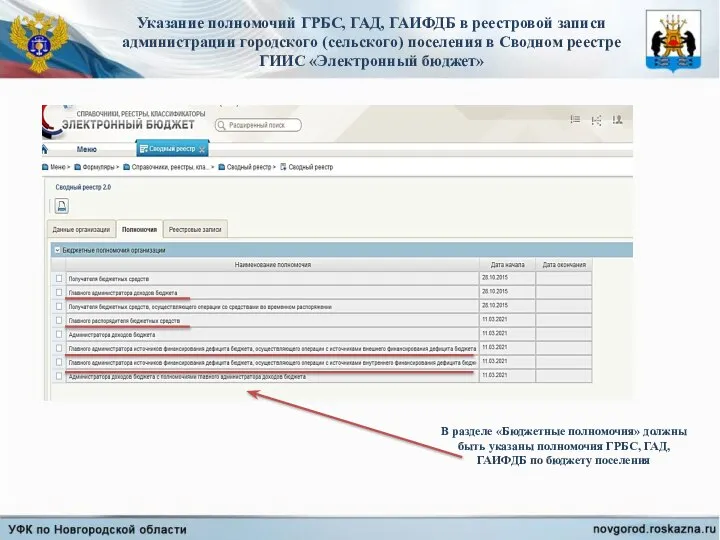 Полномочия ГРБС, ГАД, ГАИФДБ
Полномочия ГРБС, ГАД, ГАИФДБ Исполнение комплексного плана Совета ТОС «Правые Чемы» в 2011 году
Исполнение комплексного плана Совета ТОС «Правые Чемы» в 2011 году Пенопласт
Пенопласт Гуманитарная методология: прочтение, программа, профанация?
Гуманитарная методология: прочтение, программа, профанация?