Содержание
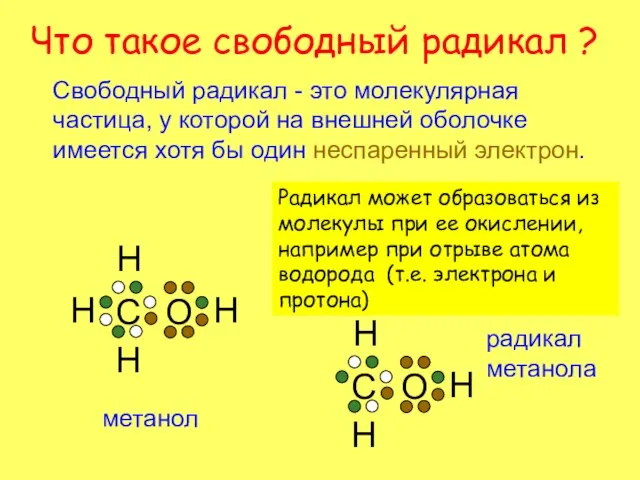
- 2. Что такое свободный радикал ? Свободный радикал - это молекулярная частица, у которой на внешней оболочке
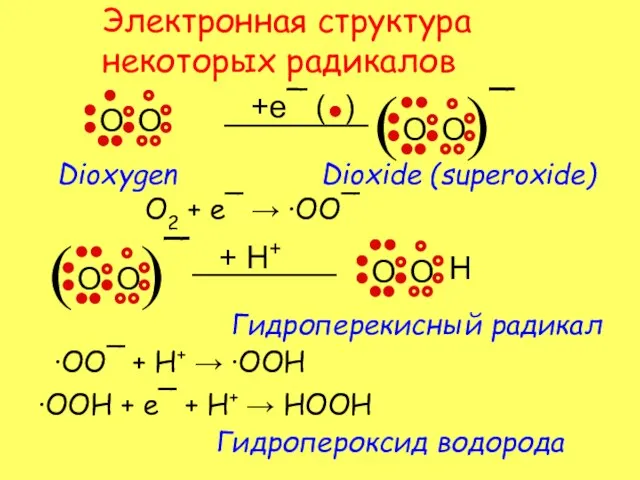
- 3. Электронная структура некоторых радикалов O2 + e¯ → ·OO¯ ·OO¯ + H+ → ·OOH
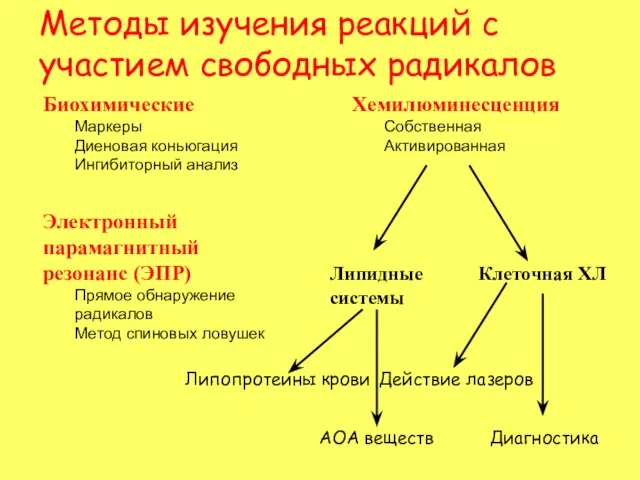
- 4. Биохимические Маркеры Диеновая коньюгация Ингибиторный анализ Электронный парамагнитный резонанс (ЭПР) Прямое обнаружение радикалов Метод спиновых ловушек
- 5. Хемилюминесценция при цепном (перекисном) окислении липидов
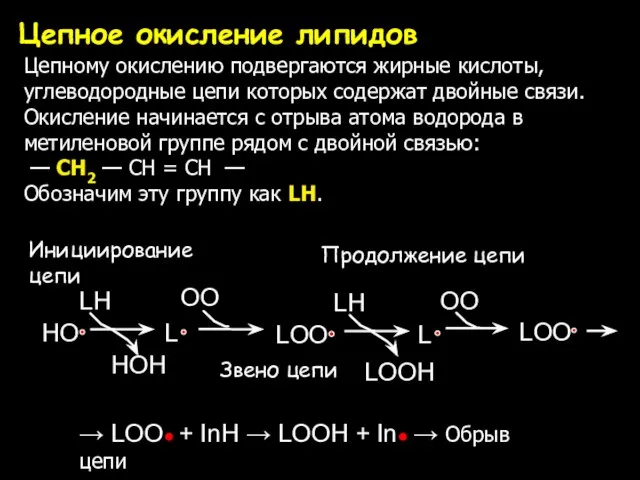
- 6. Цепное окисление липидов → LOO● + InH → LOOH + In● → Обрыв цепи Цепному окислению
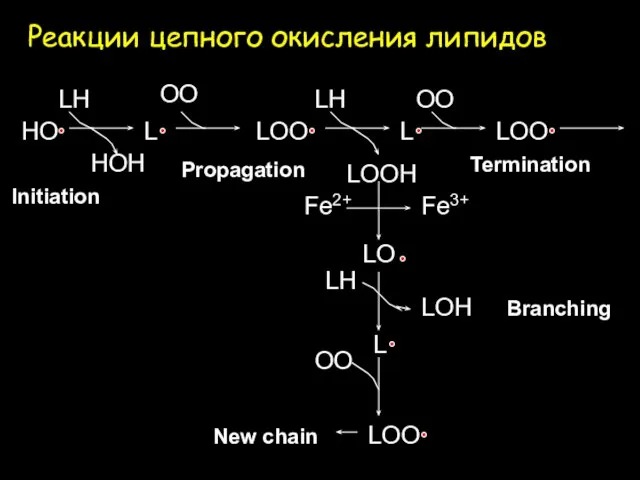
- 7. Реакции цепного окисления липидов
- 8. ХЛ и [O2] (отн. ед.) Время инкубации, мин 3 6 9 12 15 18 Коррелляция между
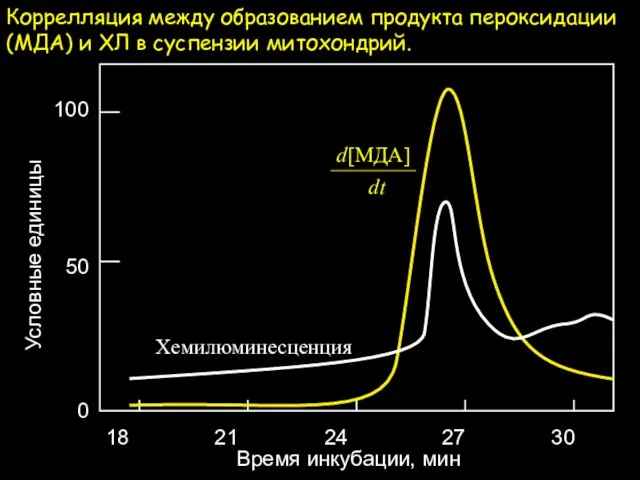
- 9. Коррелляция между образованием продукта пероксидации (МДА) и ХЛ в суспензии митохондрий. 100 50 0 18 21
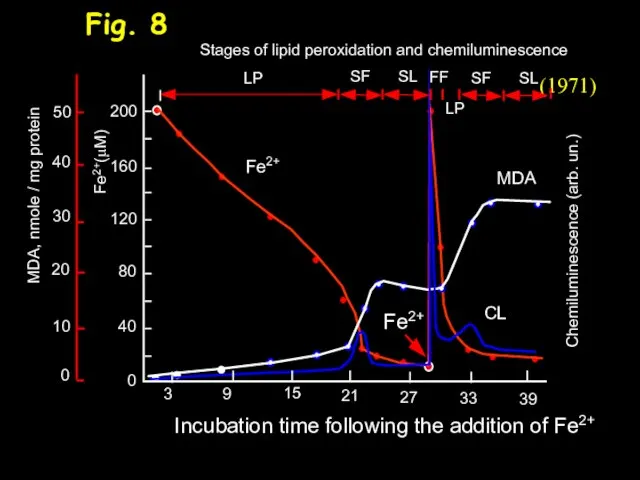
- 10. Fig. 8 (1971)
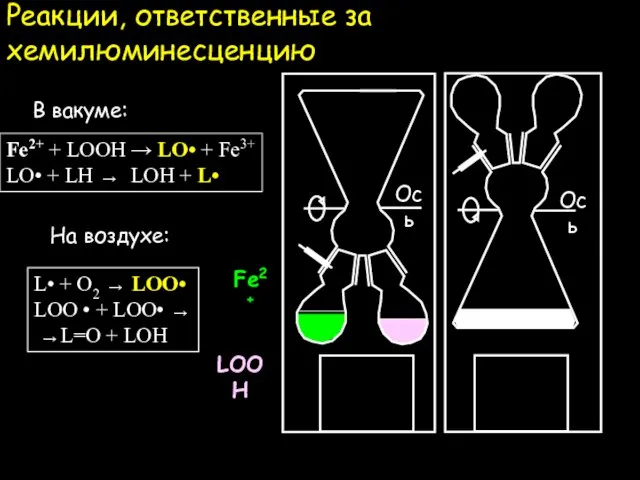
- 11. Реакции, ответственные за хемилюминесценцию
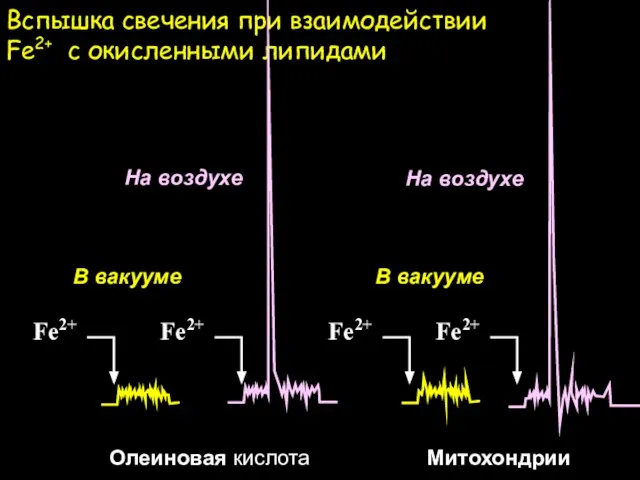
- 12. Вспышка свечения при взаимодействии Fe2+ с окисленными липидами
- 13. Измерение ХЛ – прямой метод определения радикалов LOO· в биохимических системах LOO· + LOO· → LOH
- 14. Хемилюминесценция при образовании активных форм кислорода
- 15. Основоположники Robert Allan. Открыл ХЛ нейтрофилов в 1971 году. A.U. Khan. Открыл ХЛ при реакции гипохлорита
- 16. Супероксидный радикал Встретив чужеродную частицу, например, бактерию, фагоцит прикрепляется к ней и начинает выделять активные формы
- 17. Метаболизм супероксидного радикала 2 ·OO¯ → H2O2 + 3O2 (Супероксиддисмутаза) 2 ·OO¯ → H2O2 + 1O2
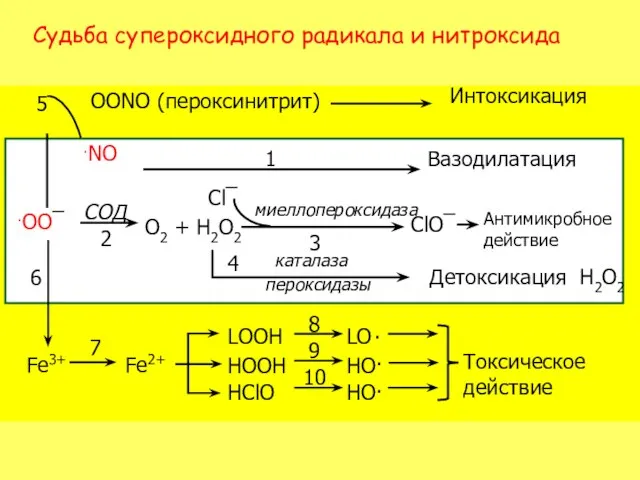
- 18. Судьба супероксидного радикала и нитроксида
- 19. Хемилюминесценция через стадию образования эксимеров кислорода
- 20. Активированная ХЛ 1. Химические активаторы (Sensitizers)
- 21. Два типа активаторов ХЛ – CL enhancers
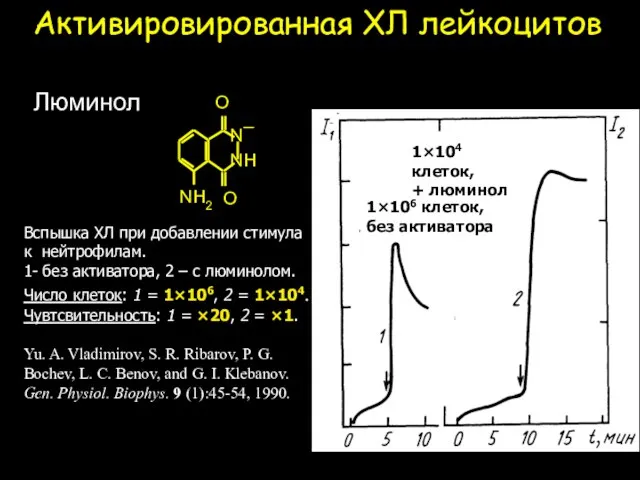
- 22. Активировированная ХЛ лейкоцитов Вспышка ХЛ при добавлении стимула к нейтрофилам. 1- без активатора, 2 – с
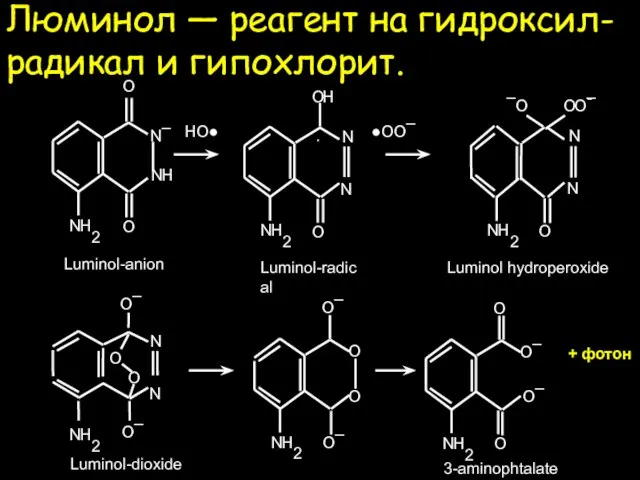
- 23. Люминол — реагент на гидроксил-радикал и гипохлорит. ●OO¯ HO● Luminol-radical + фотон
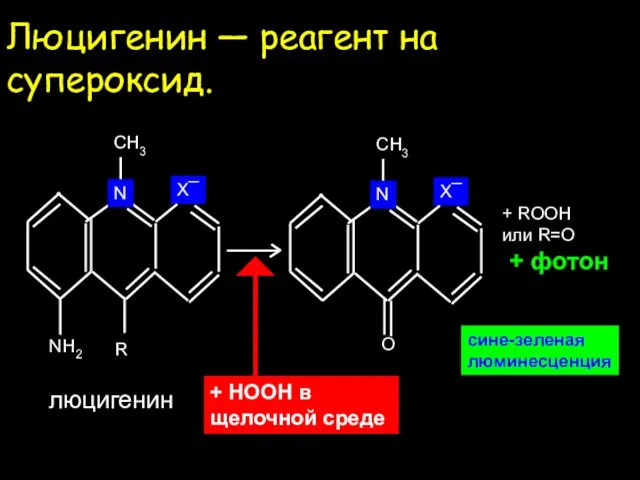
- 24. Люцигенин — реагент на супероксид. сине-зеленая люминесценция + ROOH или R=O + фотон N X¯ R
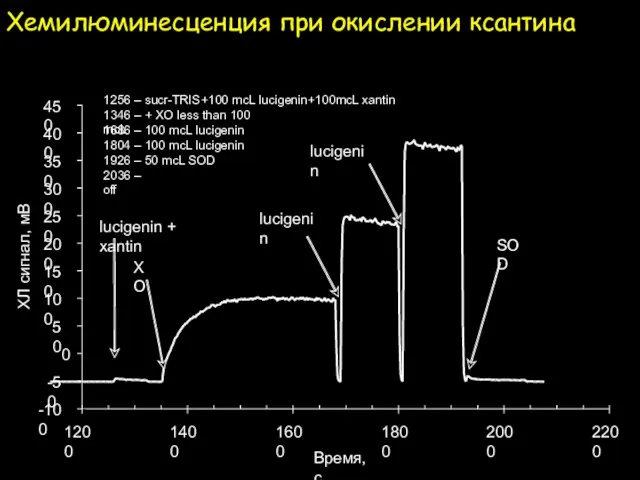
- 25. Хемилюминесценция при окислении ксантина -100 -50 0 50 100 150 200 250 300 350 400 450
- 26. Хемилюминесценция митохондрий
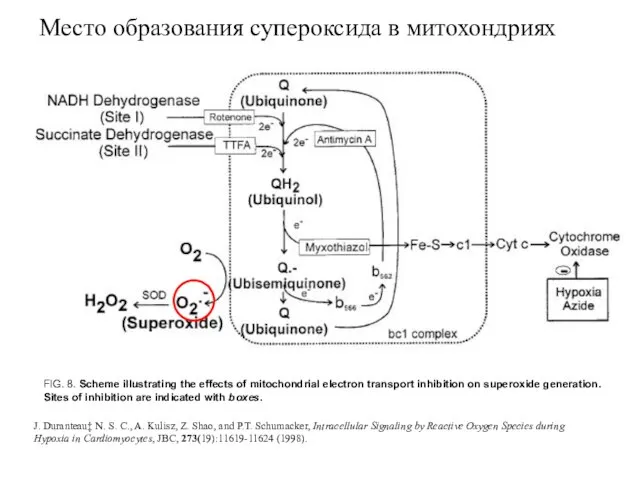
- 27. Место образования супероксида в митохондриях FIG. 8. Scheme illustrating the effects of mitochondrial electron transport inhibition
- 28. Активированная ХЛ 2. Физические активаторы (Sensitizers)
- 29. Активированная ХЛ. Физические активаторы. Квантовый выход ХЛ (ηХЛ): Многие химические реакции сопровождаются очень слабым свечением. Почему
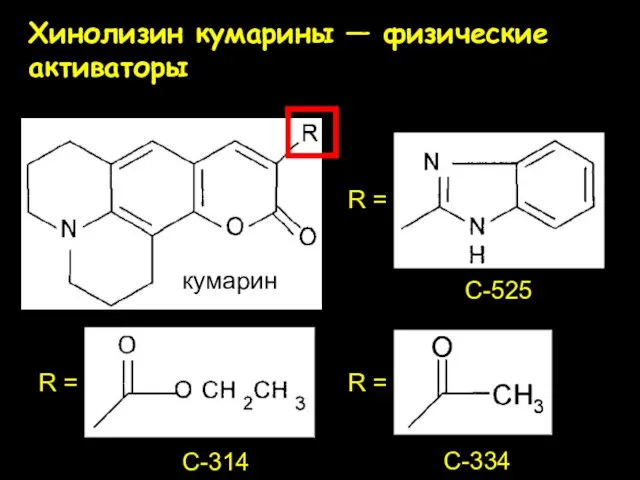
- 30. Хинолизин кумарины — физические активаторы
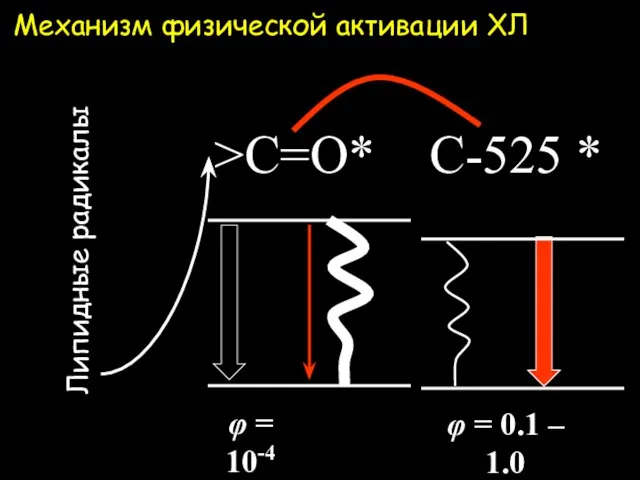
- 31. Механизм физической активации ХЛ >C=O* Липидные радикалы φ = 0.1 – 1.0
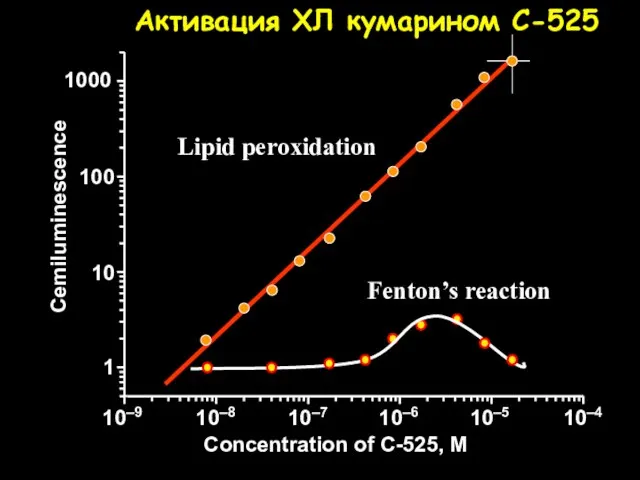
- 32. Lipid peroxidation Fenton’s reaction Concentration of C-525, M Cemiluminescence Активация ХЛ кумарином C-525 10–9 10–8 10–7
- 34. Скачать презентацию

![ХЛ и [O2] (отн. ед.) Время инкубации, мин 3 6 9 12](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/467081/slide-7.jpg)











 Прибавить и вычесть число 2
Прибавить и вычесть число 2 Обособление несогласованных определений
Обособление несогласованных определений Информационно – познавательная программа Счастье там, где верность и любовь
Информационно – познавательная программа Счастье там, где верность и любовь Самый классный классный 2011
Самый классный классный 2011 Система ФОССТИС в индустрии
Система ФОССТИС в индустрии Україна на Іграх нескорених
Україна на Іграх нескорених Кредитно-денежная система
Кредитно-денежная система Депрессии.Эволюция антидепрессантов.
Депрессии.Эволюция антидепрессантов. Отчёт о работе МО учителей математики, физики и ИКТ за 2010 - 2011 учебный год
Отчёт о работе МО учителей математики, физики и ИКТ за 2010 - 2011 учебный год Заглянем в кладовые Земли
Заглянем в кладовые Земли Современный выпускник глазами учителей, родителей, учащихся. Модель выпускника
Современный выпускник глазами учителей, родителей, учащихся. Модель выпускника Распаковка подарков. Поддержка новогоднего ассортимента
Распаковка подарков. Поддержка новогоднего ассортимента Семейный бюджет. Доходная и расходная части бюджета.
Семейный бюджет. Доходная и расходная части бюджета. Шаблон конкурсной работы
Шаблон конкурсной работы Группа компаний ИНТАЛЕВ
Группа компаний ИНТАЛЕВ Приоритетные направления развития по формированию и поддержанию компетенций экспертов по аккредитации
Приоритетные направления развития по формированию и поддержанию компетенций экспертов по аккредитации К вопросу о формировании информационной культуры старшеклассников
К вопросу о формировании информационной культуры старшеклассников Конституция РФ
Конституция РФ LabZZ! — это серия домашних лабораторий для проведения интересных опытов в домашних условиях и познавательных игр, завоевавших любо
LabZZ! — это серия домашних лабораторий для проведения интересных опытов в домашних условиях и познавательных игр, завоевавших любо Рекомендации по проведению ГИА-9 по информатике и ИКТ
Рекомендации по проведению ГИА-9 по информатике и ИКТ SWOT-анализ
SWOT-анализ Аликина О.В. Развитие сферы детского отдыха
Аликина О.В. Развитие сферы детского отдыха Черты петербургской культуры. Жизнь в Петербурге
Черты петербургской культуры. Жизнь в Петербурге Тенденции развития современных антенн для аппаратуры потребителя СНС
Тенденции развития современных антенн для аппаратуры потребителя СНС Подбор персонала Пятёрочка. Линейная воронка, основные статусы
Подбор персонала Пятёрочка. Линейная воронка, основные статусы Микены и Троя
Микены и Троя Как утверждались абсолютные монархии
Как утверждались абсолютные монархии Учебно-познавательные задачи
Учебно-познавательные задачи