Содержание
- 2. Общая характеристика элементов IV группы Углерод: Строение и аллотропия Химические свойства Круговорот в природе Оксиды углерода:
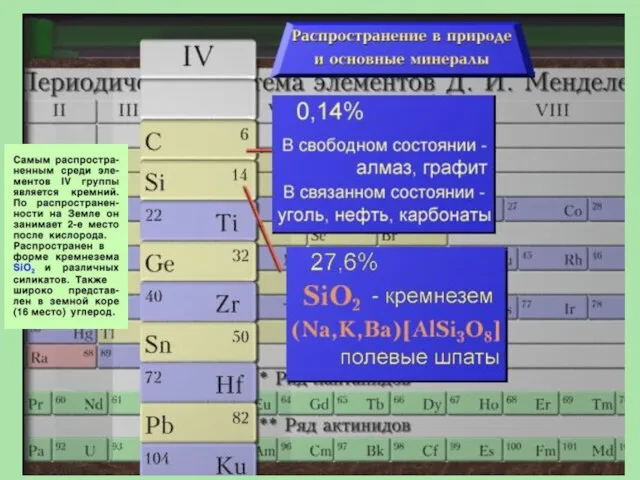
- 3. Общая характеристика элементов IV группы
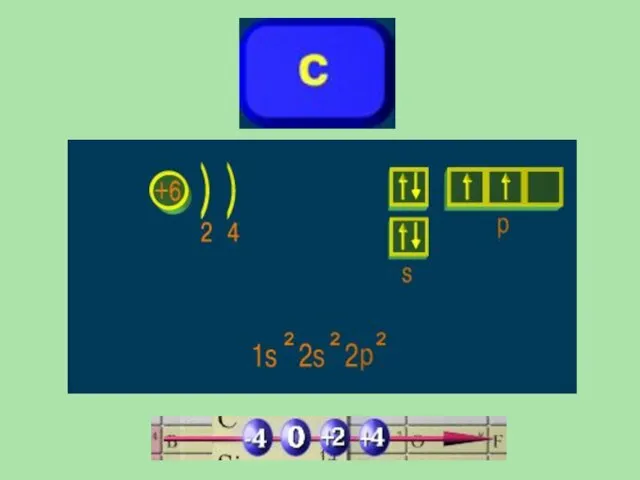
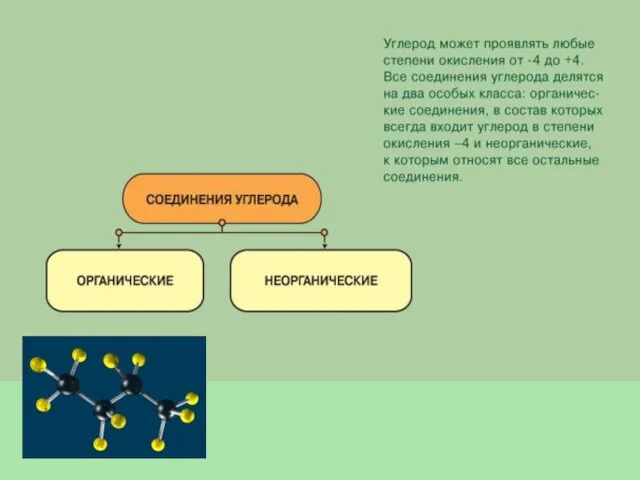
- 11. Углерод
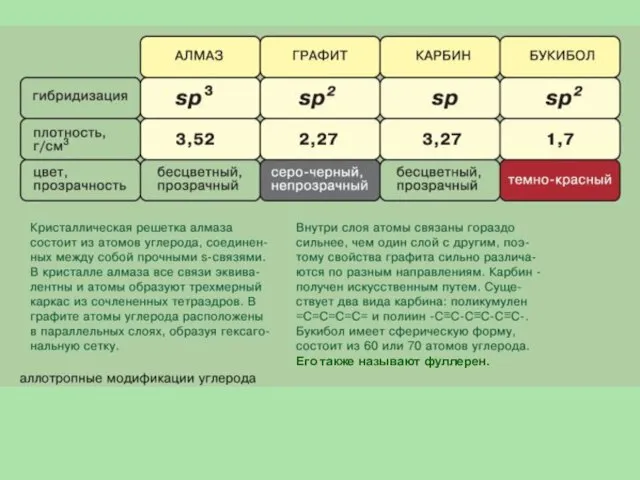
- 14. Его также называют фуллерен.
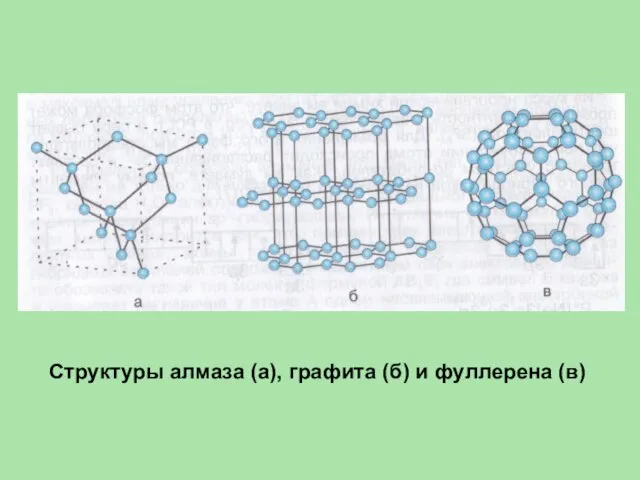
- 15. Структуры алмаза (а), графита (б) и фуллерена (в)
- 16. Кристаллические решётки алмаза (а) и графита (б) а
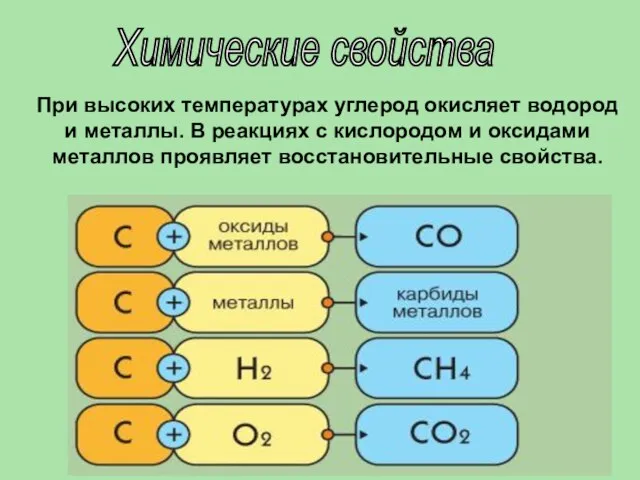
- 17. Химические свойства При высоких температурах углерод окисляет водород и металлы. В реакциях с кислородом и оксидами
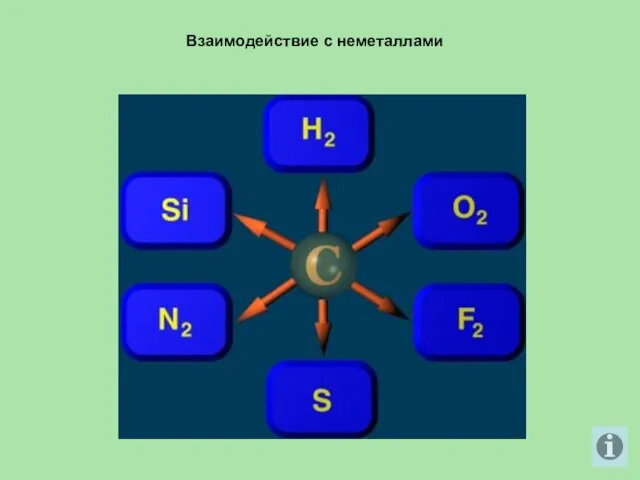
- 19. Взаимодействие с неметаллами
- 20. При нагревании углерод соединяется с кислородом, образуя оксид углерода (IV), или углекислый газ: С + O2
- 22. Углерод – сильный восстановитель. При нагревании с водяным паром он вытесняет из воды водород: Н2O +
- 23. При взаимодействии с металлами углерод образует карбиды
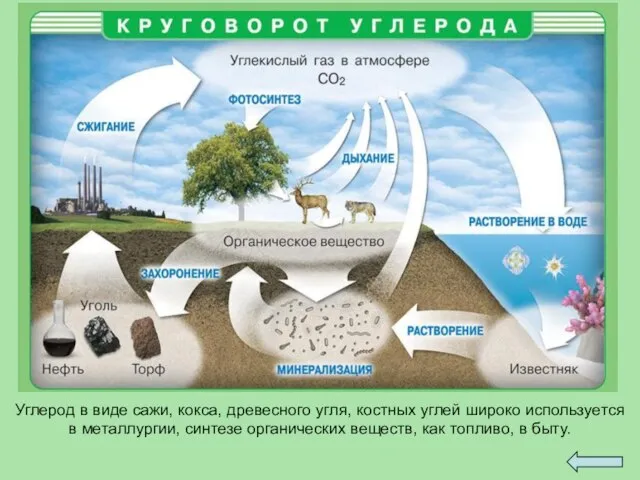
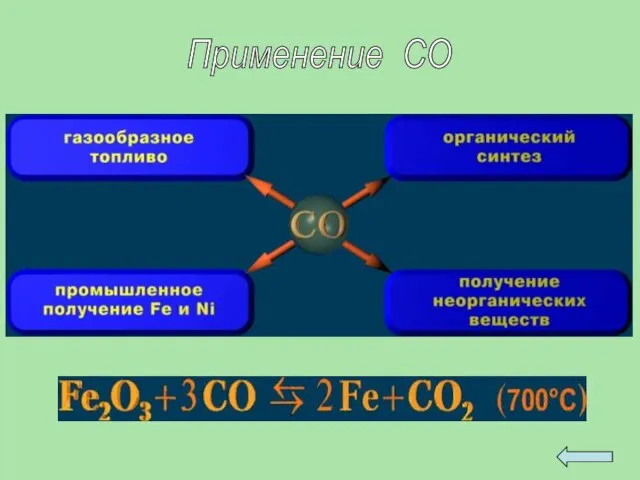
- 24. Углерод в виде сажи, кокса, древесного угля, костных углей широко используется в металлургии, синтезе органических веществ,
- 25. Оксиды углерода
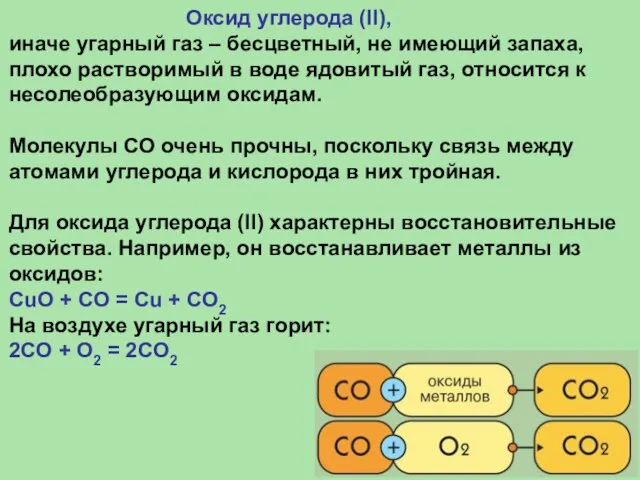
- 26. Оксид углерода (II), иначе угарный газ – бесцветный, не имеющий запаха, плохо растворимый в воде ядовитый
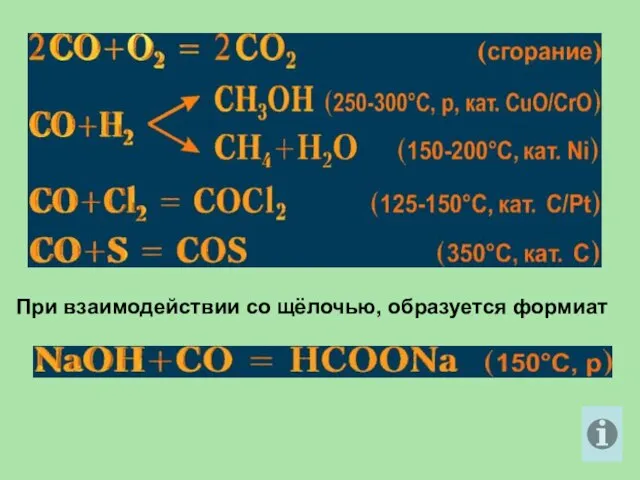
- 27. При взаимодействии со щёлочью, образуется формиат
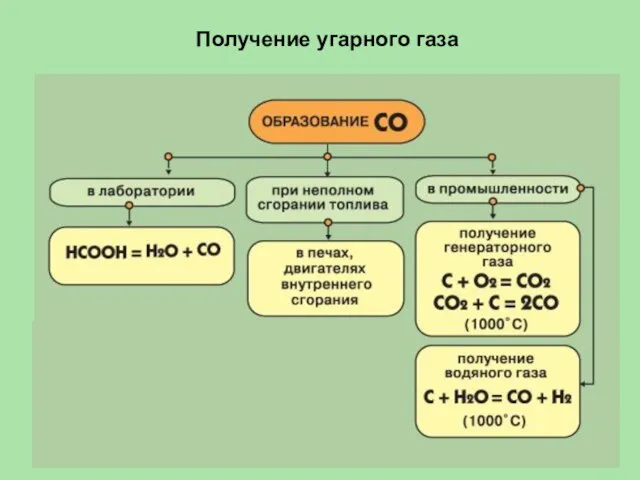
- 28. Получение угарного газа
- 29. Применение СО
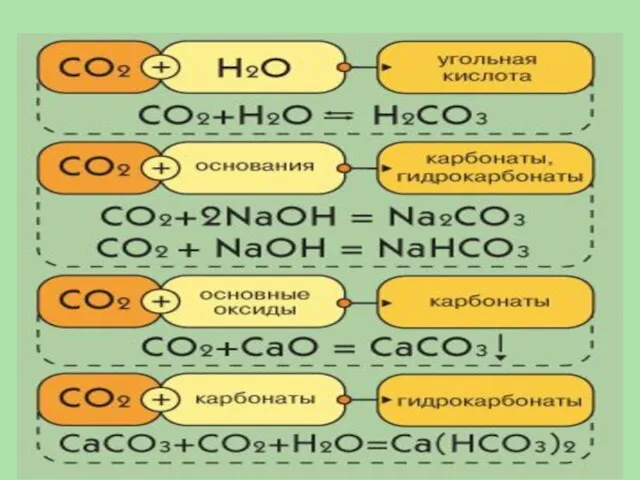
- 30. Оксид углерода (IV), или углекислый газ, – газ без цвета и запаха. Это кислотный оксид, ему
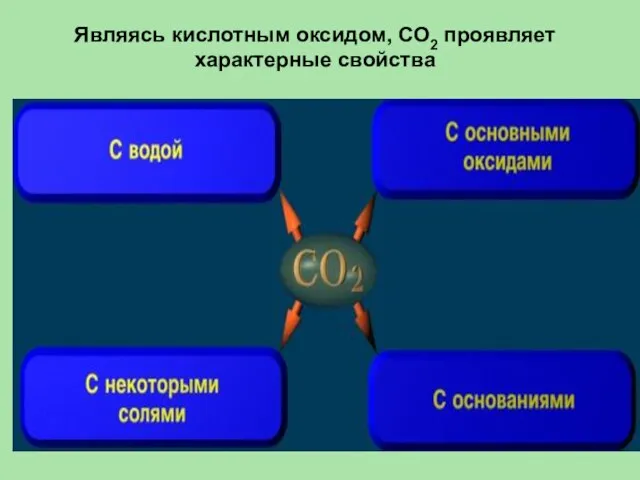
- 31. Являясь кислотным оксидом, СО2 проявляет характерные свойства
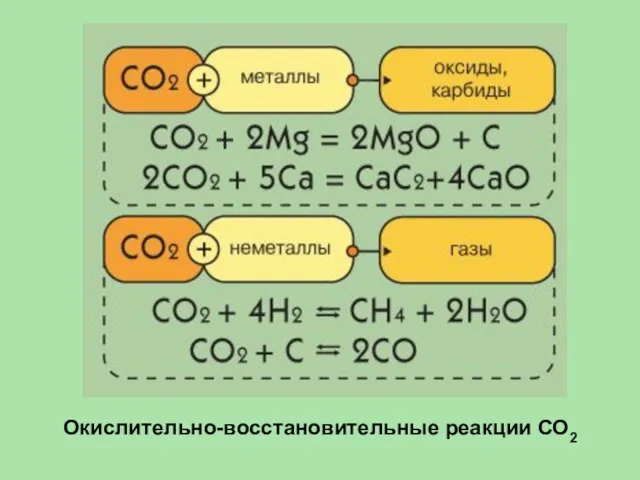
- 34. Окислительно-восстановительные реакции СО2
- 35. В лаборатории оксид углерода (IV) получают взаимодействием карбоната кальция (мел, мрамор) с соляной кислотой в аппаратах
- 37. Реакция СО2 с известковой водой (помутнение раствора из-за образования осадка СаСО3) является качественной реакцией.
- 38. Применение СО2
- 39. Фотосинтез
- 42. Угольная кислота и её соли
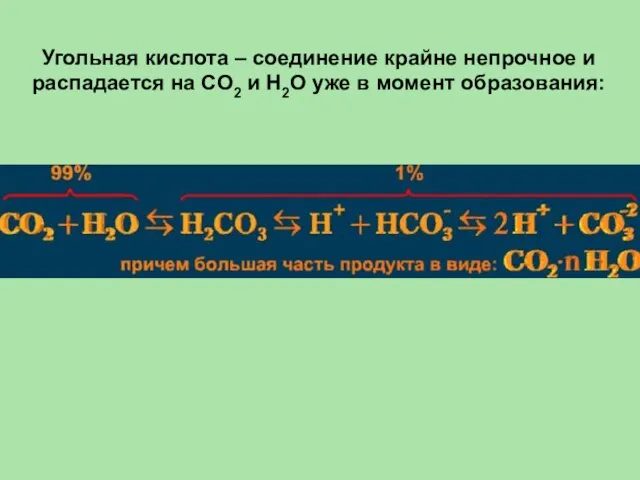
- 43. Угольная кислота – соединение крайне непрочное и распадается на CO2 и H2O уже в момент образования:
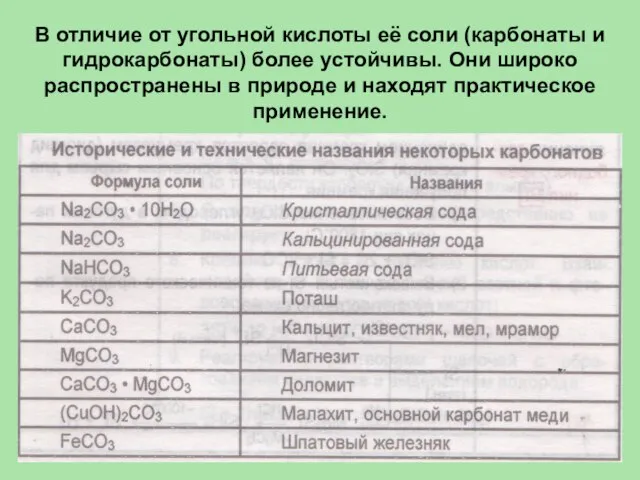
- 45. В отличие от угольной кислоты её соли (карбонаты и гидрокарбонаты) более устойчивы. Они широко распространены в
- 46. В водных растворах карбонаты и гидрокарбонаты подвергаются гидролизу по аниону:
- 49. Скачать презентацию




























 Характеристика стран восточной Европы
Характеристика стран восточной Европы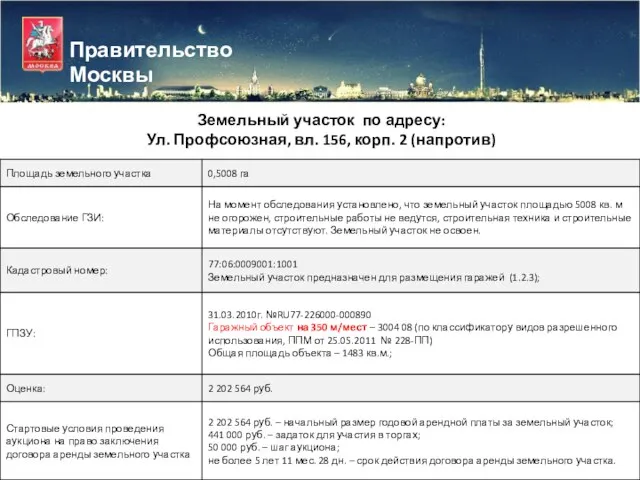 Правительство Москвы
Правительство Москвы Психолого – педагогическая служба в образовательном процессе
Психолого – педагогическая служба в образовательном процессе Стандарты кредитной надежности
Стандарты кредитной надежности Методика оценки командной эффективности. Социальные драйверы командной эффективности
Методика оценки командной эффективности. Социальные драйверы командной эффективности T-fest
T-fest Студенты-гуманитарии и вытеснение “систематического” мышления “поисковым”:к постановке проблемы
Студенты-гуманитарии и вытеснение “систематического” мышления “поисковым”:к постановке проблемы Презентация на тему Страны Африки. Ливия
Презентация на тему Страны Африки. Ливия  Проведение недель профессионального мастерства как форма коллективной методической работы
Проведение недель профессионального мастерства как форма коллективной методической работы  OpenOffice.org Writer
OpenOffice.org Writer GK120产品保养调整介绍
GK120产品保养调整介绍 Таргетированная реклама
Таргетированная реклама Musical Crossword
Musical Crossword Работа с контурной картой возраст гор
Работа с контурной картой возраст гор Учимся рисовать гуашью букет подсолнухов
Учимся рисовать гуашью букет подсолнухов ВИДЫ ТЕПЛОПЕРЕДАЧИ
ВИДЫ ТЕПЛОПЕРЕДАЧИ 23 февраля День защитника Отечества
23 февраля День защитника Отечества Растения Красной книги
Растения Красной книги Интегрированный урок в начальной школе
Интегрированный урок в начальной школе Курск Малая родина моя
Курск Малая родина моя Organic therapy
Organic therapy Приходи в Диснейленд
Приходи в Диснейленд אנחנו רוצים מחברות חדשות
אנחנו רוצים מחברות חדשות Христианская семья
Христианская семья Изготовление ящика для инструментов
Изготовление ящика для инструментов Воспитательный потенциал семьи
Воспитательный потенциал семьи Приходи на ФПММ — у нас интересно!
Приходи на ФПММ — у нас интересно! Биография Ф. И. Тютчева
Биография Ф. И. Тютчева