Содержание
- 2. Цели урока. Обобщить представление о химической реакции как о процессе превращения одного или нескольких исходных веществ-реактивов
- 3. Химические реакции, или химические явления, -это процессы, в результате которых из одних веществ образуются другие, отличающиеся
- 4. Химические реакции происходят: при смешении или физическом контакте реагентов самопроизвольно при нагревании при участии катализаторов при
- 5. Все реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном,
- 6. Лабораторная работа Признаки химических реакций: появление запаха выпадение осадка растворение осадка выделение газа изменение цвета выделение
- 7. по числу и составу ре- 1. соединения агентов и продуктов 2. разложения 3. замещения 4. обмена
- 8. Реакции соединения – это такие реакции, при которых из двух и более веществ образуется одно сложное
- 9. Реакции разложения –это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
- 10. Реакции замещения -это такие реакции, в результате которых атомы простого вещества замещают атомы одного из элементов
- 11. Реакции обмена –это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
- 12. Какие условия должны выполняться, чтобы произошла химическая реакция? 1. Необходимо, чтобы реагирующие вещества соприкоснулись и чем
- 13. Реакции, протекающие с выделением теплоты и света называются - РЕАКЦИЯМИ ГОРЕНИЯ Реакции, протекающие с выделением теплоты,
- 14. Спасибо за урок!
- 16. Скачать презентацию













 Гимназия №42Приморский районСанкт-Петербург
Гимназия №42Приморский районСанкт-Петербург Сграффито
Сграффито ПРОЕКТ "ГРАЖДАНИН"ТЕХНОЛОГИЧЕСКИЕ СТАДИИ
ПРОЕКТ "ГРАЖДАНИН"ТЕХНОЛОГИЧЕСКИЕ СТАДИИ Проектная деятельность НОО
Проектная деятельность НОО Татьяна Нешумова. Стишки и картинки 2018 года
Татьяна Нешумова. Стишки и картинки 2018 года Информационно-образовательная система«Электронный журнал кафедры»
Информационно-образовательная система«Электронный журнал кафедры» Причина вчерашней конфронтации. Девиантное поведение
Причина вчерашней конфронтации. Девиантное поведение Календарные эффекты
Календарные эффекты Презентация на тему: Работа классного руководителя с родителями
Презентация на тему: Работа классного руководителя с родителями Институты гражданского права
Институты гражданского права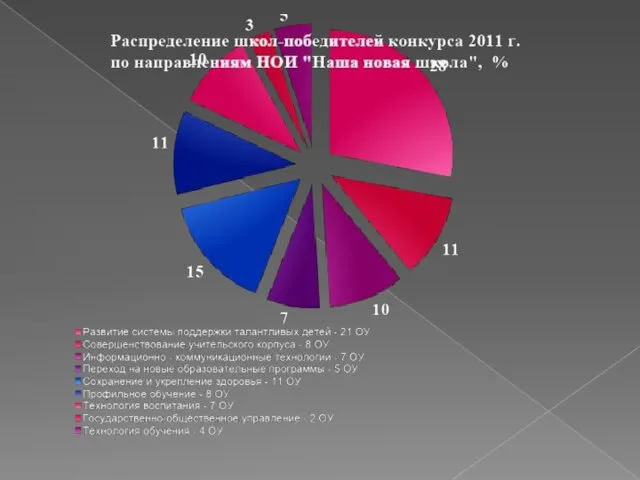 ПОБЕДИТЕЛИ 06-08 + 2011 г.321 + 73 = 394 УЧАСТНИКИ 06-08 + 2011 г.224+74 = 298 ВСЕГО692.
ПОБЕДИТЕЛИ 06-08 + 2011 г.321 + 73 = 394 УЧАСТНИКИ 06-08 + 2011 г.224+74 = 298 ВСЕГО692. Лица без определенного места жительства
Лица без определенного места жительства SYM MAXSYM TL 500
SYM MAXSYM TL 500 колесокисельник дуб – суп луг – лук луг – лук пруд – прут пруд – прут гараж – шалаш гараж – шалаш воз – рос воз – рос.
колесокисельник дуб – суп луг – лук луг – лук пруд – прут пруд – прут гараж – шалаш гараж – шалаш воз – рос воз – рос. Проект по технологии Деревянный табурет
Проект по технологии Деревянный табурет Юзабилити игровых интерфейсов
Юзабилити игровых интерфейсов Физкультпаузы на уроках немецкого языка
Физкультпаузы на уроках немецкого языка Водные ресурсы Земли
Водные ресурсы Земли Между педагогикой и искусством: художественно-педагогический метод
Между педагогикой и искусством: художественно-педагогический метод Электронные цифровые архивы : долговременное сохранение данных и обеспечение их аутентичности. Модель сохранения данных OAIS (ISO 1472
Электронные цифровые архивы : долговременное сохранение данных и обеспечение их аутентичности. Модель сохранения данных OAIS (ISO 1472 Единая информационная система региона – механизм повышения качества государственного и муниципального управления.
Единая информационная система региона – механизм повышения качества государственного и муниципального управления. М.Ю.Лермонтов (1814-1841)
М.Ю.Лермонтов (1814-1841) Как прошла неделя начальных классов в МОУ СОШ п. Карагайского
Как прошла неделя начальных классов в МОУ СОШ п. Карагайского Презентация на тему Путешествие по Африке
Презентация на тему Путешествие по Африке  Правила дорожного движения для детей
Правила дорожного движения для детей How schoolchildren can contribute to keeping our planet green and clean
How schoolchildren can contribute to keeping our planet green and clean Организационная структура страховой компании. Понятие
Организационная структура страховой компании. Понятие Tehnici de vânzări
Tehnici de vânzări