Содержание
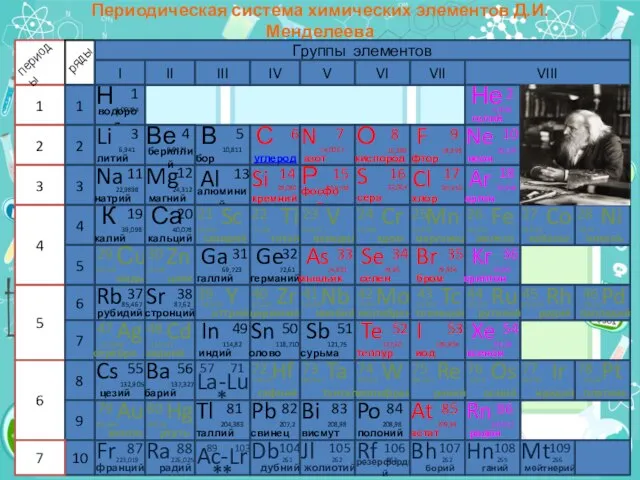
- 2. Периодическая система химических элементов Д.И.Менделеева Группы элементов I II III IV V VI 1 1 2
- 3. Периодическая система химических элементов Д.И.Менделеева 1 2 3 4 5 6 7 периоды ряды Группы элементов
- 4. Углерод
- 5. 1 s2 2 s2 2p2 Углерод назад
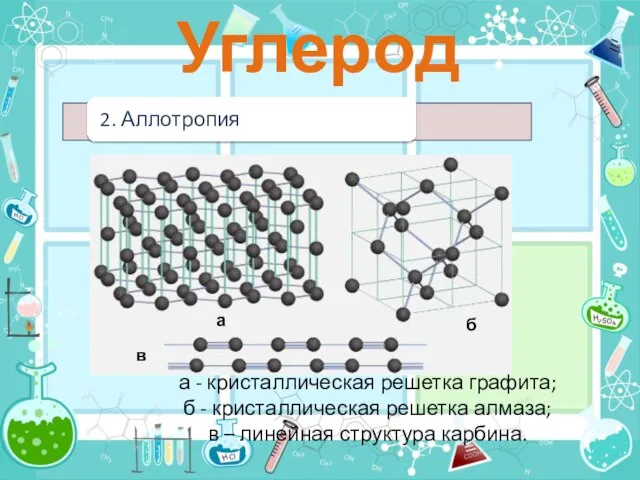
- 6. Аллотропные модификации углерода - алмаз, графит карбин.
- 7. а б в а - кристаллическая решетка графита; б - кристаллическая решетка алмаза; в – линейная
- 8. бесцветное кристаллическое вещество с атомной решеткой. Каждый атом углерода в алмазе окружен четырьмя другими, расположенными от
- 9. Да, алмаз - нестареющий камень. Он - самый-самый из минералов по всем показателям. Имеет самую высокую
- 10. жирное на ощупь вещество черного или серого цвета с металлическим блеском, тугоплавок (плавится под давлением 105
- 11. Кристаллическая решётка графита для графита характерна гексагональная кристаллическая решетка. Состоит из параллельных слоев, образованных правильными шестиугольниками
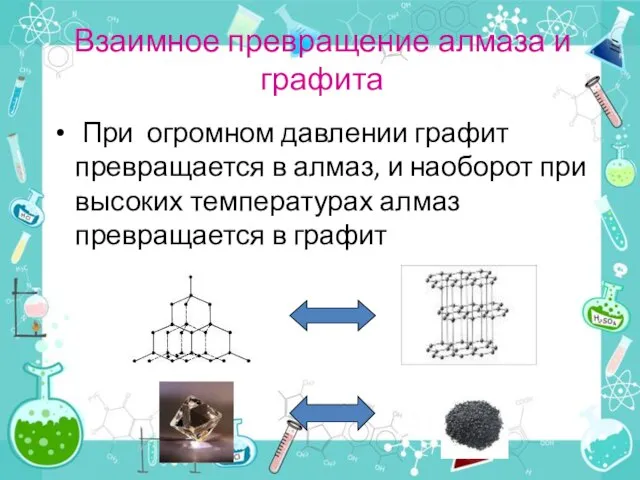
- 12. Взаимное превращение алмаза и графита При огромном давлении графит превращается в алмаз, и наоборот при высоких
- 13. аллотропная модификация углерода. Представляет собой черный порошок. Карбин является полупроводником и его проводимость возрастает под действием
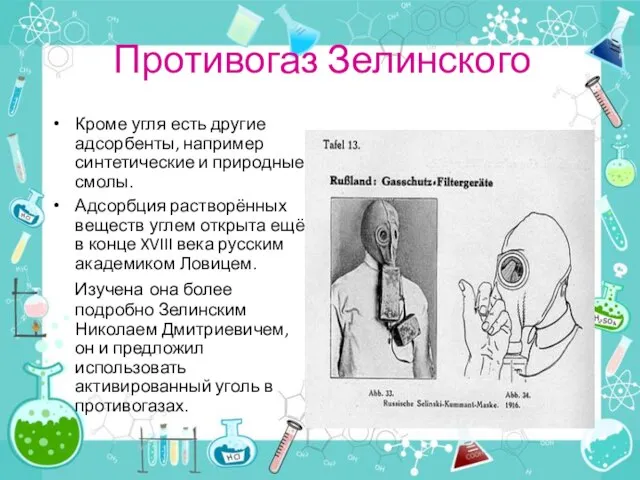
- 14. Адсорбция-свойство угля и других твёрдых веществ удерживать на своей поверхности пары, газы и растворённые вещества. Адсорбент-
- 15. Противогаз Зелинского Кроме угля есть другие адсорбенты, например синтетические и природные смолы. Адсорбция растворённых веществ углем
- 16. Зелинский Николай Дмитриевич Своим изобретением он спас миллионы солдат от страшной, мучительной смерти и сделал химическое
- 17. Активированный уголь Адсорбционная способность зависит от пористости вещества. Для увеличения пористости угля его активируют, нагревают в
- 18. Химические свойства. Cвойства окислителя: а) с металлами образует карбиды 4Al+3C=Al4C3 ( при нагревании) карбида алюминия получают
- 19. Свойства восстановителя в) восстанавливает металлы из их оксидов CuO + C = CO2 +Cu г) горит
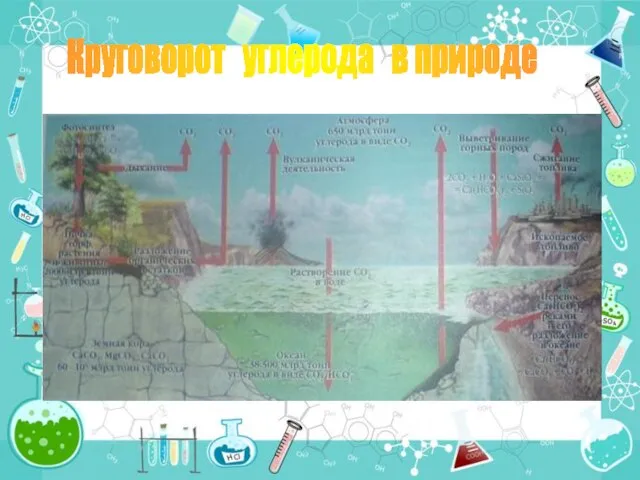
- 20. Круговорот углерода в природе
- 21. Углерод С сталь сельское хозяйство топливо медицина типография ювелирные изделия адсорбент резина крем обуви назад
- 22. Углерод Заполните кроссворд, отгадав ключевое слово, означающее процесс выделения различных веществ поверхностью угля. Явление, преломления лучей
- 24. Скачать презентацию
















 Учебный курсдля учащихся 4 классов
Учебный курсдля учащихся 4 классов Теории творчества и креативности
Теории творчества и креативности Русская трапеза
Русская трапеза ?
? Экслибрис. Задание по прикладной композиции
Экслибрис. Задание по прикладной композиции Большие гонки
Большие гонки Умники и умницы
Умники и умницы Презентация на тему Внешнее и внутреннее строение насекомого
Презентация на тему Внешнее и внутреннее строение насекомого Формула сайта:Успешный интернет-магазин от А до Я
Формула сайта:Успешный интернет-магазин от А до Я Управление Росприроднадзора по Свердловской области ОАО Уральский центр энергосбережения и экологии Сохранение и обустройство
Управление Росприроднадзора по Свердловской области ОАО Уральский центр энергосбережения и экологии Сохранение и обустройство  Основы тайм-менеджмента
Основы тайм-менеджмента Экслибрис – искусство книжного знака
Экслибрис – искусство книжного знака Securities fraud
Securities fraud Цикл менеджмента. Планирование
Цикл менеджмента. Планирование История возникновения логарифмов
История возникновения логарифмов Was ist in Deutschland
Was ist in Deutschland  Особенности делового этикета в Японии
Особенности делового этикета в Японии Социально-значимая деятельность школьников
Социально-значимая деятельность школьников Добро пожаловать в наш Педагогический колледж! Университетский Педагогический колледж №16 – это авторитетное, современное, дина
Добро пожаловать в наш Педагогический колледж! Университетский Педагогический колледж №16 – это авторитетное, современное, дина Управление проектами Тема 1 – введение в управление проектами Проф., д.т.н. А.А. Дульзон
Управление проектами Тема 1 – введение в управление проектами Проф., д.т.н. А.А. Дульзон Метапредметный подход при преподавании математики: использование технологии метапредмета «Задача»
Метапредметный подход при преподавании математики: использование технологии метапредмета «Задача» Питание и органы пищеварения
Питание и органы пищеварения Презентация на тему Конструирование текстов, предложений (2 класс)
Презентация на тему Конструирование текстов, предложений (2 класс) Божественный идеал в религиях мира (Буддизм)
Божественный идеал в религиях мира (Буддизм) Организация и проведение мероприятий направленных на привлечение детей занятиями лыжным спортом
Организация и проведение мероприятий направленных на привлечение детей занятиями лыжным спортом Совы
Совы Вглядываясь в человека. Портрет
Вглядываясь в человека. Портрет Визитная карточка начальной школы ГУО «Гимназия №20 г.Минска»
Визитная карточка начальной школы ГУО «Гимназия №20 г.Минска»