Содержание
- 2. Общая характеристика подгруппы класса Вода . Химические и физические свойства. Вода как растворитель Сероводород. Получение. Свойства
- 3. ns2np4 – общая электронная формула внешнего слоя. О 1s22s22p4 S 1s22s22p63s23p4 Se 1s22s22p63s23p63d104s24p4 Te 1s22s22p63s23p63d104s24p64d105s25p4 Сверху
- 4. Степени окисления кислорода
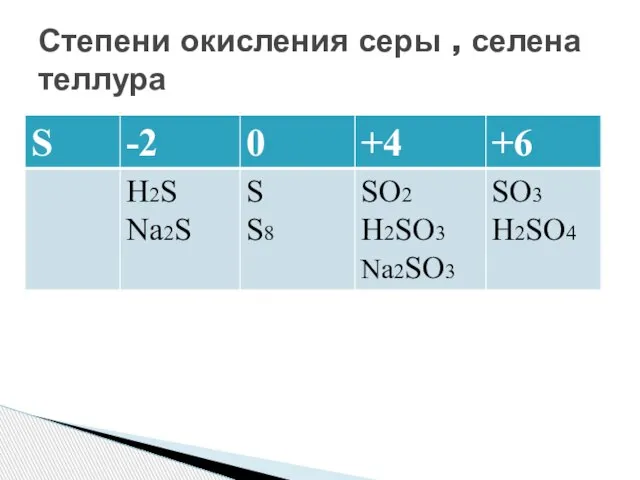
- 5. Степени окисления серы , селена теллура
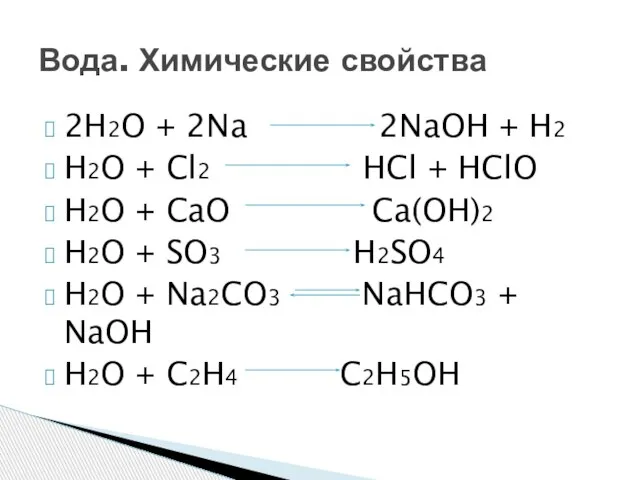
- 6. 2H2O + 2Na 2NaOH + H2 H2O + Cl2 HCl + HClO H2O + CaO Ca(OH)2
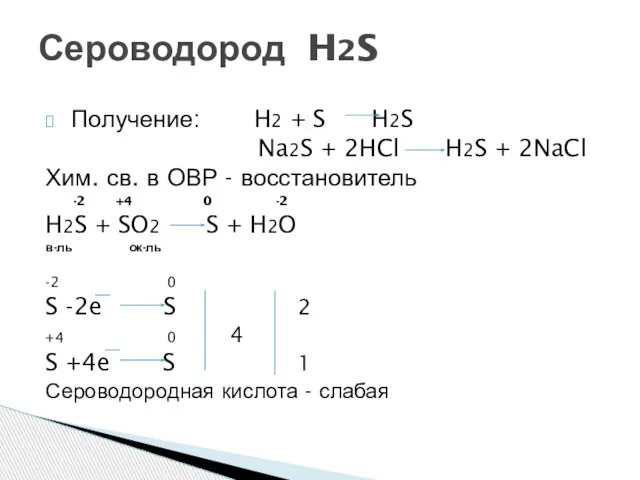
- 7. Получение: H2 + S H2S Na2S + 2HCl H2S + 2NaCl Хим. св. в ОВР -
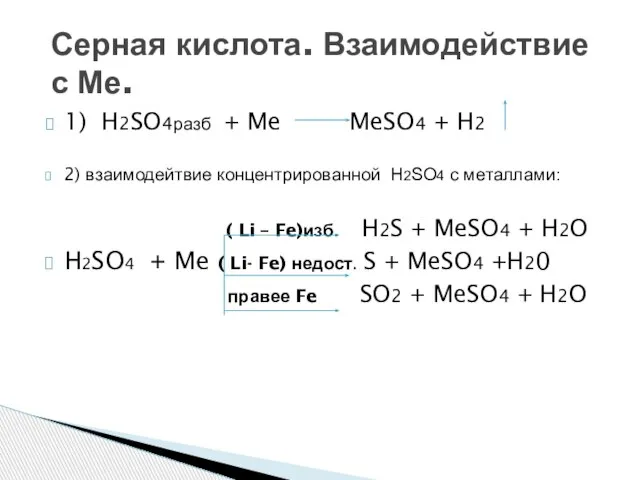
- 8. 1) H2SO4разб + Me MeSO4 + H2 2) взаимодейтвие концентрированной Н2SО4 с металлами: ( Li –
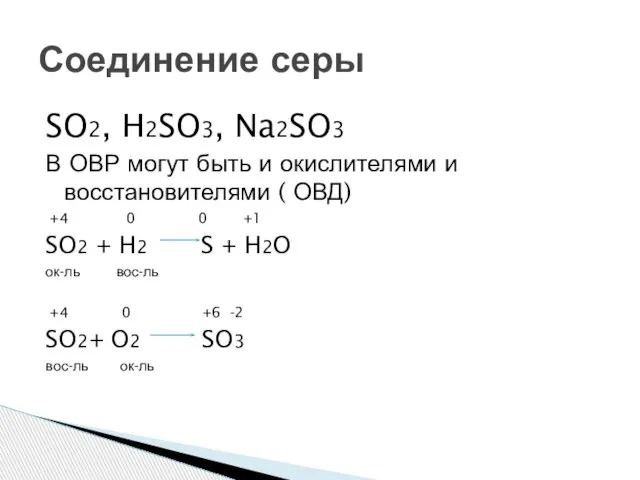
- 9. SO2, H2SO3, Na2SO3 В ОВР могут быть и окислителями и восстановителями ( ОВД) +4 0 0
- 10. План : Общая хар-ка подгруппы азота Аммиак. Получение. Свойства. Роль в ОВР Азотная кислота . Взаимодействие
- 11. ns2np3 – внешний электронный слой N 1s22s22p3 P 1s22s22p63s23p3 As 1s22s22p63s23p63d104s24p3 Sb 1s22s22p63s23p63d104s24p64d105s25p3 Bi 1s22s22p63s23p63d104s24p64d104f145s25p65d10 Сверху
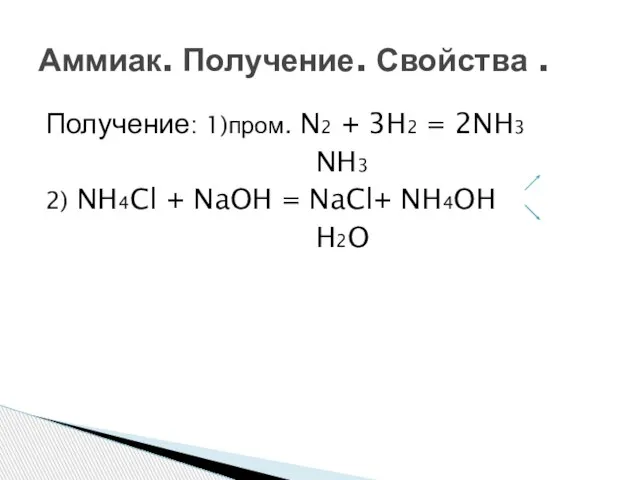
- 12. Получение: 1)пром. N2 + 3H2 = 2NH3 NH3 2) NH4Cl + NaOH = NaCl+ NH4OH H2O
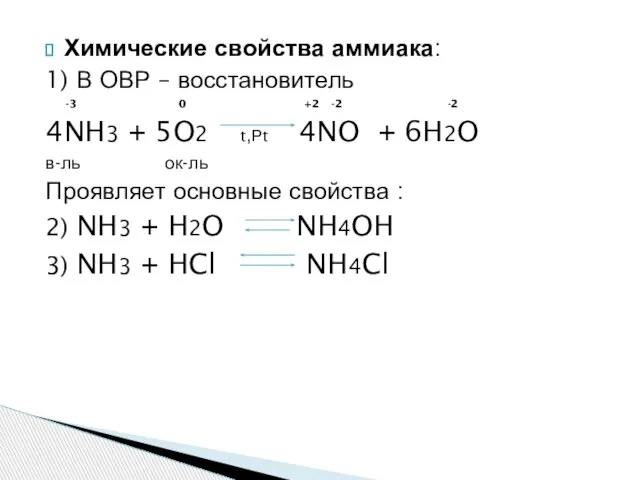
- 13. Химические свойства аммиака: 1) В ОВР – восстановитель -3 0 +2 -2 -2 4NH3 + 5O2
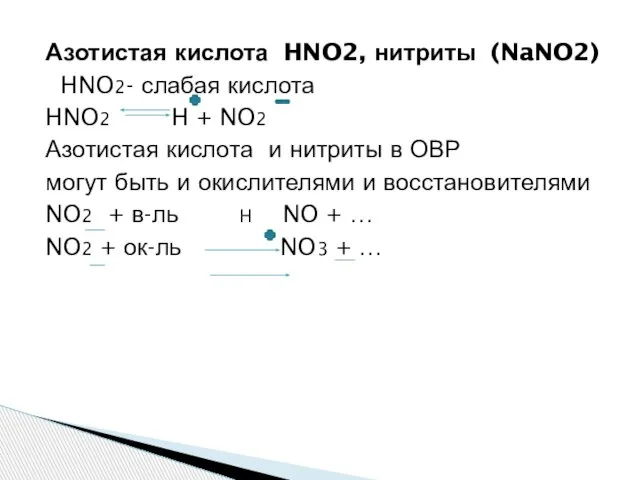
- 14. Азотистая кислота HNO2, нитриты (NaNO2) HNO2- слабая кислота HNO2 H + NO2 Азотистая кислота и нитриты
- 15. Биологическая роль азота и фосфора N – входит в состав всех аминокислот KNO3, NaNO3, NH4NO3 –
- 17. Скачать презентацию






 Новый менеджер в сформировавшейся команде – методы безболезненного внедрения Вершинина Екатерина
Новый менеджер в сформировавшейся команде – методы безболезненного внедрения Вершинина Екатерина SPE Outstanding Student Chapter and Gold Award Criteria
SPE Outstanding Student Chapter and Gold Award Criteria Предлог
Предлог Презентация на тему Физминутка для глаз
Презентация на тему Физминутка для глаз  Теплота згоряння палива. Розрахунок кількості теплоти внаслідок згоряння палива
Теплота згоряння палива. Розрахунок кількості теплоти внаслідок згоряння палива Вакцины от ВПЧ. Конкурентная борьба и стратегия работы врача женской консультации.Нужна ли нам государственная программа вакцина
Вакцины от ВПЧ. Конкурентная борьба и стратегия работы врача женской консультации.Нужна ли нам государственная программа вакцина Египетские пирамиды в Гизе
Египетские пирамиды в Гизе О дисциплинах цикла ГСЭ
О дисциплинах цикла ГСЭ Проект для сотрудников (шаблон)
Проект для сотрудников (шаблон) «Работа учреждения в рамках реализации закона 83-ФЗ»
«Работа учреждения в рамках реализации закона 83-ФЗ» Карикатурный портрет
Карикатурный портрет Am, is or are
Am, is or are ДОКЛАД: М.М. ТУЛЯГАНОВОЙ ОСОБЕННОСТИ НЕФОРМАЛЬНОЙ ЭКОНОМИКИ В РЕСПУБЛИКЕ УЗБЕКИСТАН
ДОКЛАД: М.М. ТУЛЯГАНОВОЙ ОСОБЕННОСТИ НЕФОРМАЛЬНОЙ ЭКОНОМИКИ В РЕСПУБЛИКЕ УЗБЕКИСТАН Кленовый лист, кленовый лист, ты мне среди зимы приснись
Кленовый лист, кленовый лист, ты мне среди зимы приснись Путешествия в сказку
Путешествия в сказку Визитная карточка школы
Визитная карточка школы ОПЕРАТИВНАЯ ПОЛИГРАФИЯ
ОПЕРАТИВНАЯ ПОЛИГРАФИЯ Учебный проектОсновные темы рассказа А.И. Куприна «Белый пудель»
Учебный проектОсновные темы рассказа А.И. Куприна «Белый пудель» London. Sightseeing of London
London. Sightseeing of London Документы и сведения, представляемые таможенным органам при прибытии на таможенную территорию Подготовили: студентки 3-го курса
Документы и сведения, представляемые таможенным органам при прибытии на таможенную территорию Подготовили: студентки 3-го курса  Логічні одиниці інформаціи
Логічні одиниці інформаціи Основы ЭКГ
Основы ЭКГ Английская монархия от завоевания до парламента
Английская монархия от завоевания до парламента Налоги. Объект налогообложения
Налоги. Объект налогообложения Освещение. Свет и тень. Правила распределения светотени в натюрморте
Освещение. Свет и тень. Правила распределения светотени в натюрморте Презентация "Художественный образ в произведениях музыки и изобразительного искусства" - скачать презентации по МХК
Презентация "Художественный образ в произведениях музыки и изобразительного искусства" - скачать презентации по МХК Учитель начальных классов высшей категории МОУ «СОШ №6» г. Бузулука Оренбургской области
Учитель начальных классов высшей категории МОУ «СОШ №6» г. Бузулука Оренбургской области Организация и планирование закупок. Тема 2
Организация и планирование закупок. Тема 2