Содержание
- 2. Электролиты Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных
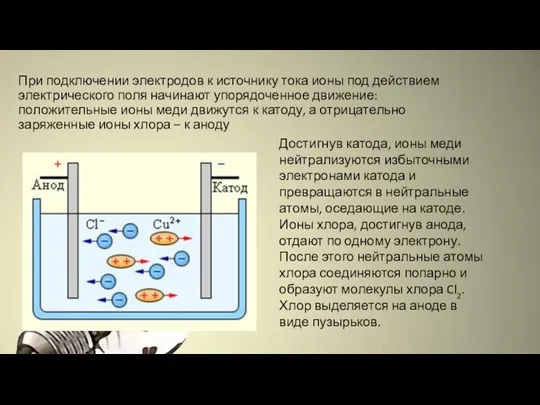
- 3. Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся
- 4. При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы
- 5. Диссоциация молекул сульфата меди происходит по следующей схеме Нейтральные атомы меди отлагаются в виде твердого осадка
- 6. Первый закон Фарадея для Электролиза Если пропускать через раствор медного купороса электрический ток в течение определённого
- 7. Фарадей установил взаимосвязь массы вещества, силы тока и времени. Математически эта взаимосвязь выражается следующим образом: m
- 8. Фарадей, пропуская электрический ток одинаковой силы через различные электролиты, заметил, что массы веществ на электродах неодинаковы.
- 9. На основе этих данных он вывел: Для определённого количества электричества масса химического элемента, образовавшегося на электроде,
- 10. Для выделения одного моля эквивалента затрачивается одинаковое количество электричества – 96485 Кл/моль. Это число называется числом
- 11. Вывод Фарадей, проводя реакцию электролиза разных веществ, вывел два закона. Согласно первому закону, масса вещества, осевшего
- 13. Скачать презентацию








 Управление электродвигателем в заданной последовательности
Управление электродвигателем в заданной последовательности Машина - техническое приспособление, выполняющее механические движения для преобразования энергии
Машина - техническое приспособление, выполняющее механические движения для преобразования энергии Линзы. Оптическая сила линзы. 9 класс
Линзы. Оптическая сила линзы. 9 класс Електричні двигуни
Електричні двигуни Плотность вещества
Плотность вещества Закон Ома. Светодиоды. Кнопки. Виды кнопок и переключателей
Закон Ома. Светодиоды. Кнопки. Виды кнопок и переключателей ППШ
ППШ Фотоно-кристалличские волокна
Фотоно-кристалличские волокна Конструкции электрических машин переменного тока
Конструкции электрических машин переменного тока Физика для химиков день третий. МКТ и электричество
Физика для химиков день третий. МКТ и электричество Движение твердых тел, жидкости и газов
Движение твердых тел, жидкости и газов Ультразвуковые технологии. Технология 9 класс
Ультразвуковые технологии. Технология 9 класс Транзистор. Виды транзисторов
Транзистор. Виды транзисторов Машиностроительное черчение. Зубчатые передачи: классификация, основные элементы
Машиностроительное черчение. Зубчатые передачи: классификация, основные элементы Параметры эвольвентного зубчатого зацепления
Параметры эвольвентного зубчатого зацепления Презентация на тему Электрическое поле (8 класс)
Презентация на тему Электрическое поле (8 класс)  Сообщающиеся сосуды. 7 класс
Сообщающиеся сосуды. 7 класс Презентация на тему Удельная теплоемкость
Презентация на тему Удельная теплоемкость  Матрица
Матрица Диэлектрики и проводники в электрическом поле
Диэлектрики и проводники в электрическом поле Презентация на тему Решение задач: уравнение газового состояния
Презентация на тему Решение задач: уравнение газового состояния  Измерительные приборы
Измерительные приборы Поверхностное натяжение
Поверхностное натяжение Экзаменационные вопросы по ФЯР
Экзаменационные вопросы по ФЯР Развитие представлений о строении атома. Модель резерфорда
Развитие представлений о строении атома. Модель резерфорда Давление жидкостей и газов, закон Архимеда
Давление жидкостей и газов, закон Архимеда Индукция. Самоиндукция. Интерактивный кроссворд Автор: Апрельская Валентина Ивановна, учитель физики МБОУ « СОШ № 11» ИМРСК,
Индукция. Самоиндукция. Интерактивный кроссворд Автор: Апрельская Валентина Ивановна, учитель физики МБОУ « СОШ № 11» ИМРСК,  Сравнение основных параметров импульсных и линейных источников питания
Сравнение основных параметров импульсных и линейных источников питания