Содержание
- 2. ЦЕЛИ УРОКА: Изучить понятия об электролитах и неэлектролитах. Рассмотреть механизм диссоциации веществ с различным типом связи.
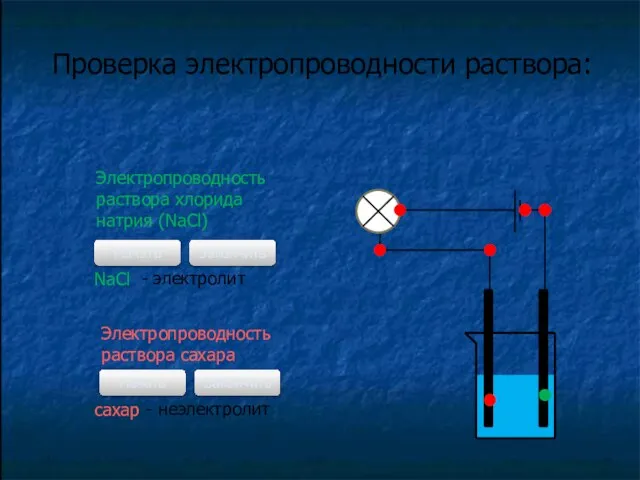
- 3. Проверка электропроводности раствора: Электропроводность раствора хлорида натрия (NaCl) Начать Закончить NaCl - электролит Электропроводность раствора сахара
- 5. С.Аррениус изучая электропроводность растворов различных веществ, пришел в 1887 г. к выводу, что причиной электропроводности является
- 6. Сванте Аррениус (1859-1927) Шведский физикохимик, создатель теории электролитической диссоциации, академик Королевской академии наук Швеции.
- 7. C Аррениус считал, что в растворах находятся свободные ионы ( не учитывал взаимодействия электролита с водой).
- 8. Схема электролитической диссоциации хлорида натрия на гидратированные ионы 1) Ориентация молекул – диполей воды около ионов
- 9. 1.Ориентация молекул воды вокруг полюсов молекулы электролита. Схема электролитической диссоциации полярной молекулы хлороводорода на гидратированные ионы
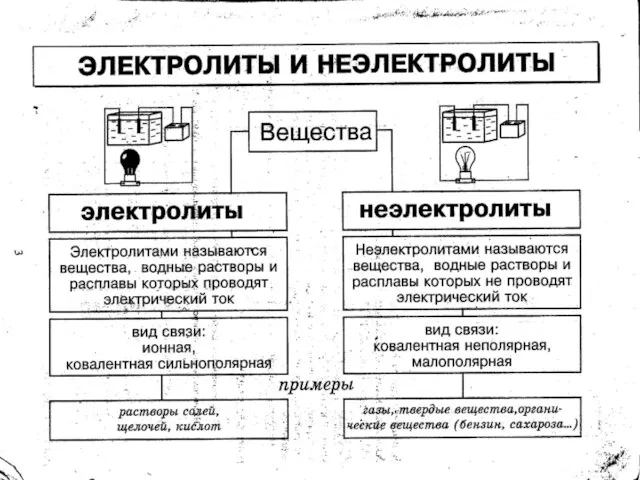
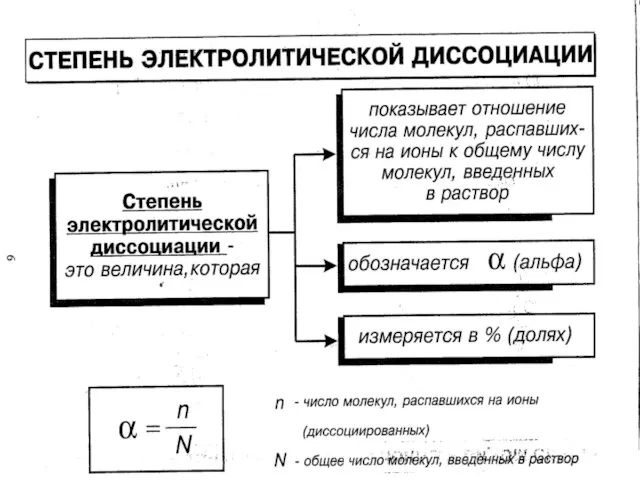
- 10. В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которую
- 13. Проверь себя! Что является причиной электропроводности веществ? наличие в растворе ионов. 2) Как называется процесс распада
- 15. Скачать презентацию









 Научное открытие России: Гравитационные волны
Научное открытие России: Гравитационные волны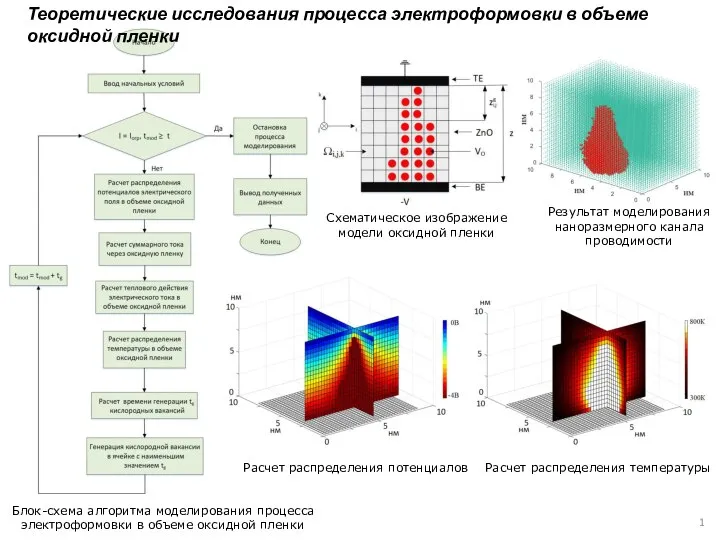 Модель исследования процесса электроформовки в объеме оксидной пленки
Модель исследования процесса электроформовки в объеме оксидной пленки Фотометрия Бугера, Ламберта, Бера
Фотометрия Бугера, Ламберта, Бера Деформированное состояние в точке. Обобщенный закон Гука. Лекция 10
Деформированное состояние в точке. Обобщенный закон Гука. Лекция 10 Презентация на тему Паровые машины
Презентация на тему Паровые машины  Электромагнитные колебания
Электромагнитные колебания Принципы действия различных типов двигателей. Двигатели внешнего сгорания
Принципы действия различных типов двигателей. Двигатели внешнего сгорания Техническое состояние трансмиссии автомобилей
Техническое состояние трансмиссии автомобилей Чувствительность взрывчатых систем к внешним воздействиям
Чувствительность взрывчатых систем к внешним воздействиям Закон сохранения механической энергии
Закон сохранения механической энергии Нефтегазовая и рудная геофизика. Сейсмические методы при изучении строения земной коры
Нефтегазовая и рудная геофизика. Сейсмические методы при изучении строения земной коры Реологиялық әдістер. Кернеу және пішін өзгерісі
Реологиялық әдістер. Кернеу және пішін өзгерісі Радиоволны. История открытия
Радиоволны. История открытия Выдающиеся физики
Выдающиеся физики Ядерная геофизика
Ядерная геофизика Визуальный и измерительный метод неразрушающего контроля. Электронный учебный курс
Визуальный и измерительный метод неразрушающего контроля. Электронный учебный курс Кинематика твердого тела/ Простейшие движения твердого тела
Кинематика твердого тела/ Простейшие движения твердого тела Сила трения. Сила упругости
Сила трения. Сила упругости Становление физиологии. Ятрофизика, ятромеханика
Становление физиологии. Ятрофизика, ятромеханика 840842
840842 Ангармонизм, упругость
Ангармонизм, упругость Взаимные превращения жидкостей и газов
Взаимные превращения жидкостей и газов Диадинамические токи
Диадинамические токи Презентация на тему Взаимодействие частиц вещества
Презентация на тему Взаимодействие частиц вещества  Выпускная бакалаврская работа Повышение безопасности труда при ремонте сельскохозяйственной техники
Выпускная бакалаврская работа Повышение безопасности труда при ремонте сельскохозяйственной техники Особенности эксплуатации оборудования для ТО и ТР колес и шин (урок 20-23)
Особенности эксплуатации оборудования для ТО и ТР колес и шин (урок 20-23) Блоки. Простые механизмы
Блоки. Простые механизмы Определение толщины зуба на любом радиусе
Определение толщины зуба на любом радиусе