Содержание
- 2. ФИЗИЧЕСКАЯ ХИМИЯ ХИМИЧЕСКАЯ КИНЕТИКА Лекция 1 2017 г
- 3. Химическая кинетика Химическая кинетика наряду с термоди-намикой и строением вещества составляет теоретический фундамент современной химии. Она
- 4. Предмет и основные понятия Химическая кинетика – это учение о скорости и механизме процесса и его
- 5. Формальная кинетика Направление химической кинетики, позволившее разработать методику расчета скорости химических реакций и динамику изменения концентрации
- 6. Типы химических реакций Простые реакции является совокупностью однотипных элементарных химических актов, представляющих собой превращение реагентов в
- 7. Типы химических реакций Химические реакции в своем большинстве являются сложными, т. е., включают несколько элементарных (простых)
- 8. Энергия активации процесса Необходимым условием протекания любой химической реакции является реакционная способность реагентов, т. е. наличие
- 9. Cостояние реагирующей системы Различают статические химические реакции, протекающие в закрытых системах, неспособных обмениваться массой с окружающей
- 10. Открытые системы Системы, в которых имеет место материальный обмен с окружающей средой, называются открытыми системами. Большинство
- 11. Типы химических реакций Химические реакции, протекающие в гомогенных системах (в их объеме), называются гомогенными, т.е. осуществляются
- 12. Кинетика гомогенных химических реакций Формальная кинетика В кинетике скорость химической реакции представляется как функция концентрации реагентов
- 13. Скорость химических реакций
- 14. Реакционное пространство R
- 15. Глубина протекания реакции
- 16. В закрытых системах изменение количества вещества с течением времени происходит только за счет протекания в них
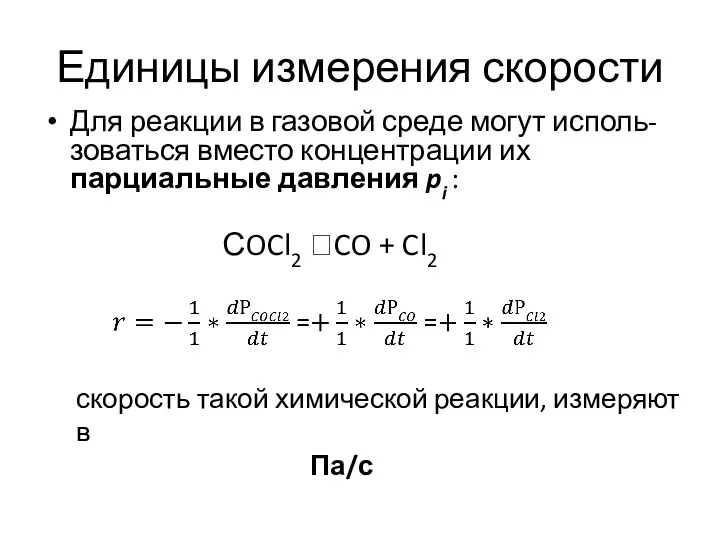
- 17. Единицы измерения скорости Для реакции в газовой среде могут исполь-зоваться вместо концентрации их парциальные давления pi
- 18. Кинетическое уравнение химических реакций Кинетическое уравнение это зависимость скорости реакции от концентрации реагентов. Для простых реакций
- 19. Закон действующих масс Величина k численно равна скорости реакции при концентрациях всех реагентов, равных единице. Она
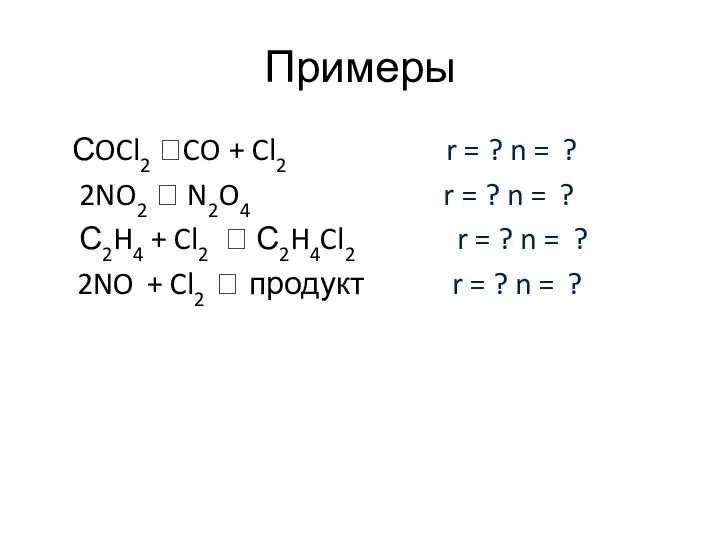
- 20. Примеры СOCl2 ?CO + Cl2 r = ? n = ? 2NO2 ? N2O4 r =
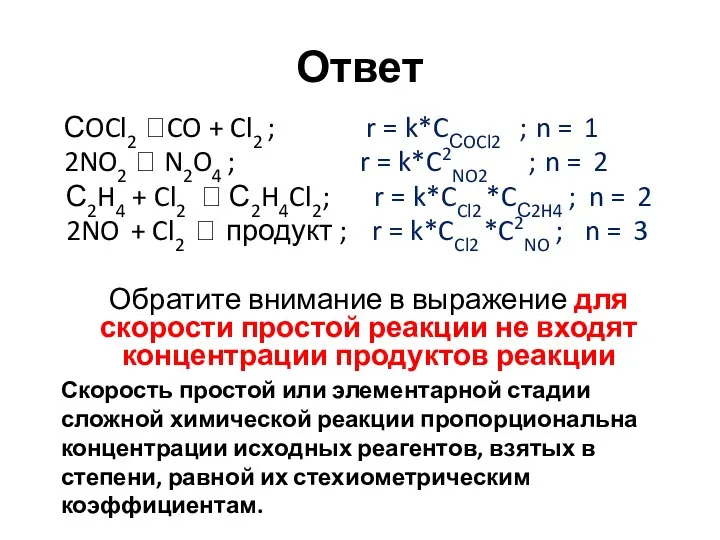
- 21. Ответ СOCl2 ?CO + Cl2 ; r = k*CСOCl2 ; n = 1 2NO2 ? N2O4
- 22. Пример
- 23. Молекулярность и порядок В кинетике химические реакции разделяют по признаку молекулярности реакции и по признаку порядка
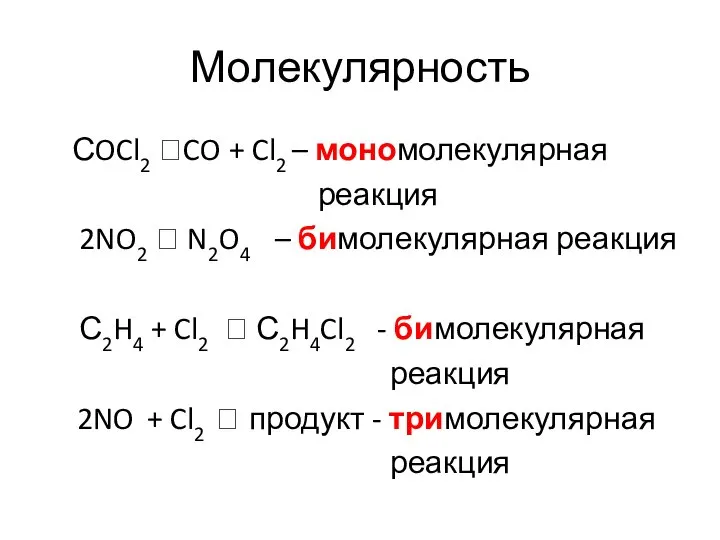
- 24. Молекулярность СOCl2 ?CO + Cl2 – мономолекулярная реакция 2NO2 ? N2O4 – бимолекулярная реакция С2H4 +
- 25. Порядок реакции Порядок ni реакции по компоненту – это показатель степени при концентрации i-го реагентов в
- 26. Примеры СOCl2 ?CO + Cl2 ; n = 1 (реакция 1 порядка) 2NO2 ? N2O4 ;
- 27. Критерии простой реакции Стехиометрическое уравнение реакции описывает реальной механизм химической реакции. Молекулярность простой реакции совпадает с
- 28. Пример вопроса на экзамене Понятие простой и сложной реакции. Для некоторой реакции А + В ?C
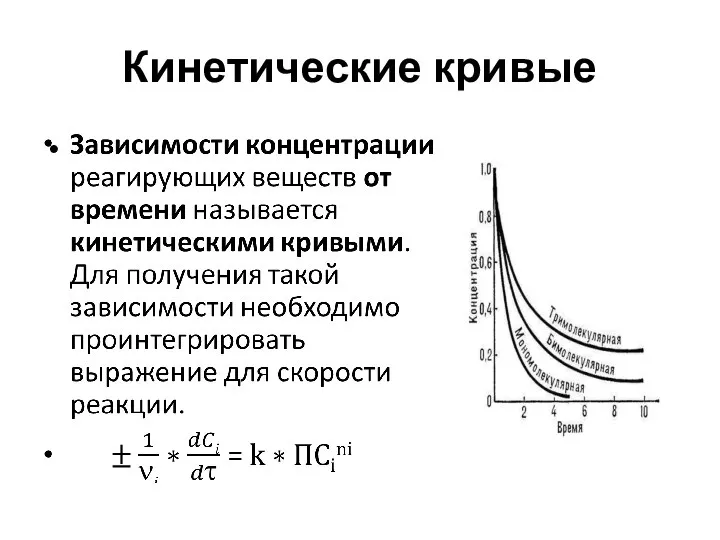
- 29. Кинетические кривые
- 30. Формальная кинетика простых реакций Лекция 2 2018
- 31. Реакция «0» порядка (y =ax + b) tgα = a tgα = -k
- 32. Время полупревращения Для характеристики скорости реакции наряду с константой скорости часто пользуются временем, или периодом полупревращения
- 33. Реакция 1 порядка N2O5 ? 2NO2 + 1/2O2
- 36. Вывод интегрального уравнения
- 38. Размерность константы скорости
- 40. Задание
- 42. Скачать презентацию




























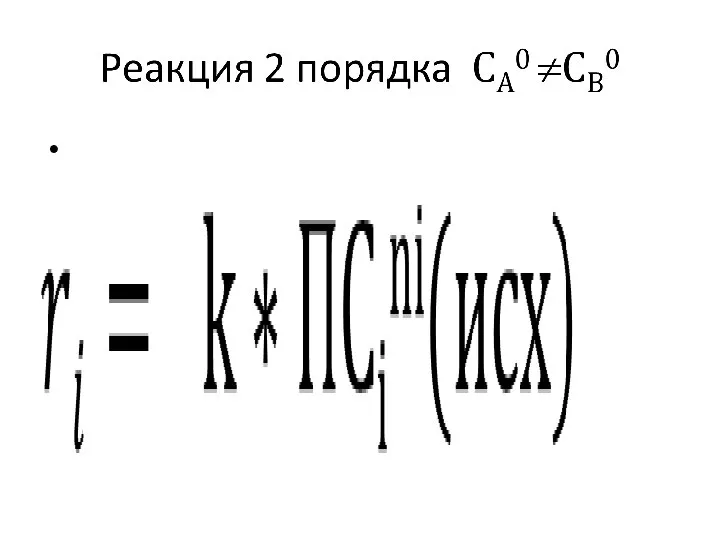



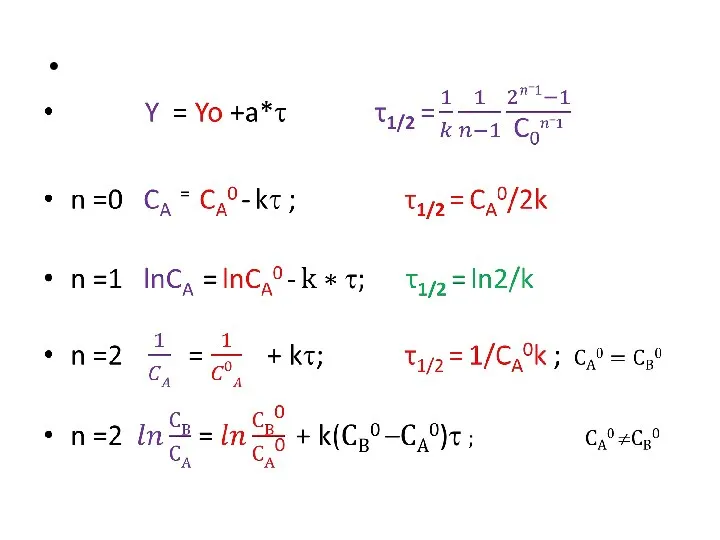

 Теория пластин
Теория пластин Работа и мощность электрического тока
Работа и мощность электрического тока Скорость движения
Скорость движения Узгоджувальні пристрої. Лекція 2
Узгоджувальні пристрої. Лекція 2 Второе начало термодинамики. Принцип действия тепловой машины и ее КПД. Лекция 6
Второе начало термодинамики. Принцип действия тепловой машины и ее КПД. Лекция 6 Электрический ток
Электрический ток Энергетические установки в космосе
Энергетические установки в космосе Квантовая радиофизика
Квантовая радиофизика Презентация на тему Внутренняя энергия. Количество теплоты
Презентация на тему Внутренняя энергия. Количество теплоты  Система пуска двигателя
Система пуска двигателя Силы. Действие силы
Силы. Действие силы Презентация на тему Приливы, отливы, их использование 9 класс
Презентация на тему Приливы, отливы, их использование 9 класс  Допуски и посадки
Допуски и посадки Освещение. Свет и тень
Освещение. Свет и тень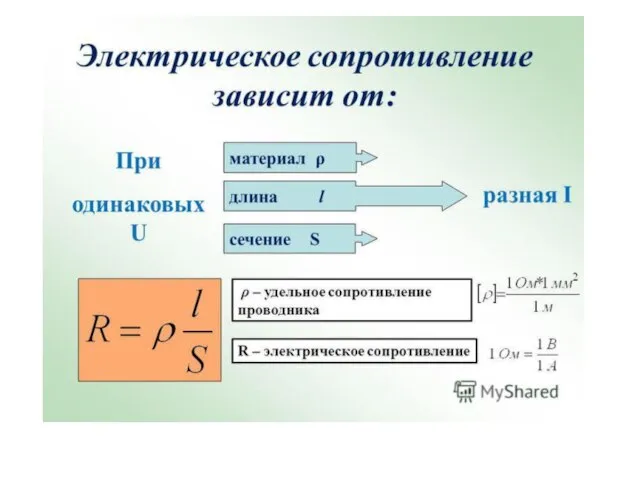 Электрическое сопротивление
Электрическое сопротивление Применение первого начала термодинамики к изопроцессам
Применение первого начала термодинамики к изопроцессам Дви́гатель вну́треннего сгора́ния (ДВС)
Дви́гатель вну́треннего сгора́ния (ДВС) Энергия топлива. Удельная теплота сгорания
Энергия топлива. Удельная теплота сгорания Цифровые измерительные приборы. Мультиметр
Цифровые измерительные приборы. Мультиметр Цепи переменного тока с последовательным соединением элементов
Цепи переменного тока с последовательным соединением элементов Основные Законы Природы
Основные Законы Природы Живой свет свечи
Живой свет свечи Преломление света. Физический смысл показателя преломления. Электромагнитные явления
Преломление света. Физический смысл показателя преломления. Электромагнитные явления Лед и соль!
Лед и соль! Дробилка безрешетная
Дробилка безрешетная Презентация на тему Перемещение при прямолинейном равноускоренном движении (9 класс)
Презентация на тему Перемещение при прямолинейном равноускоренном движении (9 класс)  Уравнение движения
Уравнение движения Изобретения, подсказанные природой
Изобретения, подсказанные природой