Содержание
- 2. Газовые законы Количественные зависимости между двумя из параметров состояния газа (р, V, T), когда третий параметр
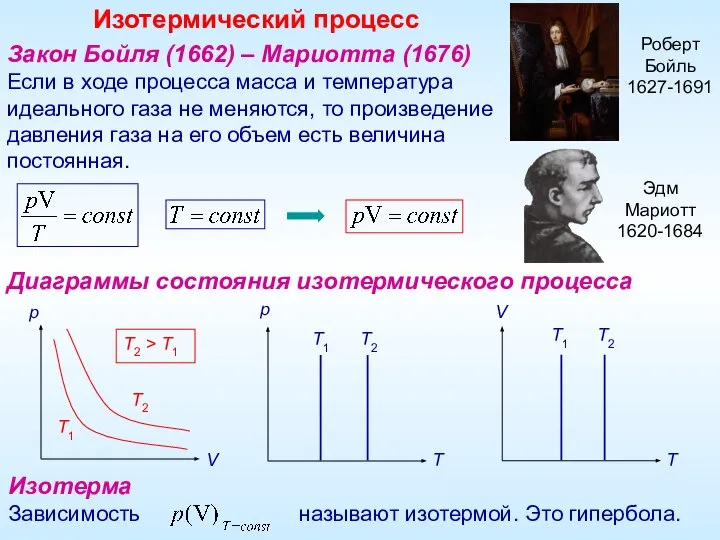
- 3. Закон Бойля (1662) – Мариотта (1676) Если в ходе процесса масса и температура идеального газа не
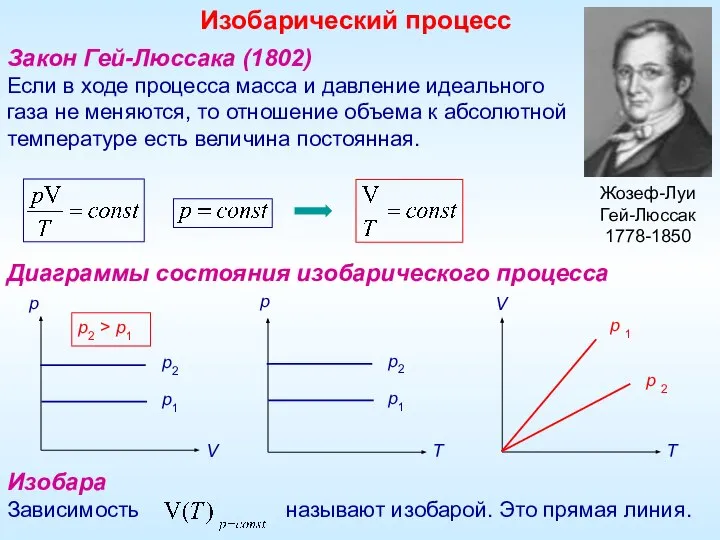
- 4. Закон Гей-Люссака (1802) Если в ходе процесса масса и давление идеального газа не меняются, то отношение
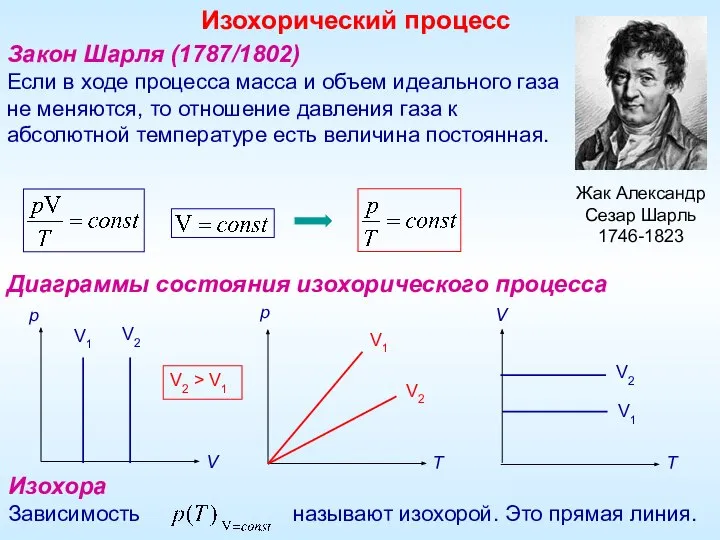
- 5. Закон Шарля (1787/1802) Если в ходе процесса масса и объем идеального газа не меняются, то отношение
- 6. Объемное тепловое расширение газов Закон Гей-Люссака в другом виде: чему равен объем газа V при температуре
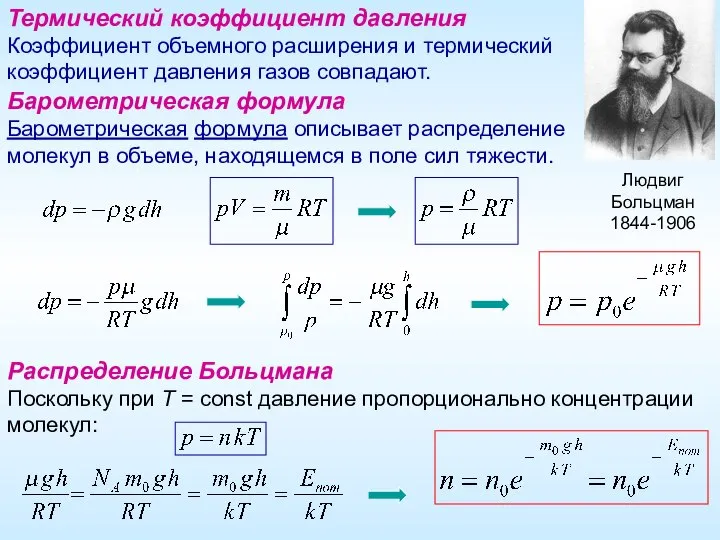
- 7. Термический коэффициент давления Коэффициент объемного расширения и термический коэффициент давления газов совпадают. Барометрическая формула Барометрическая формула
- 8. Явления переноса В отсутствии равновесия в газе имеются пространственные неоднородности параметров (давления, плотности, температуры). Если газ
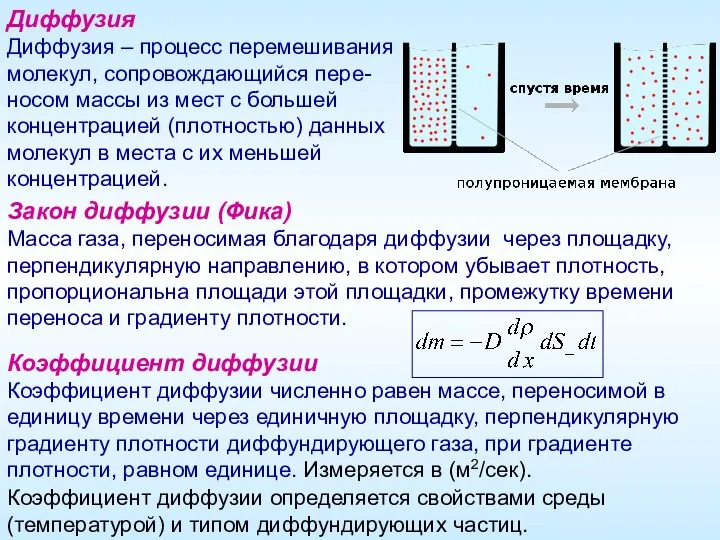
- 9. Диффузия Диффузия – процесс перемешивания молекул, сопровождающийся пере- носом массы из мест с большей концентрацией (плотностью)
- 10. Теплопроводность Теплопроводность – процесс выравнивания температуры тела, сопровождающийся направленным переносом тепла из более нагретых мест в
- 11. Вязкость Вязкость – процесс выравнивания скоростей частиц тела, сопровождающийся направленным переносом импульса из более быстрых слоев
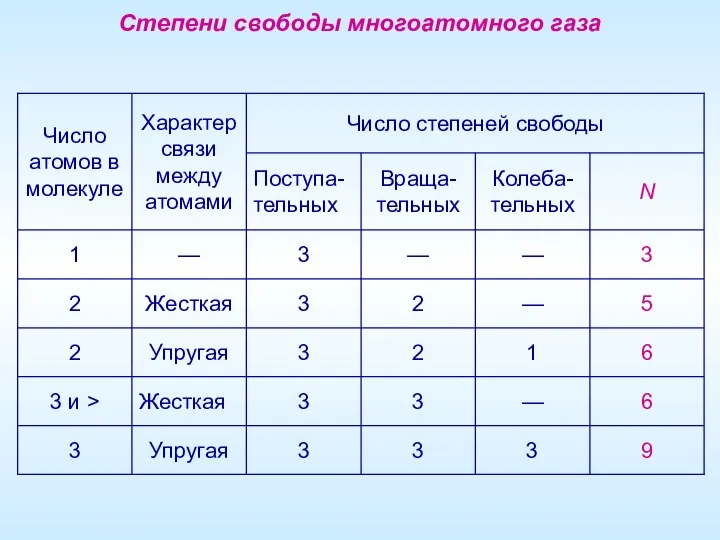
- 12. Многоатомный газ Степени свободы системы (N) Числом степеней свободы материального объекта называется число независимых координат, которые
- 13. Степени свободы многоатомного газа
- 14. Средняя энергия молекул одноатомного газа Распределение энергии по степеням свободы молекул Поступательно двигаются только одноатомные молекулы.
- 15. Идеальный газ 1) Молекулы действуют как точечные массы (что приблизительно соответствует действительности, если они удалены друг
- 16. Уравнение Ван-дер-Ваальса (1873) Для 1 моля: Для молей: Значение уравнения Ван-дер-Ваальса: 1) уравнение было получено из
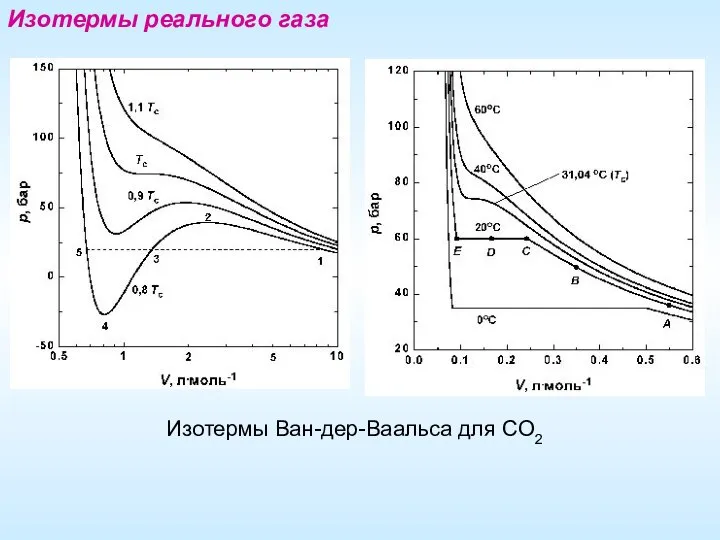
- 17. Изотермы реального газа Изотермы Ван-дер-Ваальса для СО2
- 18. Переход жидкость–газ Притяжение между молекулами приводит к тому, что В. назвал внутренним давлением, которое стремится удержать
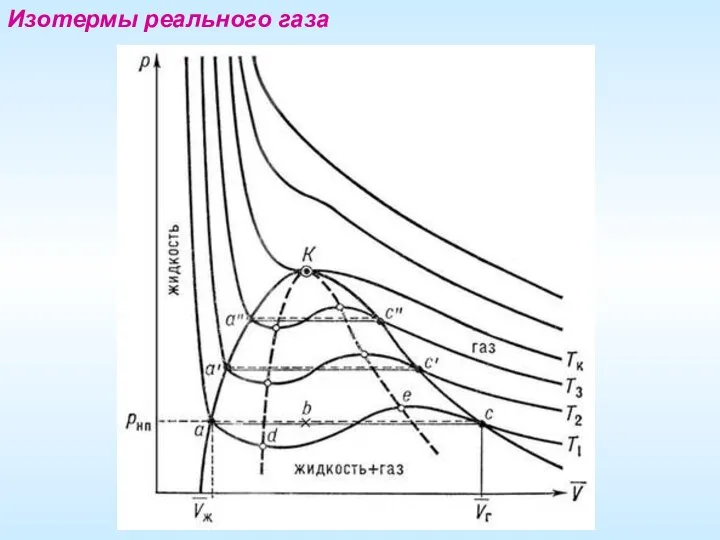
- 19. Изотермы реального газа
- 21. Скачать презентацию










 Центр тяжести
Центр тяжести Силы. Сила тяжести
Силы. Сила тяжести Выпуск первого автомобиля в г. Тольятти
Выпуск первого автомобиля в г. Тольятти Термодинамические процессы
Термодинамические процессы Мирный атом
Мирный атом Осциллограф. Классификация
Осциллограф. Классификация Фотометрия Пьера Бугера
Фотометрия Пьера Бугера Презентация на тему Молекулярная физика
Презентация на тему Молекулярная физика  Электромагнитное поле и волны
Электромагнитное поле и волны Кипение воды
Кипение воды Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Проект создания точной копии летающего аэроплана Блерио XI
Проект создания точной копии летающего аэроплана Блерио XI Май күпдеші озған өткізгіш материал және оның парамтрі
Май күпдеші озған өткізгіш материал және оның парамтрі Архимедова сила. 7 класс
Архимедова сила. 7 класс Движение частиц в экспериментах ЯМР
Движение частиц в экспериментах ЯМР Презентация на тему Оптические иллюзии или обман зрения
Презентация на тему Оптические иллюзии или обман зрения  Основы технологии электронной компонентной базы
Основы технологии электронной компонентной базы Построение изображения в линзах
Построение изображения в линзах Закон Бойля-Мариотта
Закон Бойля-Мариотта Центр тяжести.Виды равновесия (10 класс)
Центр тяжести.Виды равновесия (10 класс) Свойства звуковых волн
Свойства звуковых волн Механическое движение. Масса. Плотность. Решение задач
Механическое движение. Масса. Плотность. Решение задач Плоское движение капсулы в атмосфере
Плоское движение капсулы в атмосфере Презентация на тему Методы наблюдения и регистрации элементарных частиц
Презентация на тему Методы наблюдения и регистрации элементарных частиц  Механика деформируемого твердого тела
Механика деформируемого твердого тела Закон всемирного тяготения
Закон всемирного тяготения Магнитный поток
Магнитный поток Элементы специальной теории относительности (СТО). Лекция 7
Элементы специальной теории относительности (СТО). Лекция 7