Содержание
- 2. Идеальный газ — упрощённая модель реальных газов.
- 3. Отличия идеального газа от реального 1. Частицы идеального газа — сферические тела очень малых размеров, практически
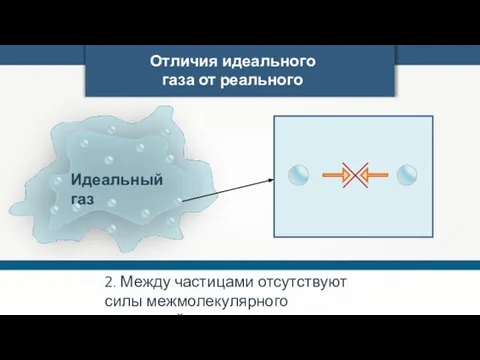
- 4. Отличия идеального газа от реального 2. Между частицами отсутствуют силы межмолекулярного взаимодействия.
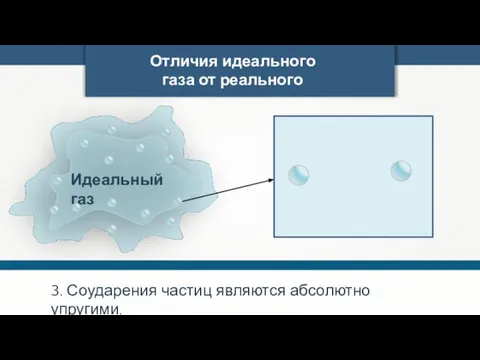
- 5. Отличия идеального газа от реального 3. Соударения частиц являются абсолютно упругими.
- 6. Молекулярно-кинетическая теория рассматривает идеальный газ как модель, в которой не учитывается взаимодействие частиц и их собственный
- 7. Масса Диаметр Скорость Энергия — количество частиц (молекул)
- 8. Температура Объём Давление
- 9. Реальные разрежённые газы действительно ведут себя подобно идеальному газу.
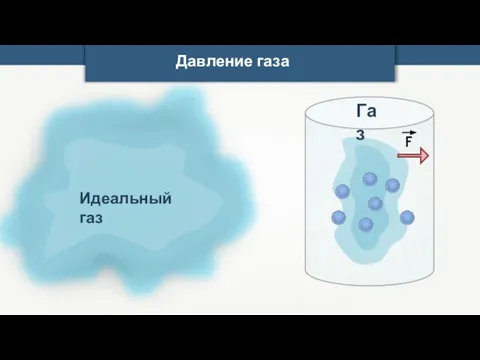
- 10. Давление газа
- 11. Давление газа
- 12. Давление газа Газ F
- 13. Давление газа Чем больше частиц содержится в сосуде, тем чаще они будут ударяться о стенку сосуда,
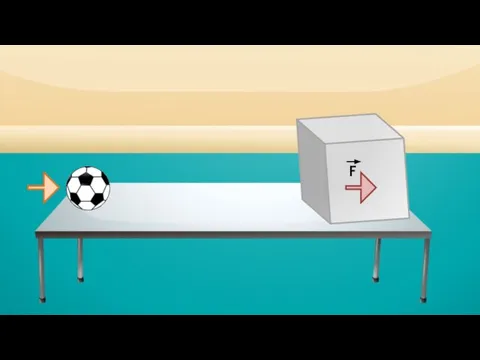
- 14. F
- 15. F
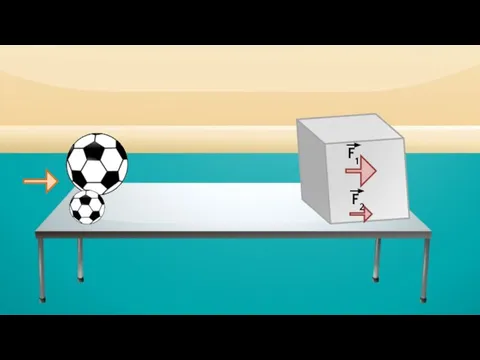
- 16. F1 F2
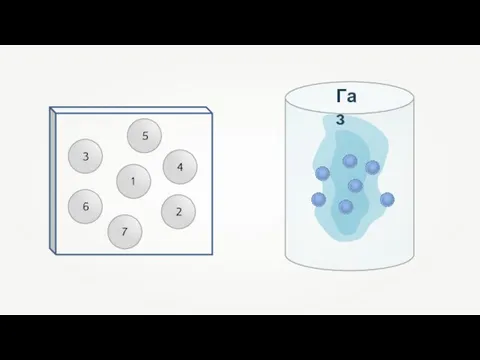
- 17. Газ
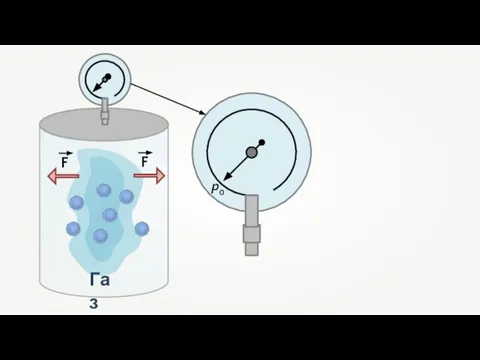
- 18. p0 F F Газ
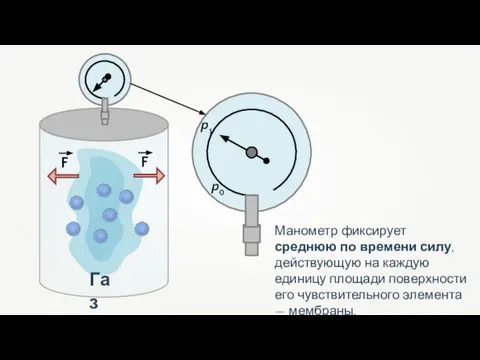
- 19. p0 p1 F F Манометр фиксирует среднюю по времени силу, действующую на каждую единицу площади поверхности
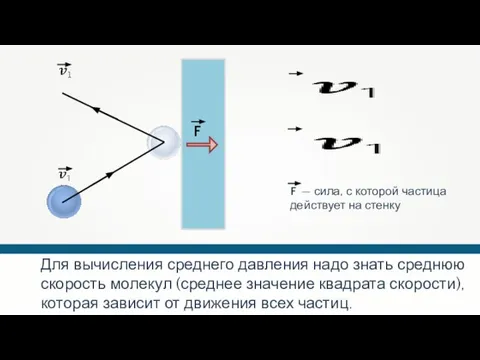
- 20. Для вычисления среднего давления надо знать среднюю скорость молекул (среднее значение квадрата скорости), которая зависит от
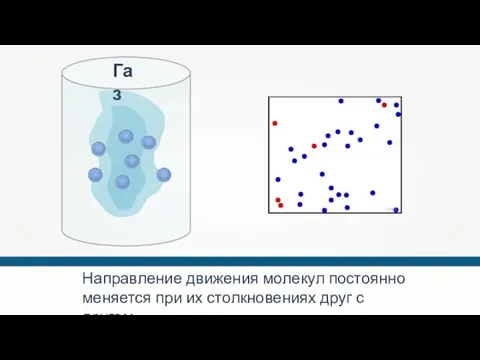
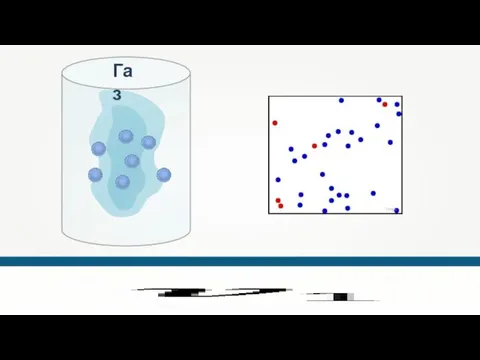
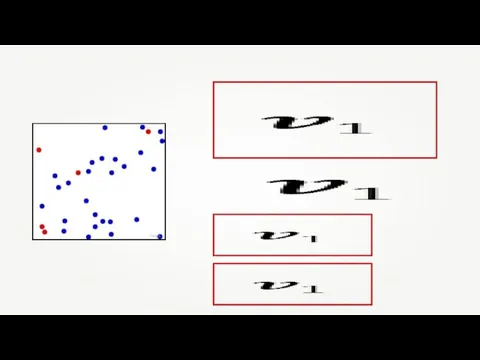
- 21. Направление движения молекул постоянно меняется при их столкновениях друг с другом. Greg L Газ
- 23. Greg L Газ
- 25. Greg L
- 27. Справедливость этого уравнения была экспериментально доказана в XIX в., после чего началось быстрое развитие количественной теории,
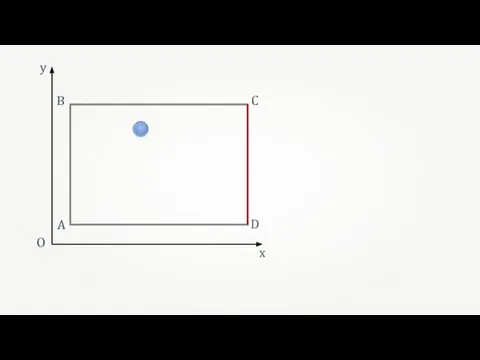
- 28. O x y A B C D
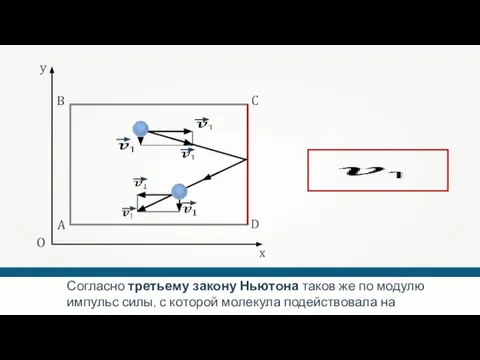
- 29. A B C D O x y Согласно второму закону Ньютона, изменение импульса молекулы равно импульсу
- 30. A B C D O x y Согласно третьему закону Ньютона таков же по модулю импульс
- 31. Газ Газ
- 32. Газ Газ
- 33. Согласно второму закону Ньютона изменение импульса любого тела за единицу времени равно действующей на него силе.
- 34. Давление газа прямо пропорционально концентрации частиц, массе частицы и квадрату скорости частицы. Основное уравнение молекулярно-кинетической теории
- 35. Зависимость давления идеального газа от концентрации и от средней кинетической энергии частиц выражается основным уравнением молекулярно-кинетической
- 36. Давление идеального газа пропорционально произведению концентрации молекул и средней кинетической энергии поступательного движения молекул.
- 38. Скачать презентацию


















 Организация технического обслуживания и ремонта системы питания дизельного двигателя Mitsubishi L200
Организация технического обслуживания и ремонта системы питания дизельного двигателя Mitsubishi L200 Методы наблюдения и регистрации элементарных частиц
Методы наблюдения и регистрации элементарных частиц Влияние накипи на энергетические и денежные затраты
Влияние накипи на энергетические и денежные затраты Явление инерция. Инерция покоя. Инерция движения
Явление инерция. Инерция покоя. Инерция движения Навигация по геофизическим полям
Навигация по геофизическим полям Ламповый генератор
Ламповый генератор Теория функционала плотности: война с бесконечностью
Теория функционала плотности: война с бесконечностью Досліди Фарадея. Явище електромагнітної індукції. 9кл
Досліди Фарадея. Явище електромагнітної індукції. 9кл ЭДС индукции в движущихся проводниках. Решение задач
ЭДС индукции в движущихся проводниках. Решение задач Работа и мощность электрического тока. Закон Джоуля-Ленца. КПД источника тока
Работа и мощность электрического тока. Закон Джоуля-Ленца. КПД источника тока Презентация на тему Изменение агрегатного состояния вещества
Презентация на тему Изменение агрегатного состояния вещества  Презентация на тему Действие магнитного поля на проводники с током (11 класс)
Презентация на тему Действие магнитного поля на проводники с током (11 класс)  Методы наблюдения и регистрации элементарных частиц
Методы наблюдения и регистрации элементарных частиц Изображения, даваемые линзой
Изображения, даваемые линзой Задачи по ТМ. Сложение ускорений
Задачи по ТМ. Сложение ускорений Электромагнитные колебания
Электромагнитные колебания Дифракция световых волн
Дифракция световых волн Простые механизмы. Момент силы. Золотое правило механики. 7 класс
Простые механизмы. Момент силы. Золотое правило механики. 7 класс Инструменты и приборы
Инструменты и приборы Следствия из преобразований Лоренца. Сложение скоростей в специальной теории относительности. Релятивистская динамика
Следствия из преобразований Лоренца. Сложение скоростей в специальной теории относительности. Релятивистская динамика Принцип Гюйгенса. Дифракция механических волн
Принцип Гюйгенса. Дифракция механических волн Фізика. Запитання для оцінювання
Фізика. Запитання для оцінювання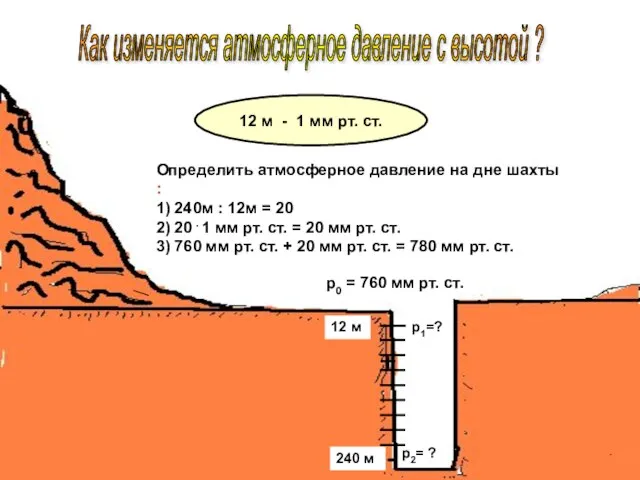 Презентация по физике "Как изменяется атмосферное давление с высотой ?" -
Презентация по физике "Как изменяется атмосферное давление с высотой ?" -  Классификация связей в динамике
Классификация связей в динамике Ядерное оружие
Ядерное оружие Закон Ома для участка цепи. Сопротивление. Последовательное и параллельное соединение проводников
Закон Ома для участка цепи. Сопротивление. Последовательное и параллельное соединение проводников Электромагнитная природа света
Электромагнитная природа света Физическая викторина. Игра
Физическая викторина. Игра