Содержание
- 2. НУЛЕВОЕ НАЧАЛО ТЕРМОДИНАМИКИ Нулевое начало термодинамики сформулированное всего около 50 лет назад , по существу представляет
- 3. Первое закон термодинамики Первый закон термодинамика – это закон сохранения энергии, распространенный на тепловые явления. Он
- 4. Невозможность создания вечного двигателя Задолго до открытия закона сохранения энергии Французская Академия наук приняла в 1775г.
- 5. Применение I закона к изопроцессам 1) T=const – изотермический δT=0 Q=A’ δU=0 2) P=const – изобарный
- 6. Второй закон термодинамики Второй закон термодинамики указывает направление возможных энергетических превращений и тем самым выражает необратимость
- 7. И Людвиг Больцман выдвинул спасительную теорию, что Вселенную необходимо рассматривать в целом, поскольку процессы, происходящие в
- 8. Второй закон термодинамики постулирует существование функции состояния , называемой «энтропией» ( что означает от греческого «эволюция»
- 9. Третий закон термодинамики Открытие третьего начала термодинамики связано с нахождением химического средства - величины , характеризующих
- 11. Скачать презентацию
Слайд 2НУЛЕВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Нулевое начало термодинамики сформулированное всего около 50 лет
НУЛЕВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Нулевое начало термодинамики сформулированное всего около 50 лет

Слайд 3 Первое закон термодинамики
Первый закон термодинамика – это закон сохранения
Первое закон термодинамики
Первый закон термодинамика – это закон сохранения

Часто вместо работы А внешних тел над системой рассматривают работу А` системы над внешними телами. Учитываю, что А`= -А, первый закон термодинамики в в форме δU = A+Q можно переписать так: Q=δU+A`
Суть первого закона в утверждении: изменение так определенной энергии не зависит от процесса и определяется только начальным и конечным состояниями системы. Это означает, что внутренняя энергия – однозначная функция состояние системы и в замкнутой системе сохраняется.
Слайд 4Невозможность создания вечного двигателя
Задолго до открытия закона сохранения энергии Французская Академия наук
Невозможность создания вечного двигателя
Задолго до открытия закона сохранения энергии Французская Академия наук

Под вечным двигателем первого рода понимают устройство, которое могло бы совершать неограниченное количество работы без затраты топлива или каких-либо других материалов.
Вечные двигатели обычно конструируют на основе использования следующих приёмов или их комбинаций:
1) Подъем воды с помощью архимедова винта;
2) Подъем воды с помощью капилляров;
3) Использование колеса с неуравновешивающимися грузами;
4) Природные магниты;
5) Электромагнетизм;
6) Пар или сжатый воздух.
Слайд 5Применение I закона к изопроцессам
1) T=const – изотермический
δT=0
Q=A’
δU=0
2)
Применение I закона к изопроцессам
1) T=const – изотермический
δT=0
Q=A’
δU=0
2)
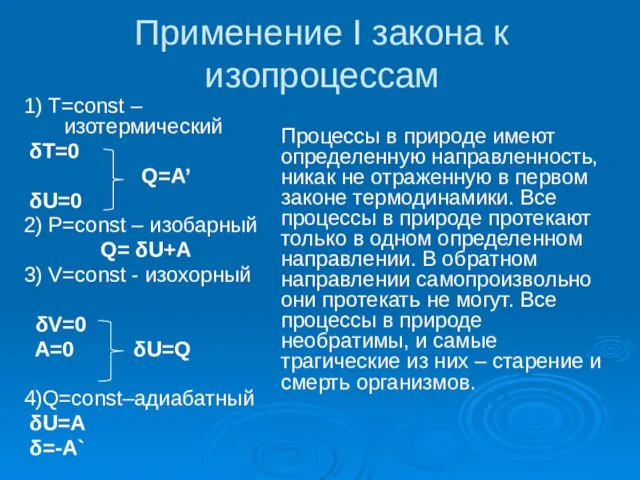
Q= δU+A
3) V=const - изохорный
δV=0
A=0 δU=Q
4)Q=const–адиабатный
δU=A
δ=-A`
Процессы в природе имеют определенную направленность, никак не отраженную в первом законе термодинамики. Все процессы в природе протекают только в одном определенном направлении. В обратном направлении самопроизвольно они протекать не могут. Все процессы в природе необратимы, и самые трагические из них – старение и смерть организмов.
Слайд 6Второй закон термодинамики
Второй закон термодинамики указывает направление возможных энергетических превращений и тем
Второй закон термодинамики
Второй закон термодинамики указывает направление возможных энергетических превращений и тем

Немецкий ученный Р. Клаузиус сформулировал этот закон так: невозможно перевести тепло от более холодной системы к более горячей при отсутствии одновременных изменений в обеих системах или окружающих телах.
Другая формулировка принадлежит английскому ученому У. Кельвину: невозможно осуществить такой периодический процесс, единственным результатом которого было бы получение работы за счет теплоты, взятой от одного источника.
Согласно 2 началу все процессы природы идут в оду сторону, к увеличению беспорядка, уменьшению энергии, а при “полном беспорядке” – напишет Клаузиус – наступит всеобщая смерть – всякое движение прекратится. Это грустный прогноз вызвал бурю возражений.
Слайд 7И Людвиг Больцман выдвинул спасительную теорию, что Вселенную необходимо рассматривать в целом,

Слайд 8Второй закон термодинамики постулирует существование функции состояния , называемой «энтропией» ( что
Второй закон термодинамики постулирует существование функции состояния , называемой «энтропией» ( что

1) Энтропия системы является экстенсивным свойством . Если система состоит из нескольких частей , то полная энтропия системы равна сумме энтропии каждой части .
Изменение энтропии S состоит из двух частей . Обозначим через δS поток энтропии, обусловленный взаимодействием с окружающей средой , а через δS - часть энтропии , обусловленную изменениями внутри системы , имеем δS = δS1 + δS2
Приращение энтропии δS обусловленное изменением внутри системы, никогда не имеет отрицательное значение . Величина δS = 0 , только тогда , когда система претерпевает обратимые изменения , но она всегда положительна , если в системе идут такие же необратимые процессы.
Таким образом:
δS = 0 ( обратимые процессы );
δS > 0( необратимые процессы );
Для изолированной системы поток энтропии равен нулю и выражения обратимого процесса и необратимого процесса сводятся к следующему виду : δS1 = δS > 0 ( изолированная система ).
Слайд 9Третий закон термодинамики
Открытие третьего начала термодинамики связано с нахождением химического средства -
Третий закон термодинамики
Открытие третьего начала термодинамики связано с нахождением химического средства -

 Источники света
Источники света Плотность вещества
Плотность вещества Закон Ома и удельное сопротивление проводника. Решение задач
Закон Ома и удельное сопротивление проводника. Решение задач Законы геометрической оптики
Законы геометрической оптики Бесконтактная передача электроэнергии
Бесконтактная передача электроэнергии Механічна робота. Потужність
Механічна робота. Потужність Античастица, антивещество и антимир
Античастица, антивещество и антимир Особенности нанообъектов
Особенности нанообъектов Построение и исследование физических моделей в Delphi 7
Построение и исследование физических моделей в Delphi 7 Методы регистрации заряженных частиц
Методы регистрации заряженных частиц Магнитное поле электрического тока
Магнитное поле электрического тока Работа силы тяжести
Работа силы тяжести Система охлаждения
Система охлаждения Закон Ома. Розв’язування задач
Закон Ома. Розв’язування задач Силы в природе
Силы в природе Строение атома
Строение атома מה השעה?
מה השעה? Презентация на тему ПРОБЛЕМНОЕ ОБУЧЕНИЕ на уроках ФИЗИКИ
Презентация на тему ПРОБЛЕМНОЕ ОБУЧЕНИЕ на уроках ФИЗИКИ  Основные понятия кинематики. Простейшие движения твердого тела
Основные понятия кинематики. Простейшие движения твердого тела Стандартные и фотометрические источники света
Стандартные и фотометрические источники света Эксплуатация газокомпрессорных станций. Магнитный подвес ротора центробежного нагнетателя
Эксплуатация газокомпрессорных станций. Магнитный подвес ротора центробежного нагнетателя Презентация на тему Виды спектров
Презентация на тему Виды спектров  Воздухораспределитель №242
Воздухораспределитель №242 Электрические цепи постоянного тока
Электрические цепи постоянного тока Дынамiка i яе асноуная задача. Сiла
Дынамiка i яе асноуная задача. Сiла Классификация нагрузок
Классификация нагрузок Колебания. Виды колебаний
Колебания. Виды колебаний Отражение света
Отражение света