Содержание
- 2. Ученые исследует то, что существует вокруг, инженеры создают то, чего никогда не было. Мы живем в
- 3. Перенос идей в промышленные технологии Основная проблема – масштабный переход ПАХТ (Chemical Engineering)
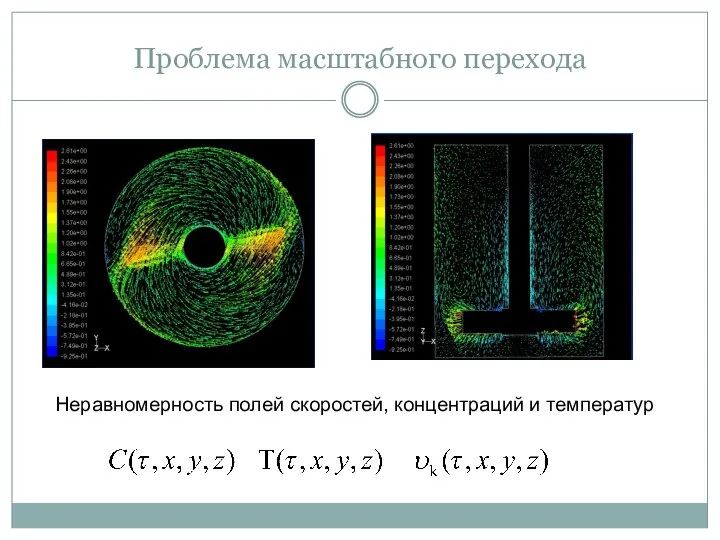
- 4. Проблема масштабного перехода Неравномерность полей скоростей, концентраций и температур
- 5. Задачи 1 Проектные – требуется подобрать и рассчитать основные размеры аппарата по заданным характеристикам входных и
- 6. ИСТОРИЯ ВОЗНИКНОВЕНИЯ ПАХТ В Российской империи первопроходцем в этой области стал Ф. А. Денисов, высказавший идею
- 7. ИСТОРИЯ ВОЗНИКНОВЕНИЯ ПАХТ Техническая школа г. Манчестер (Англия) 1901г. США в 1931 г. издан учебник В.
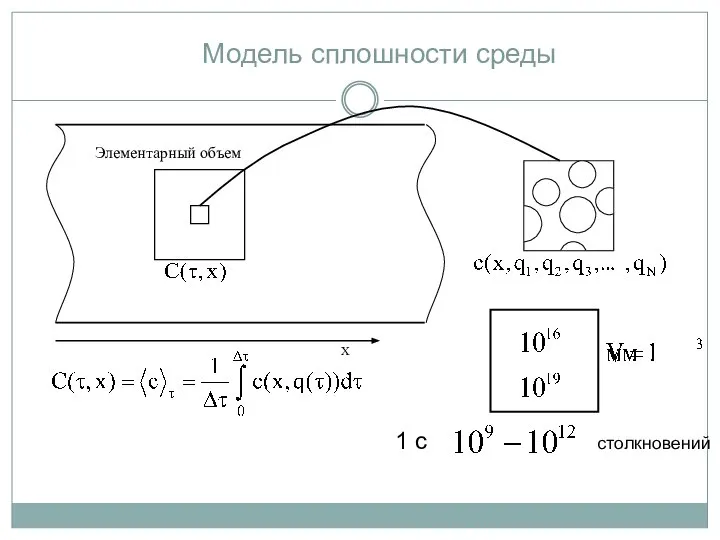
- 8. Модель сплошности среды 1 с столкновений Элементарный объем
- 9. Число параметров необходимых для однозначного задания состояния системы определяется правилом фаз Гиббса: С=К-Ф+2 Состояние системы задается
- 10. Под процессом понимается последовательная смена состояний системы. Для проведения процесса необходимо вывести систему из состояния равновесия,
- 11. Процессы Процессы могут подразделяться не только по виду переносимой субстанции, определяющей скорость их протекания, но и
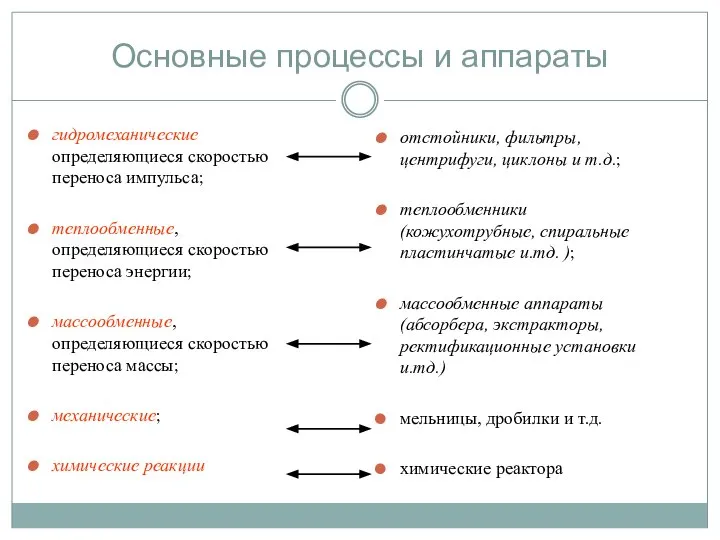
- 12. Основные процессы и аппараты гидромеханические определяющиеся скоростью переноса импульса; теплообменные, определяющиеся скоростью переноса энергии; массообменные, определяющиеся
- 13. Теоретические основы химической технологии Законы сохранения Законы термодинамики 3. Явления переноса и химическая кинетика
- 14. Второе начала термодинамики соотношение Гиббса-Дюгема: , При Р=const и T=const - свободная энергия; - энергия Гиббса;
- 15. Условия равновесия Многофазная система Однофазная система Т=const ; P=const Тепловое равновесие Механическое равновесие Концентрационное (химическое) равновесие
- 16. Химический потенциал Идеальный газ Условия фазового равновесия Справедливо при любом выборе нулевого состояния Реальный газ
- 17. Химический потенциал Переменные P, T, x Переменные V, T, x Чистый компонент Чистый компонент Для расчета
- 18. Химический потенциал
- 19. Химический потенциал - активность - Фугитивность стандартного состояния чистый компонент i при заданных Т и Р
- 21. Скачать презентацию















 Выполнение КП
Выполнение КП Механические колебания. Физика. 9 класс
Механические колебания. Физика. 9 класс Программа расчета и проведение компьютерного моделирования прохождения электронов через многобарьерную потенциальную структуру
Программа расчета и проведение компьютерного моделирования прохождения электронов через многобарьерную потенциальную структуру Маховик
Маховик Постоянные магниты. Магнитное поле Земли
Постоянные магниты. Магнитное поле Земли Абсорбционная спектроскопия (поглощение света веществом)
Абсорбционная спектроскопия (поглощение света веществом) ГБОУ ЦО № 1631 Проектная работа «Чай из самовара» Выполнила: Антипова Я. Г., ученица 8 «А» класса Руководитель: Кор
ГБОУ ЦО № 1631 Проектная работа «Чай из самовара» Выполнила: Антипова Я. Г., ученица 8 «А» класса Руководитель: Кор Элементы специальной теории относительности
Элементы специальной теории относительности Интерпретация спектральной классификации. (Тема 18)
Интерпретация спектральной классификации. (Тема 18) Часы. Приборы и методы измерения (по видам измерений)
Часы. Приборы и методы измерения (по видам измерений) Электролиз. Удивительный мир гальваники
Электролиз. Удивительный мир гальваники Гёте и Ньютон: спор о цвете
Гёте и Ньютон: спор о цвете Ферриты
Ферриты ФОМНЭ_2022_Лекция № 2
ФОМНЭ_2022_Лекция № 2 Строение атома
Строение атома Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения. Ядерная реакция
Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения. Ядерная реакция Давление твердых тел, жидкостей и газов
Давление твердых тел, жидкостей и газов Работа силы
Работа силы Консультация ГИА-9 по физике
Консультация ГИА-9 по физике Закон сохранения импульса
Закон сохранения импульса Расчёт пути и времени движения
Расчёт пути и времени движения Спектральный анализ
Спектральный анализ Эффекты квантования чисел в цифровых цепях
Эффекты квантования чисел в цифровых цепях Условие и расчет
Условие и расчет Задача по динамике
Задача по динамике Композиционные материалы на наноуровне
Композиционные материалы на наноуровне Бином Ньютона
Бином Ньютона Частицы вещества
Частицы вещества