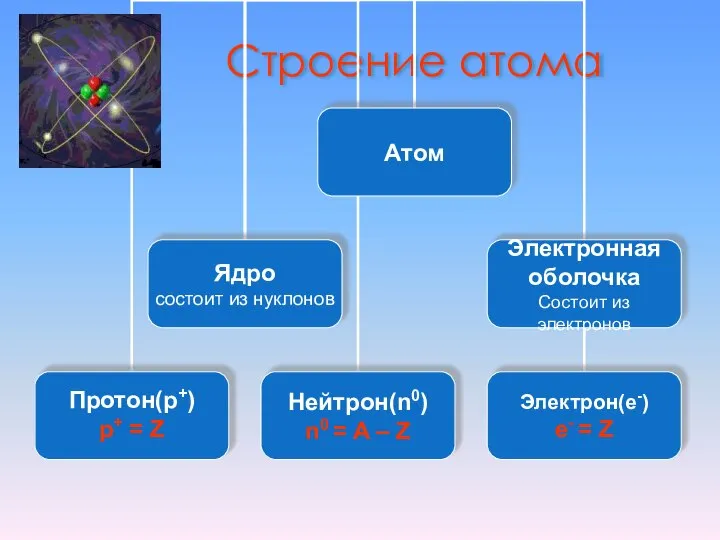
Слайд 2Молекула - наименьшая частица вещества, обладающая его химическими свойствами.
Атом - наименьшая частица химического элемента,

сохраняющая все его химические свойства
Слайд 3Первые представления о том, что вещество состоит из отдельных неделимых частиц, появились

в глубокой древности.
Атомизм - теория, согласно которой чувственно воспринимаемые (материальные) вещи состоят из химически неделимых частиц - атомов. Возникла в древнегреческой философии
Слайд 5Официально утверждено в 1860 году на международном съезде химиков

Слайд 7Долгое время господствовало мнение, что атомы неделимы. Однако в конце 19 века

был установлен ряд факторов, свидетельствующих о сложном составе атомов. Например, английский физик Джон Томсон в 1897 году открыл электрон, установил, что электроны содержатся во всех атомах, имеют отрицательный заряд, но в целом атом электронейтрален. Значит в атоме должны содержаться ещё и положительные частицы. Эти частицы и электрон назвали элементарными
Слайд 9Сумма масс протонов и нейтронов называется массовым числом атома (ядра) и выражает

его атомную массу:
p+ + n0 = А
n0 = А - p+
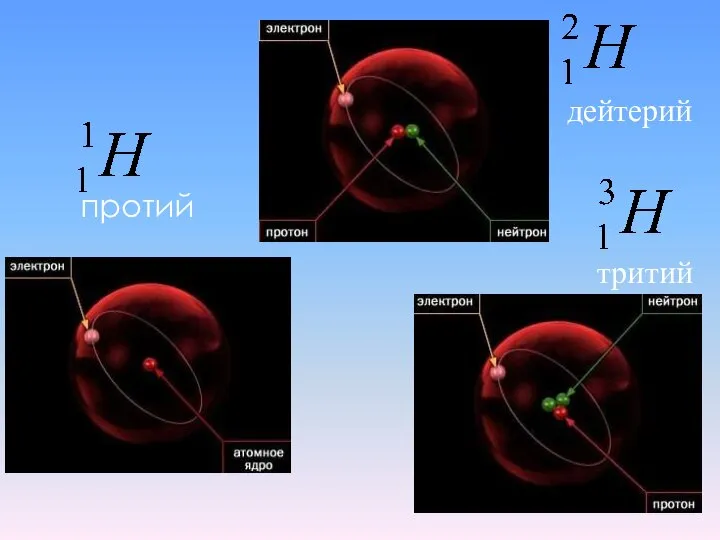
Слайд 10Изотопы - атомы одного и того же элемента с разной массой. Ядра

этих атомов содержат одинаковое число протонов, но разное число нейтронов. Поэтому в Периодической системе Д.И. Менделеева дана средняя арифметическая масса всех природных изотопов с учётом их распространения в природе (дробное число в Периодической системе). Например, встречаются атомы хлора с массой 35 и 37. У водорода изотопы носят индивидуальные названия: 1Н - легкий водород, 2Н - дейтерий (D), 3Н - тритий (Т)
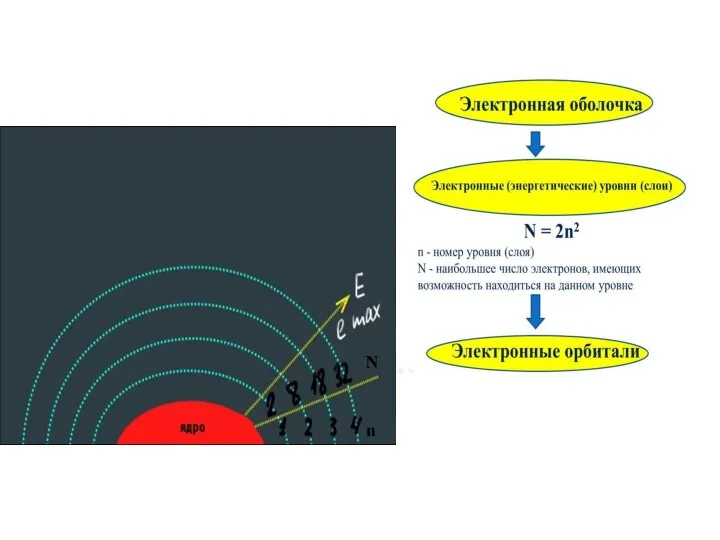
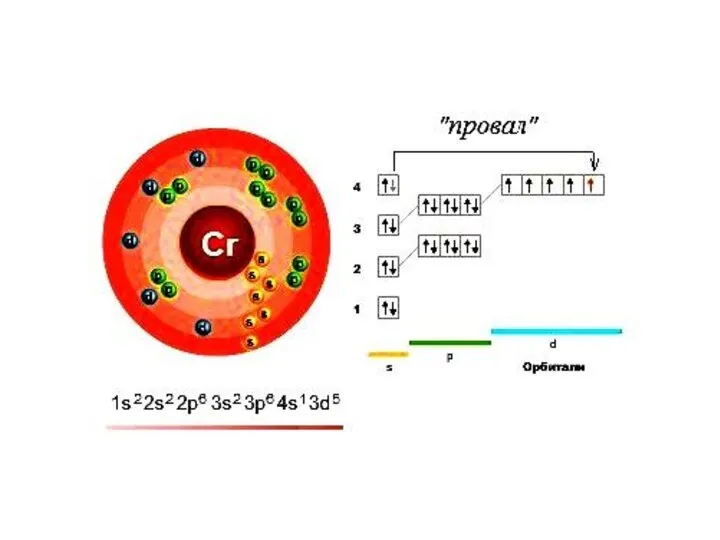
Слайд 14Электронная оболочка атома распадается на несколько энергетических уровней (слоёв). Электроны каждого следующего

слоя находятся на более высоком энергетическом уровне, чем электроны предыдущего слоя. Наибольшее число электронов N, имеющих возможность находиться на данном энергетическом уровне, равно удвоенному квадрату номера уровня:
N = 2n2 , где n - номер уровня (слоя).
Число электронов в наружном слое для всех элементов, кроме палладия, не превышает восьми, а в предпоследнем - восемнадцати.
Электронные уровни, в свою очередь, распадаются на электронные орбитали - область наиболее вероятного местонахождения электрона в пространстве
Слайд 15Электронные орбитали в основном состоянии бывают четырёх типов: s, p, d и
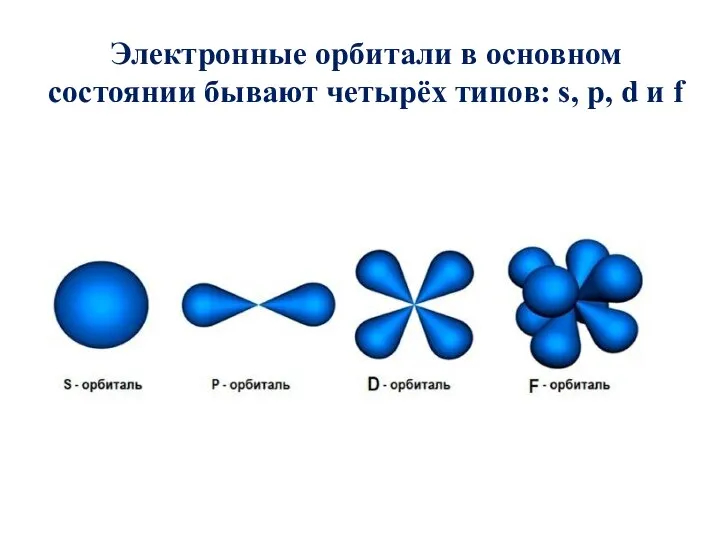
f
Слайд 18Порядковый номер в Периодической системе Д.И. Менделеева - важнейшая константа элемента, выражающая:
а)

общее количество электронов в атоме;
б) заряд атомного ядра;
в) число протонов в ядре.
Номер периода химического элемента в Периодической системе Д.И. Менделеева указывает на число энергетических уровней. Номер группы указывает на число электронов на внешнем энергетическом уровне
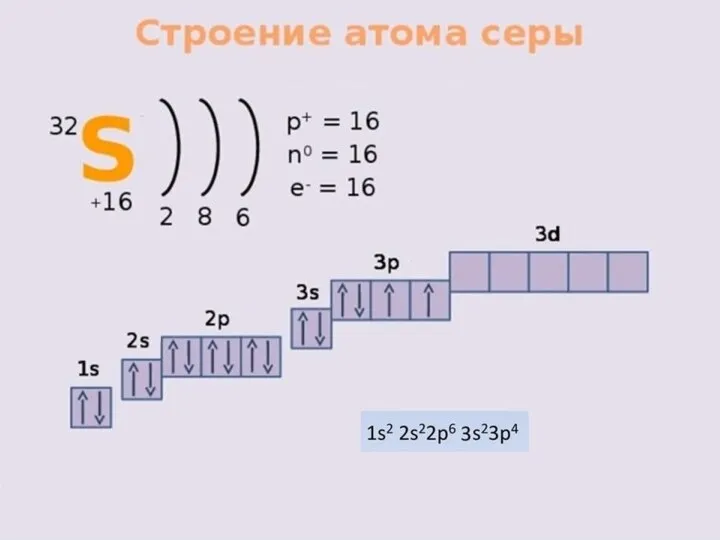
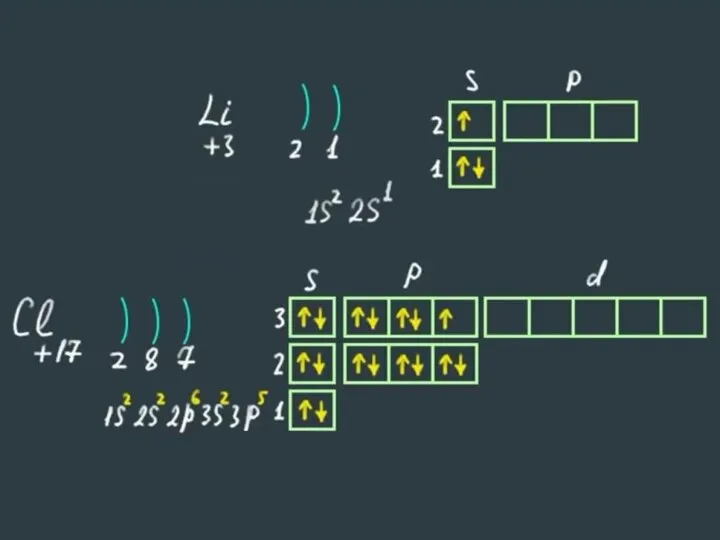
Слайд 19Алгоритм составления электронных формул строения атомов
Записываем знак химического элемента и заряд ядра

его атома (№ элемента).
Определяем количество энергетических уровней (№ периода) и количество электронов на каждом уровне.
Составляем электронную формулу, учитывая номер уровня, вид орбитали и количество электронов на ней
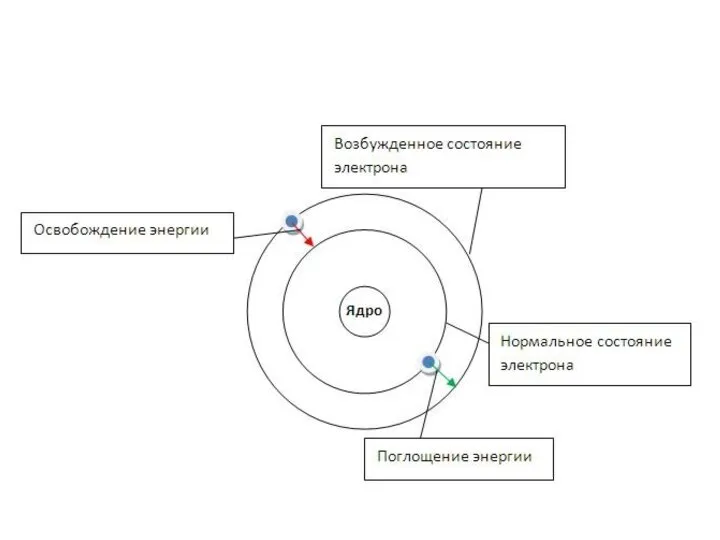
Слайд 23Состояния атомов
Атомы устойчивы лишь в некоторых стационарных состояниях, которым отвечают определенные значения

энергии.
Наинизшее из разрешённых энергетических состояний атома называется основным, а все остальные - возбуждёнными.
Возбужденные состояния атомов образуются из основного состояния при переходе одного или нескольких электронов с занятых орбиталей на свободные (или занятые лишь 1 электроном)
Слайд 25От того, какой энергетический подуровень заполняется электронами последним, различают 4 электронных семейства
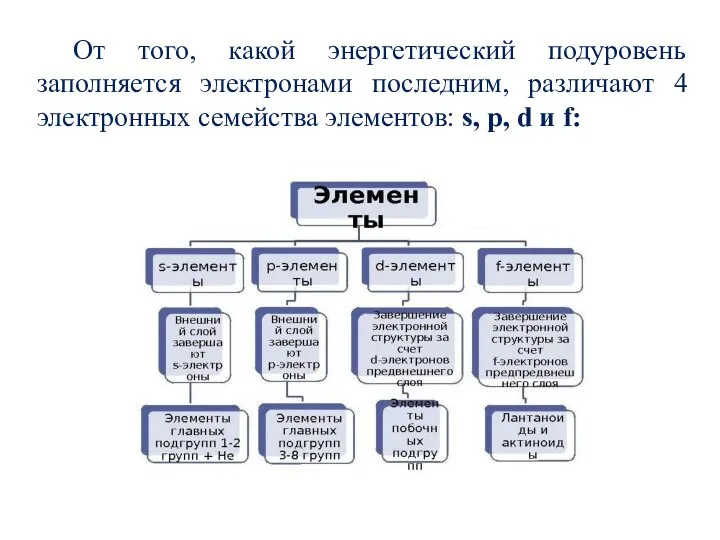
элементов: s, p, d и f:



















 Реостаты
Реостаты Сила. Динамометр
Сила. Динамометр Модель атома Томсона. Модель атома Резерфорда. Атомные спектры. Лекция 12
Модель атома Томсона. Модель атома Резерфорда. Атомные спектры. Лекция 12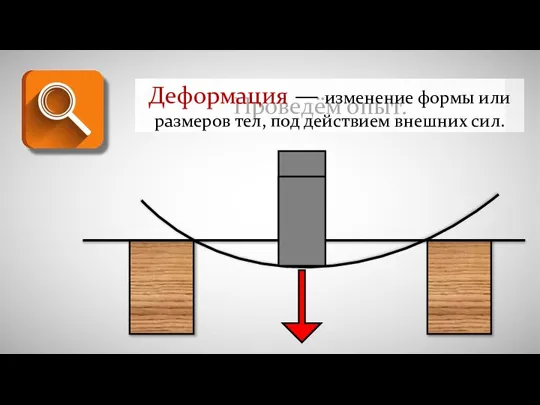 Деформация - изменение формы или размеров тел под действием внешних сил
Деформация - изменение формы или размеров тел под действием внешних сил Конструкция реактора РБМК–1000
Конструкция реактора РБМК–1000 Теория производства
Теория производства Силы в механике
Силы в механике Приёмосдаточные испытания схемы электропроводки жилого помещения
Приёмосдаточные испытания схемы электропроводки жилого помещения Физические основы микроэлектроники. Радиоматериалы и радиокомпоненты
Физические основы микроэлектроники. Радиоматериалы и радиокомпоненты Рівновага складеної системи сил
Рівновага складеної системи сил Теоретическая механика. Задачи
Теоретическая механика. Задачи Основи міцності і пластичності
Основи міцності і пластичності Научный прогресс и его влияние на здоровье человека
Научный прогресс и его влияние на здоровье человека Электрический ток в различных средах
Электрический ток в различных средах Пробка клапана. Дефект
Пробка клапана. Дефект Исследование процессов неупругих столкновений
Исследование процессов неупругих столкновений Теоретическая механика. Модуль 1. Раздел 1 – статика
Теоретическая механика. Модуль 1. Раздел 1 – статика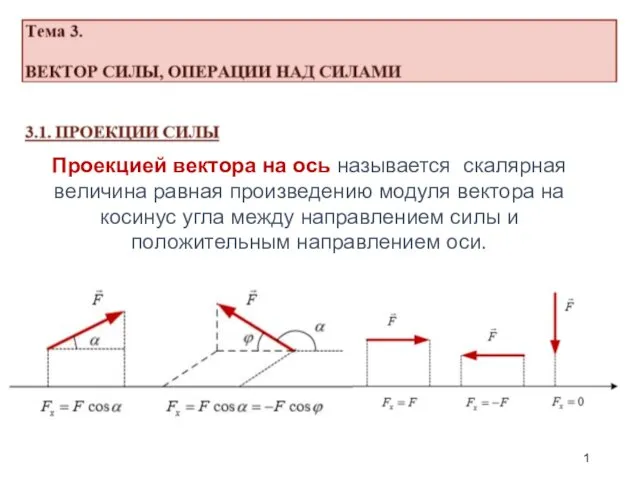 Вектор силы, операции над силами
Вектор силы, операции над силами Введение. Тест
Введение. Тест Alessandro Volta (1745-1827)
Alessandro Volta (1745-1827) Электрическое освещение бытовых и промышленных объектов
Электрическое освещение бытовых и промышленных объектов Ядерный реактор. Ядерная энергетика. Экологические проблемы работы атомных электростанций
Ядерный реактор. Ядерная энергетика. Экологические проблемы работы атомных электростанций Формирование экспериментального метода решения задач на уроках физики
Формирование экспериментального метода решения задач на уроках физики Закон Ома. Сопротивление проводника. Решение задач
Закон Ома. Сопротивление проводника. Решение задач Презентация на тему Активные фильтры
Презентация на тему Активные фильтры  Момент силы
Момент силы Сила. Масса. Законы Ньютона 9 класс
Сила. Масса. Законы Ньютона 9 класс