Содержание
- 2. ТЕПЛОВОЕ РАВНОВЕСИЕ. Макроскопические параметры – давление (Р), объем (V), температура (Т). Любое макроскопическое тело или группа
- 3. ТЕМПЕРАТУРА. ПРИДУМАЙТЕ СПОСОБ ИЗГОТОВЛЕНИЯ ТЕРМОМЕТРА Температура характеризует состояние теплового равновесия системы тел: все тела системы, находящиеся
- 4. СРЕДНЯЯ КИНЕТИЧЕСКАЯ ЭНЕРГИЯ МОЛЕКУЛ ГАЗА ПРИ ТЕПЛОВОМ РАВНОВЕСИИ. Подставим в это уравнение выражение для концентрации молекул
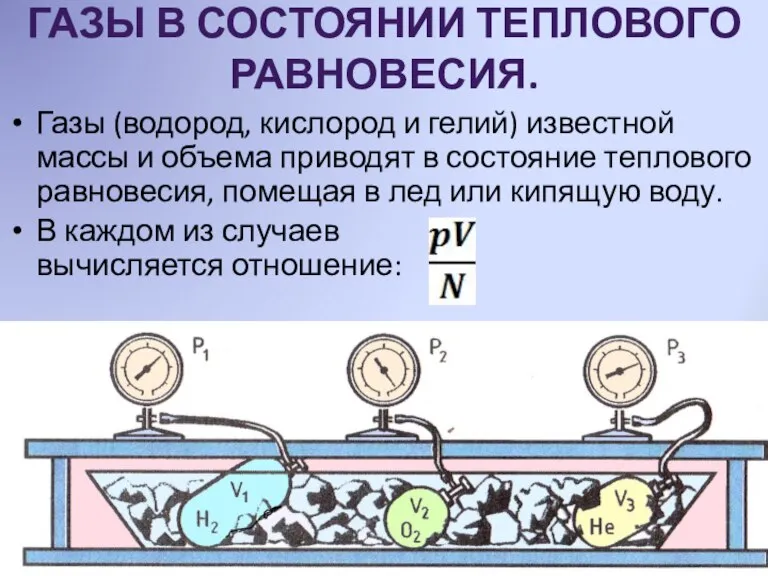
- 5. ГАЗЫ В СОСТОЯНИИ ТЕПЛОВОГО РАВНОВЕСИЯ. Газы (водород, кислород и гелий) известной массы и объема приводят в
- 6. СРАВНЕНИЕ РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТА. При помещении газов в лед; Т=00 С получено значение, одинаковое для всех газов:
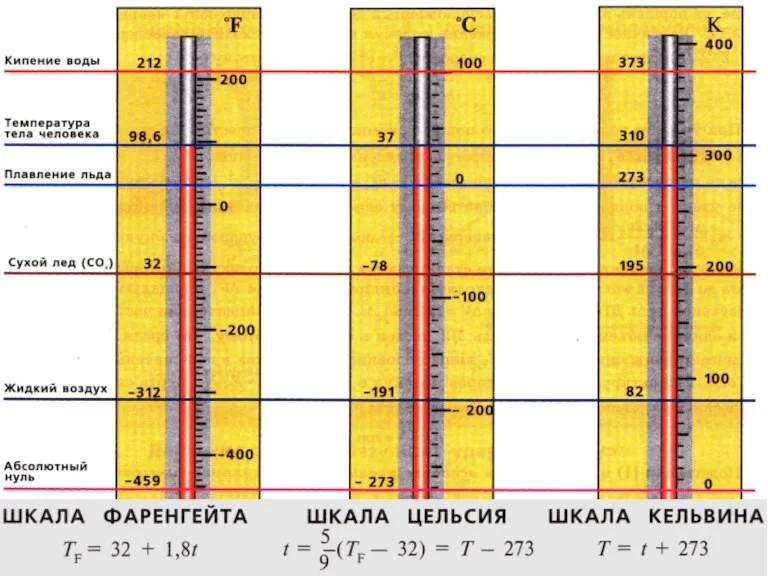
- 7. АБСОЛЮТНАЯ ТЕМПЕРАТУРА.
- 8. Перевод температуры из энергетических единиц Вместо температуры, выраженной в энергетических единицах, введем температуру, выражаемую в градусах,
- 9. АБСОЛЮТНЫЙ НУЛЬ ТЕМПЕРАТУР Предельную температуру, при которой давление идеального газа обращается в ноль при фиксированном объеме
- 11. ПОСТОЯННАЯ БОЛЬЦМАНА Зная значения температуры в энергетических единицах при 0 С и 100 С, можно вычислить
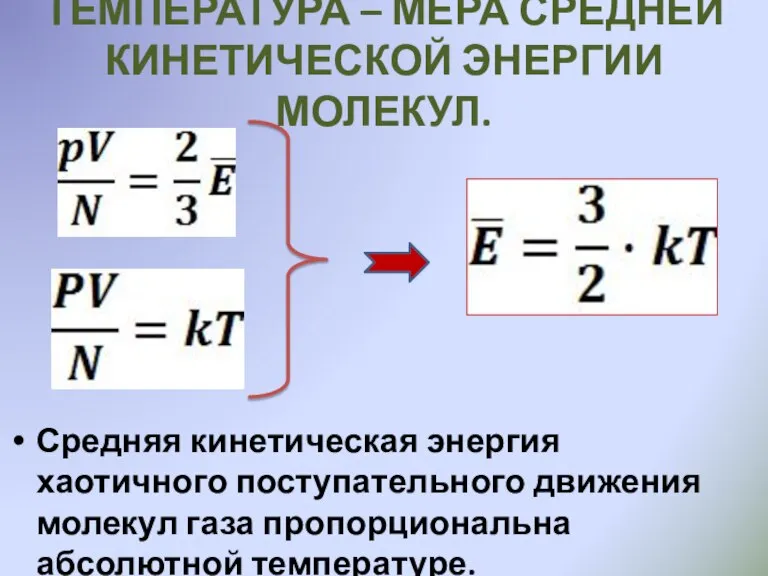
- 12. ТЕМПЕРАТУРА – МЕРА СРЕДНЕЙ КИНЕТИЧЕСКОЙ ЭНЕРГИИ МОЛЕКУЛ. Средняя кинетическая энергия хаотичного поступательного движения молекул газа пропорциональна
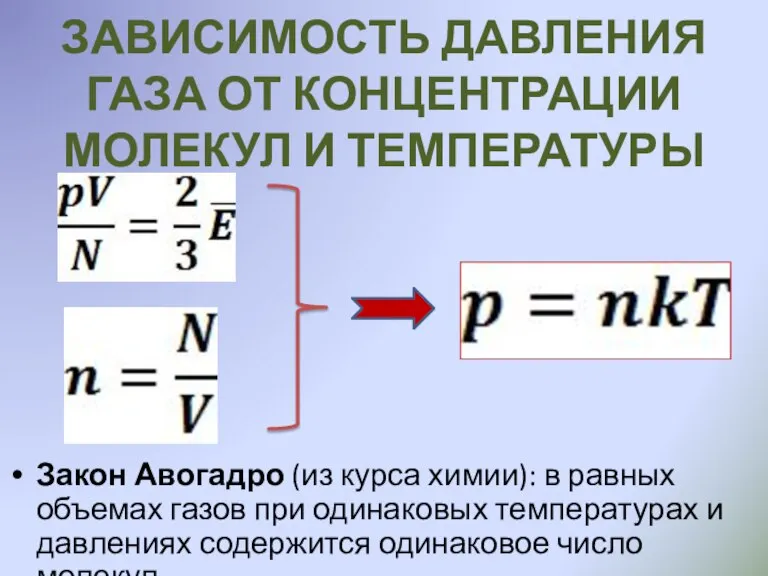
- 13. ЗАВИСИМОСТЬ ДАВЛЕНИЯ ГАЗА ОТ КОНЦЕНТРАЦИИ МОЛЕКУЛ И ТЕМПЕРАТУРЫ Закон Авогадро (из курса химии): в равных объемах
- 14. Закрепление материала: Какие величины характеризуют состояние макроскопических тел? Каковы отличительные признаки состояний теплового равновесия? Приведите примеры
- 15. РЕШЕНИЕ ЗАДАЧ повторение
- 16. ЗАДАЧИ 4, 5. Каково количество вещества, содержащееся в 1 г воды? Ответ: 0,06 моль Чему равно
- 17. ЗАДАЧИ 6, 7. Чему равна масса молекулы азота? m0=M/NА= 28∙10-3 кг/моль/ 6∙1023 ≈4,67∙10-26кг Определите число атомов
- 18. ЗАДАЧИ 8, 9. Плотность алмаза 3500 кг/м . Какой объем займут 10 атомов этого вещества? Ответ:
- 26. Скачать презентацию


















 Магнетизм. Структурно-логическая схема. Условные обозначения
Магнетизм. Структурно-логическая схема. Условные обозначения Газовые законы
Газовые законы Механика в молекулярной физике
Механика в молекулярной физике Колебания. Пример выполнения домашнего задания
Колебания. Пример выполнения домашнего задания Схеми аксіально-поршньового насосу. Билет 8
Схеми аксіально-поршньового насосу. Билет 8 Історія Електричної Лампи. Шаблон
Історія Електричної Лампи. Шаблон Термоядерный реактор. Безопасная энергия
Термоядерный реактор. Безопасная энергия Электроматериаловедение. Электротехнические материалы
Электроматериаловедение. Электротехнические материалы Жарықтың интерференциясын, дифракциясын және поляризациясын бақылау
Жарықтың интерференциясын, дифракциясын және поляризациясын бақылау Энергия - основа мироздания. Солнечные батареи
Энергия - основа мироздания. Солнечные батареи Презентация на тему Механические волны 9 класс
Презентация на тему Механические волны 9 класс  Стандартные и фотометрические источники света
Стандартные и фотометрические источники света Презентация на тему Воздействие тепловых двигателей на окружающую среду
Презентация на тему Воздействие тепловых двигателей на окружающую среду  Динамика. Лекция 2
Динамика. Лекция 2 Электростатика. Кроссворд
Электростатика. Кроссворд Обобщающий урок по механике (10 класс)
Обобщающий урок по механике (10 класс) Изучение движения тела по окружности под действием сил упругости и тяжести
Изучение движения тела по окружности под действием сил упругости и тяжести Осциллограф
Осциллограф Скорость витания
Скорость витания Вихрь (ротор) векторного поля
Вихрь (ротор) векторного поля Уравнение газа состояния идеального
Уравнение газа состояния идеального Организация участка по восстановлению коленчатых валов двигателя автомобиля ЗИЛ 5103 “Бычок” в ООО “Катран” в г. Смоленск
Организация участка по восстановлению коленчатых валов двигателя автомобиля ЗИЛ 5103 “Бычок” в ООО “Катран” в г. Смоленск Равнодействующая всех сил
Равнодействующая всех сил Тайна природы света. 11 класс
Тайна природы света. 11 класс Относительность движения
Относительность движения Теория линейных электрических цепей
Теория линейных электрических цепей Уничтожение полукруговой девиации магнитного компаса способом Эри
Уничтожение полукруговой девиации магнитного компаса способом Эри Закон сохранения энергии в механике
Закон сохранения энергии в механике