Содержание
- 2. Идеал газдың ішкі энергиясы Газдың ұлғаю жұмысы Термодинамиканың бірінші заңы Жылусыйымдылқ теориясы Карно циклы және оның
- 3. Идеал газдың ішкі энергиясы Идеал газдың ішкі энергиясы оның молекулаларының кинетикалық энергиясынан тұрады
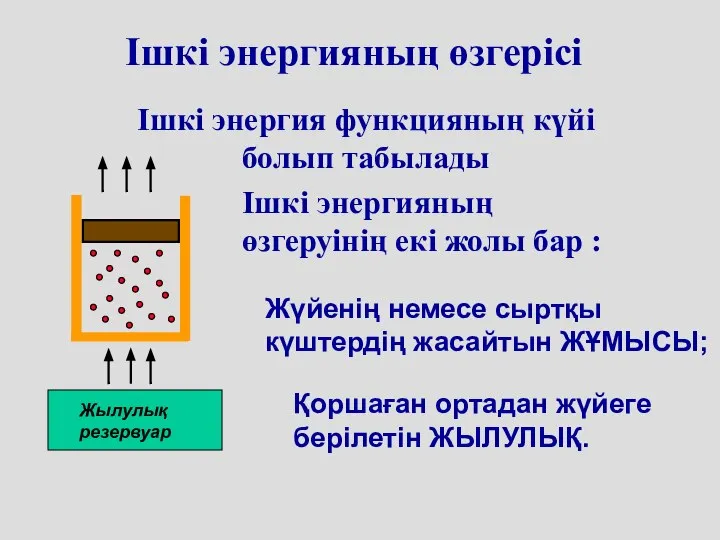
- 4. Ішкі энергияның өзгерісі Ішкі энергия функцияның күйі болып табылады Ішкі энергияның өзгеруінің екі жолы бар :
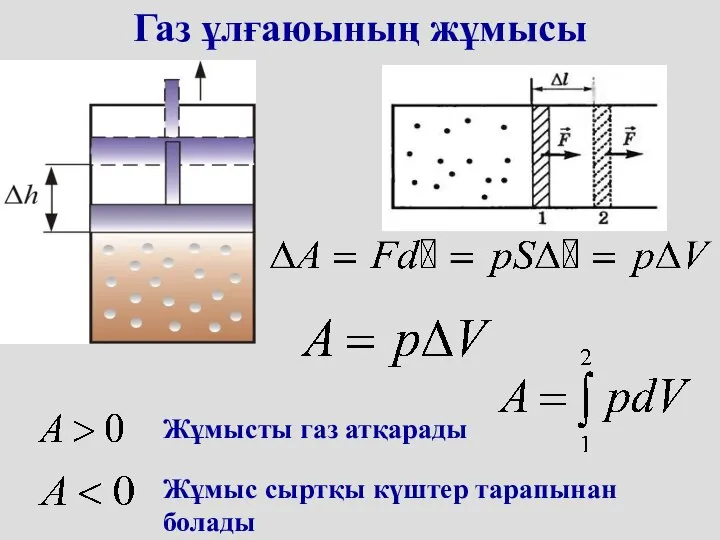
- 5. Газ ұлғаюының жұмысы Жұмысты газ атқарады Жұмыс сыртқы күштер тарапынан болады
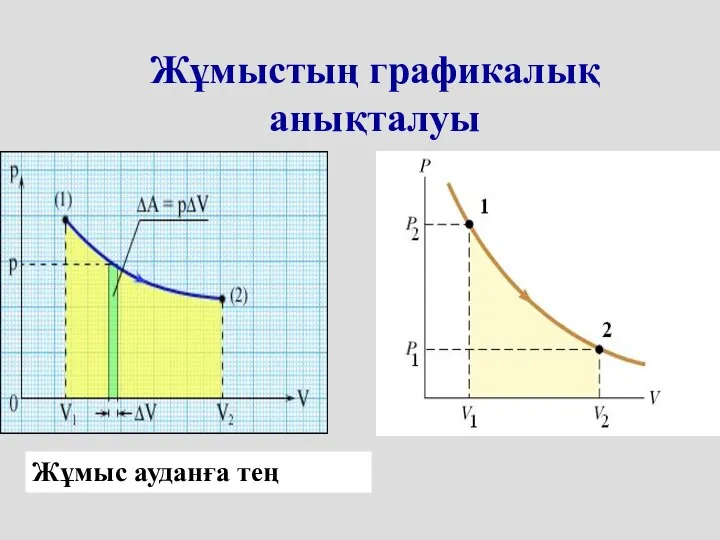
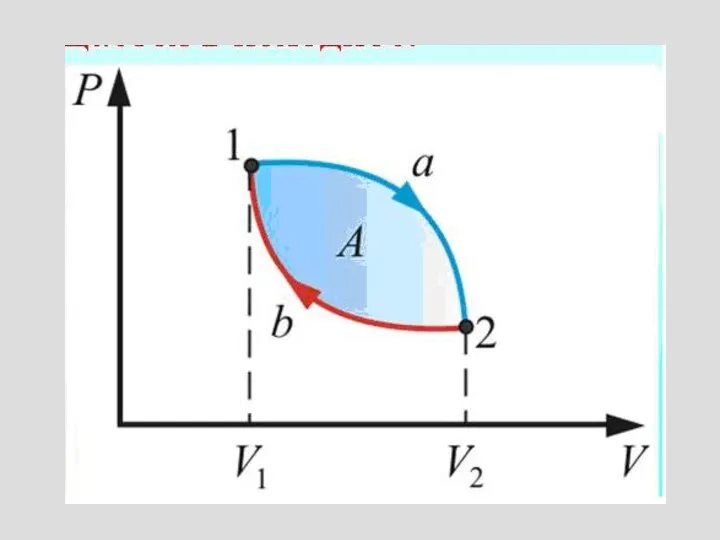
- 6. Жұмыстың графикалық анықталуы Жұмыс ауданға тең
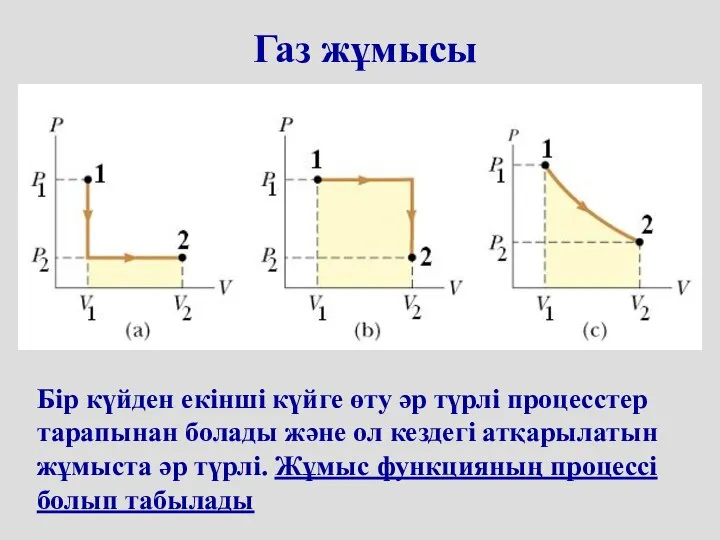
- 7. Бір күйден екінші күйге өту әр түрлі процесстер тарапынан болады және ол кездегі атқарылатын жұмыста әр
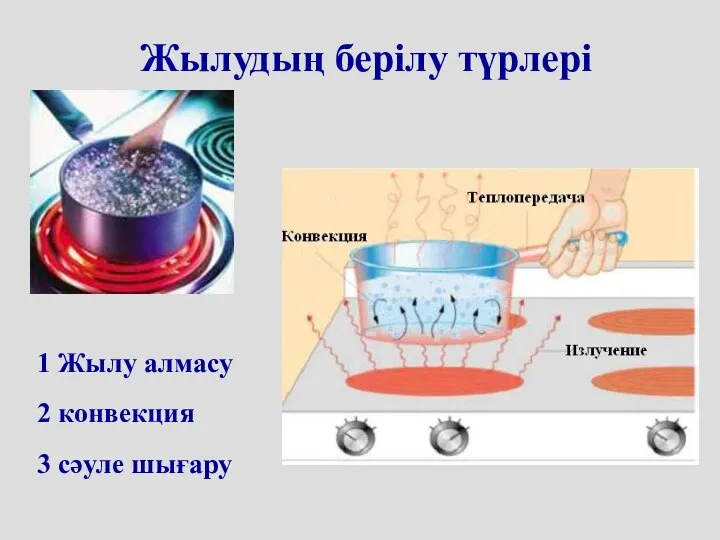
- 8. Жылудың берілу түрлері 1 Жылу алмасу 2 конвекция 3 сәуле шығару
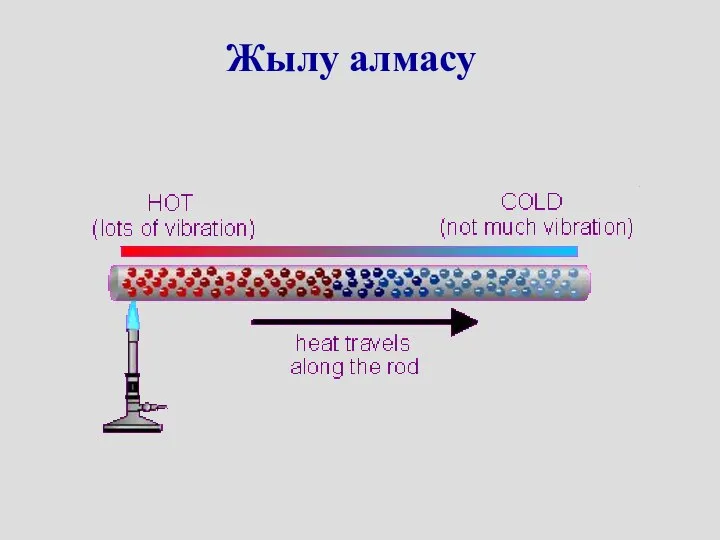
- 9. Жылу алмасу
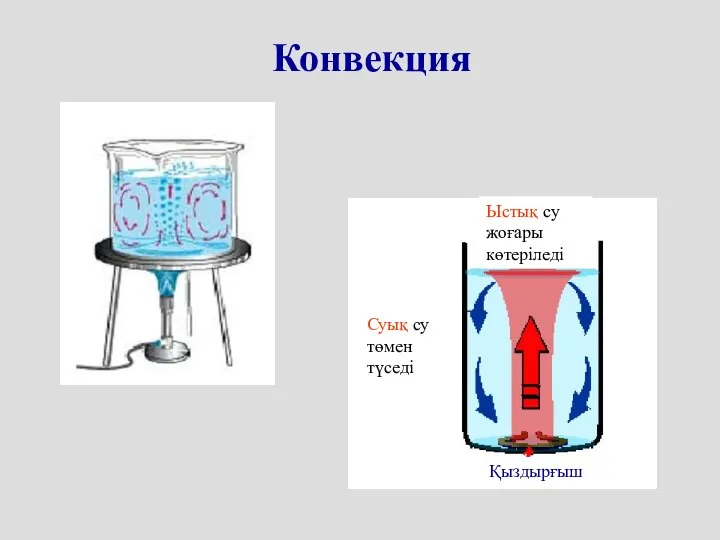
- 10. Конвекция Ыстық су жоғары көтеріледі Суық су төмен түседі Қыздырғыш
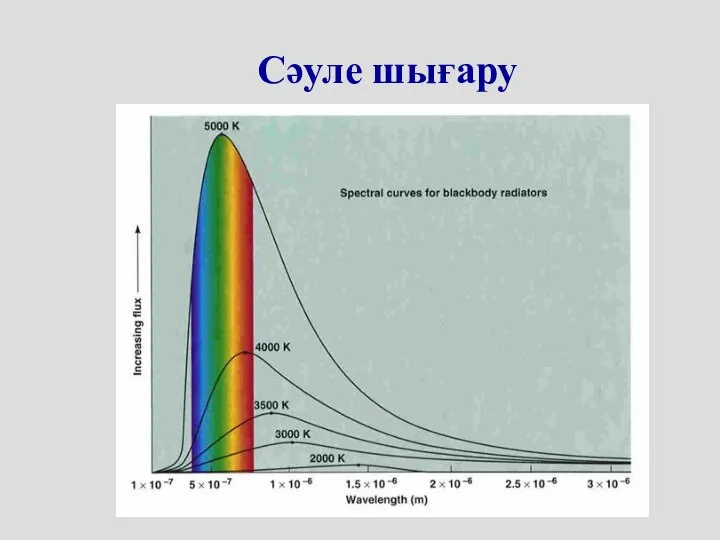
- 11. Сәуле шығару
- 13. Термодинамиканың бірінші заңы
- 14. Жылусыйымдылық Меншікті жылусыйымдылық Мольлық жылусыйымдылық
- 18. Жылусыйымдылық процесс түріне байланысты Тұрақты көлемдегі мольдық жылусыйымдылық Тұрақты қысымдығы мольдық жылусыйымдылық Мольдық жылусыйымдылық арасындағы байланыс
- 19. Изобаралық процесс
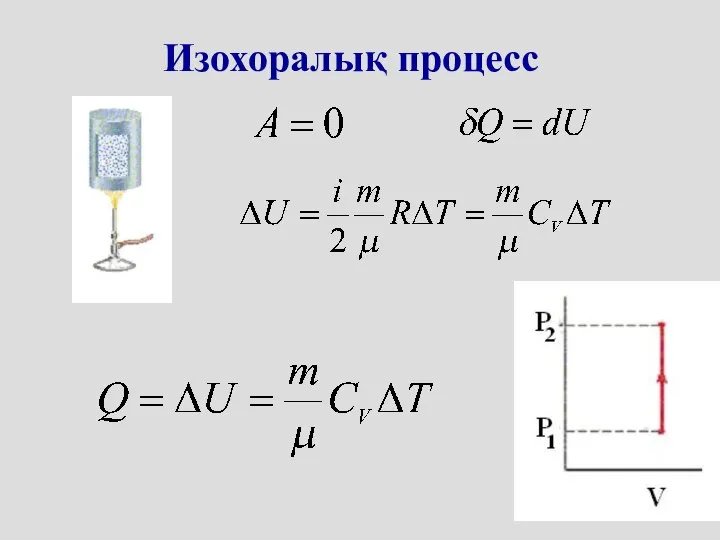
- 20. Изохоралық процесс
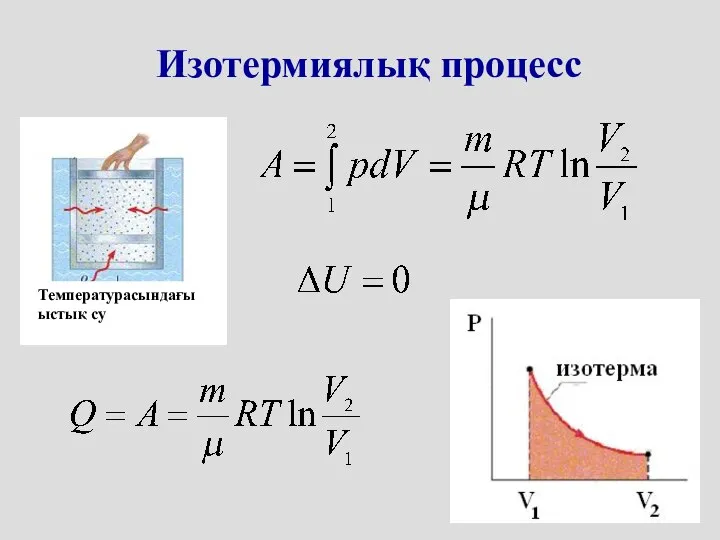
- 21. Изотермиялық процесс Температурасындағы ыстық су
- 22. Адиабаталық процесс Адиабаталық процесс кезінде қысымның ұлғаюы көлемнің кішіреуі мен температураның жоғарылауына тәуелді. Процесстің теңдеуі:
- 23. Энтропия қайтымды процесс үшін келтірілген жылу мөлшері Клаузиус өлшем енгізді, оны энтропия деп атады:
- 25. Энтропия Больцман энтропияны термодинамикалық ықтималдығымен байланыстырды : Энтропия жүйенің біркелкілік емес шамасы; үлкен энтропия үлкен хаосқа
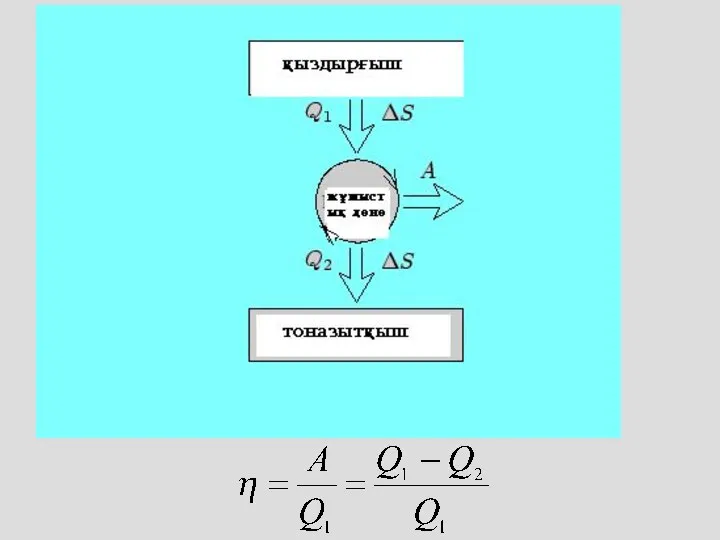
- 26. Термодинамиканың екінші бастамасы Суық денеден ыстық денеге жылу берілу мүмкін емес Бір рет қана берілген жылудың
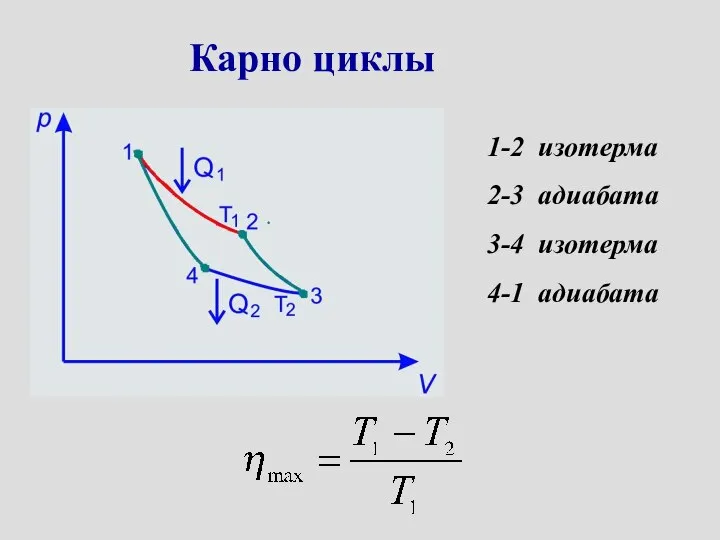
- 28. Карно циклы 1-2 изотерма 2-3 адиабата 3-4 изотерма 4-1 адиабата
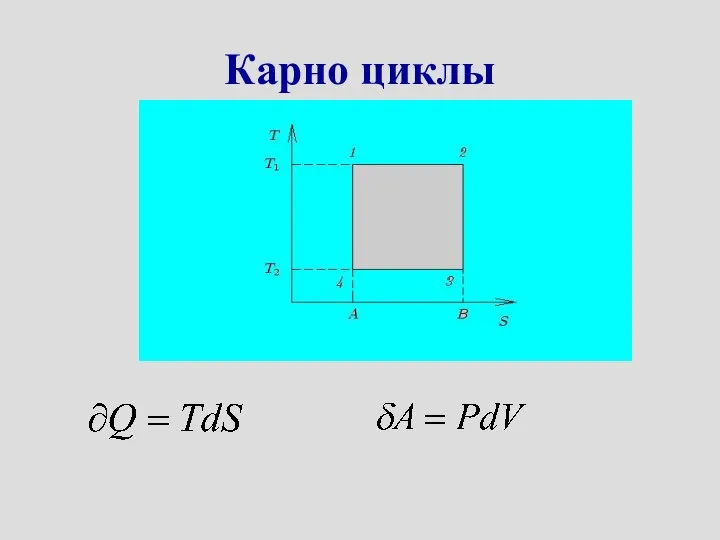
- 29. Карно циклы
- 31. ТАСЫМАЛДАУ ҚҰБЫЛЫСЫ. НАҚТЫ ГАЗДАР
- 32. Дәріс жоспары Эффективтік диаметр Тасымалдау құбылысы Молекуллрдың өзара әсерлесуі Ван-дер-Ваальс теңдеуі Ван-дер-Ваальс изотермасы Фазалық ауысу Күй
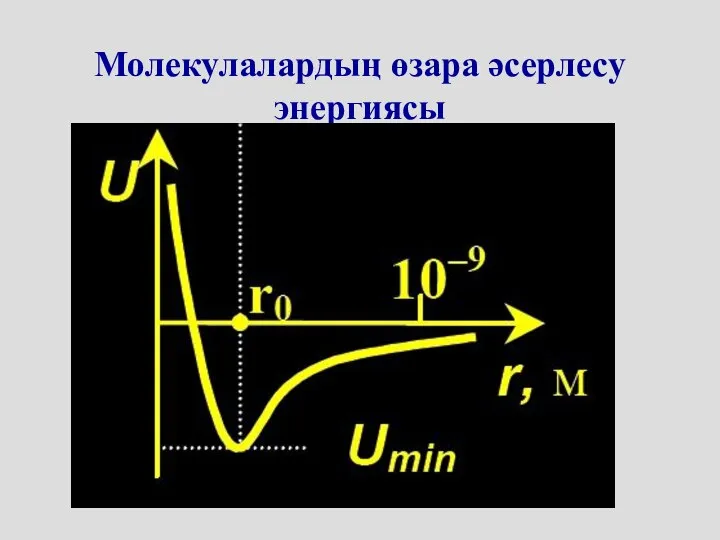
- 33. Молекулалардың өзара әсерлесу энергиясы
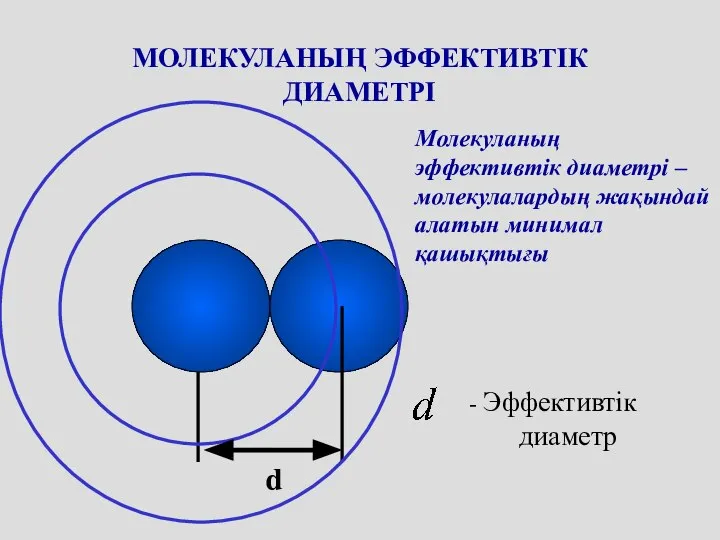
- 34. МОЛЕКУЛАНЫҢ ЭФФЕКТИВТІК ДИАМЕТРІ d Молекуланың эффективтік диаметрі – молекулалардың жақындай алатын минимал қашықтығы - Эффективтік диаметр
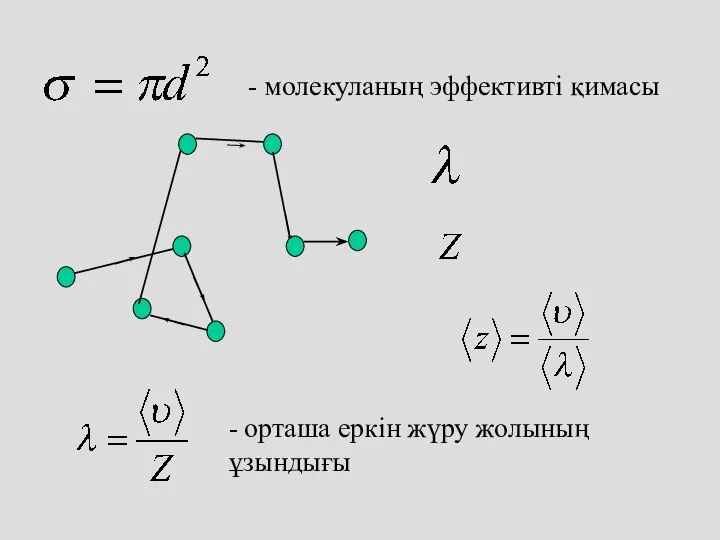
- 35. - молекуланың эффективті қимасы - орташа еркін жүру жолының ұзындығы
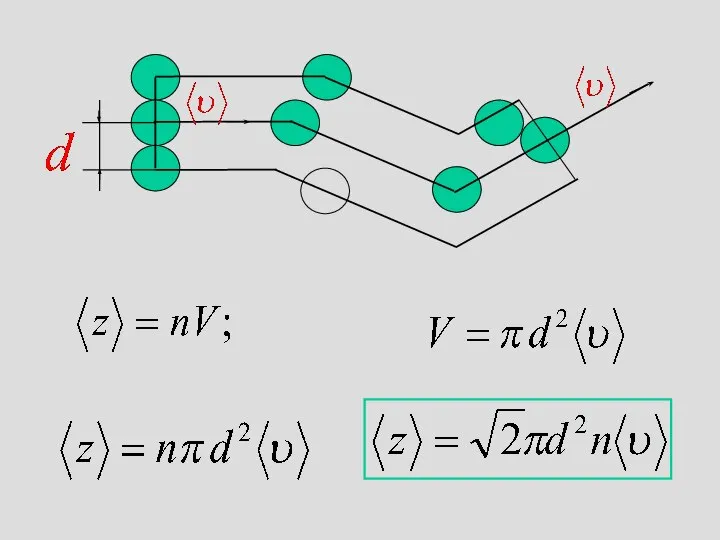
- 38. Орташа еркін жол ұзындығы
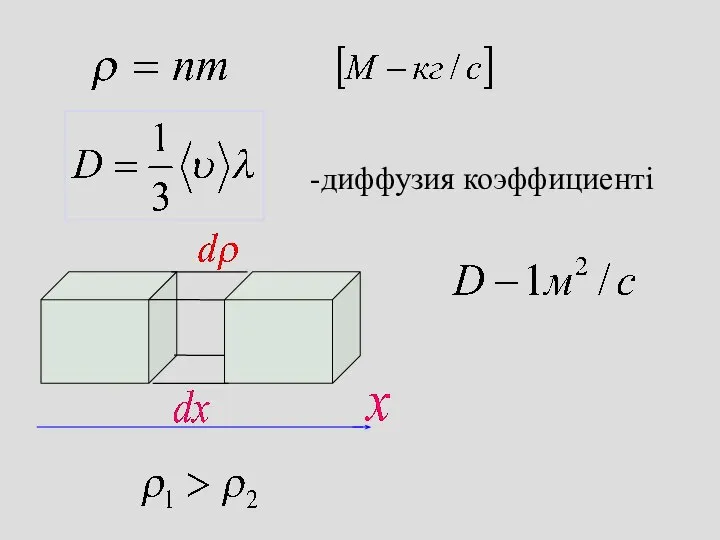
- 39. Тасымалдау құбылысы Диффузия Фик заңы
- 40. -диффузия коэффициенті
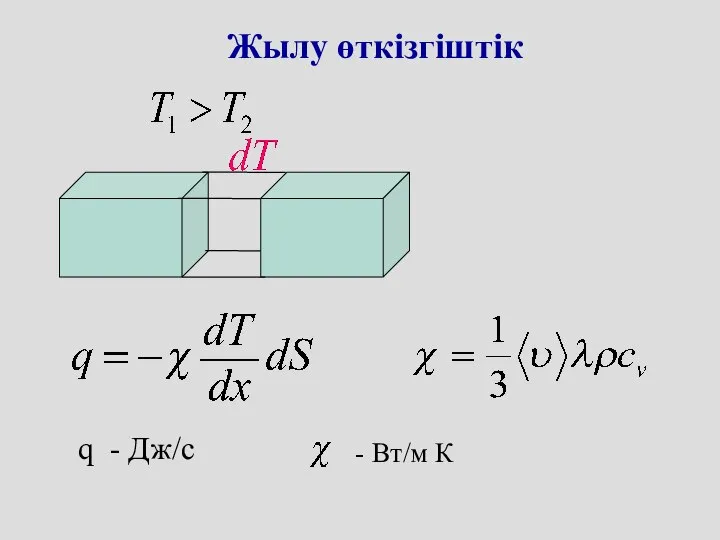
- 41. Жылу өткізгіштік q - Дж/c - Вт/м К
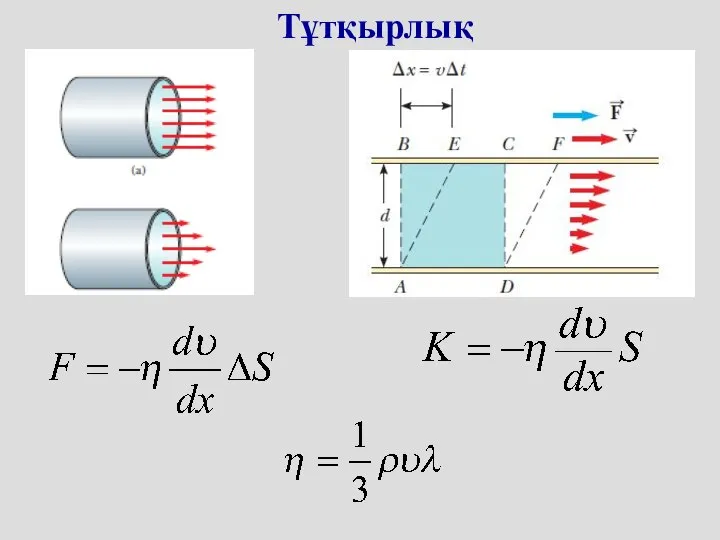
- 42. Тұтқырлық
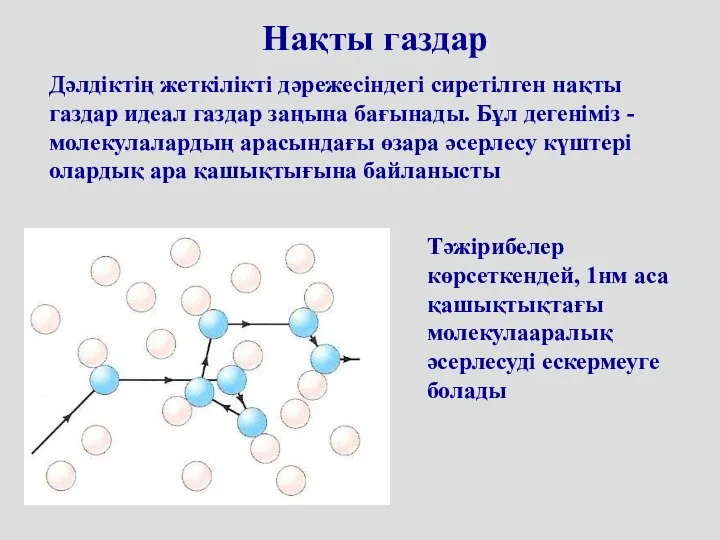
- 44. Нақты газдар Дәлдіктің жеткілікті дәрежесіндегі сиретілген нақты газдар идеал газдар заңына бағынады. Бұл дегеніміз - молекулалардың
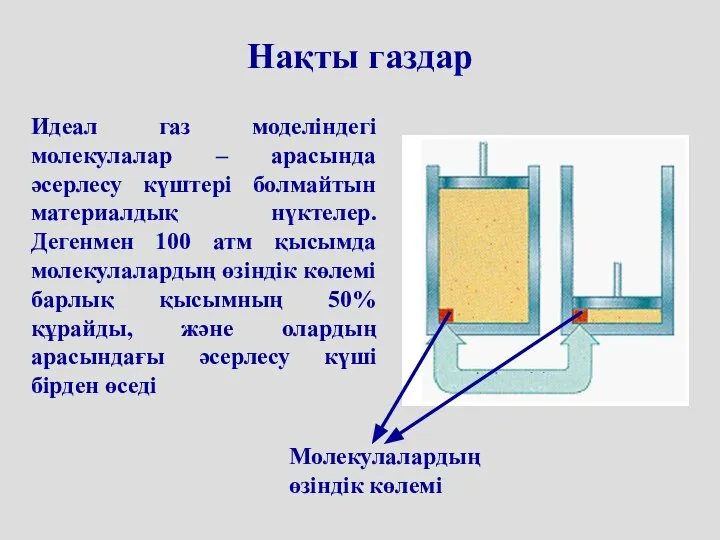
- 45. Нақты газдар Молекулалардың өзіндік көлемі Идеал газ моделіндегі молекулалар – арасында әсерлесу күштері болмайтын материалдық нүктелер.
- 46. Қысым ұлғайғанда сығылғaн газ көлемі молекулалардың өздері алатын көлемге теңеседі
- 47. Идеал газ күйінің теңдеуі төмен қысымда және жоғары температурадағы газдар әрекетін сипаттауға пайдалы. Идеал газадың берілген
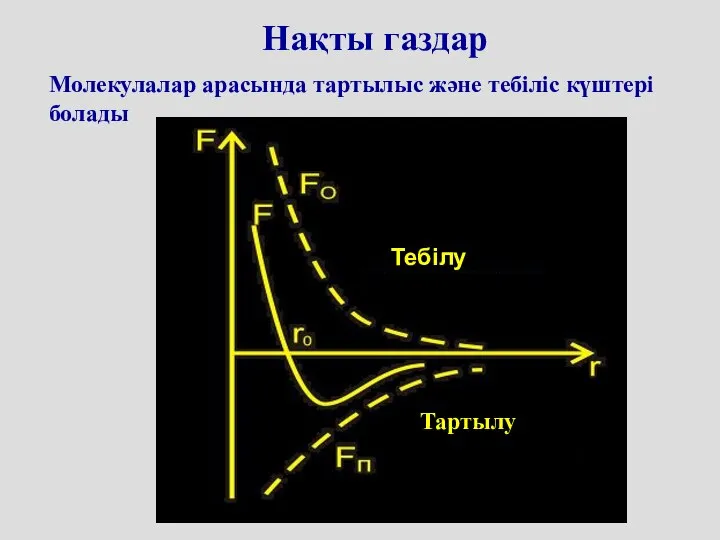
- 48. Нақты газдар Молекулалар арасында тартылыс және тебіліс күштері болады
- 49. Молекулалардың потенциялдық және кинетикалық энергиялары арасындағы арақатынас агрегаттық күйлерге бөлу үшін сындық болып табылады
- 50. Нақты газ күйінің теңдеуі –Ван-дер-Ваальс теңдеуі Нақты газдарда келесі ескерілу керек: Бөлшектерде өз көлемі болады Молекулалар
- 51. ВАН-ДЕР-ВААЛЬС ТЕҢДЕУІ Газдың 1 молі үшін Молекулалардың өзара әсерлесуін ескеру Молекуланың өз көлеміне түзетілім Газдың туынды
- 52. B-тұрақтысы молекула өлшеміне байланысты: үлкен молекула үшін оның мәні де үлкен a-молекулалар арасындағы тартылыс күшінің шамасы
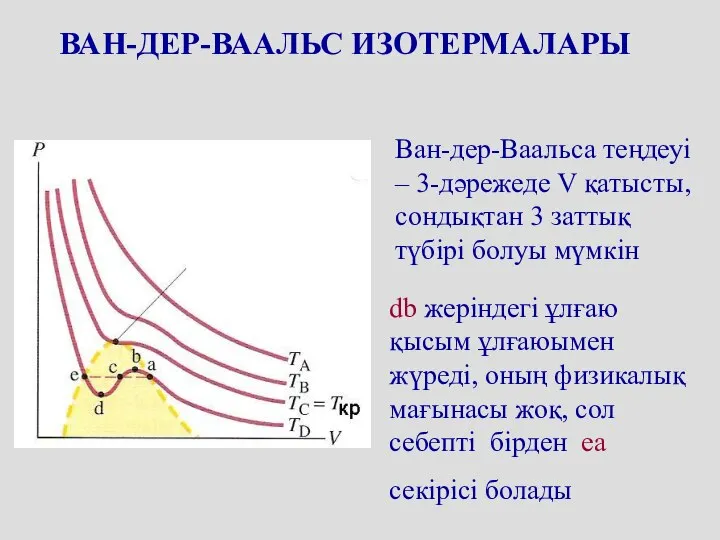
- 53. ВАН-ДЕР-ВААЛЬС ИЗОТЕРМАЛАРЫ Ван-дер-Ваальса теңдеуі – 3-дәрежеде V қатысты, сондықтан 3 заттық түбірі болуы мүмкін db жеріндегі
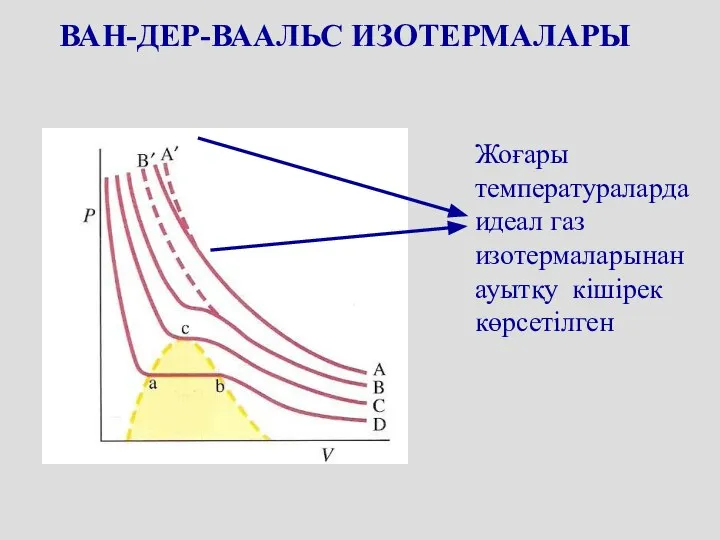
- 54. ВАН-ДЕР-ВААЛЬС ИЗОТЕРМАЛАРЫ Жоғары температураларда идеал газ изотермаларынан ауытқу кішірек көрсетілген
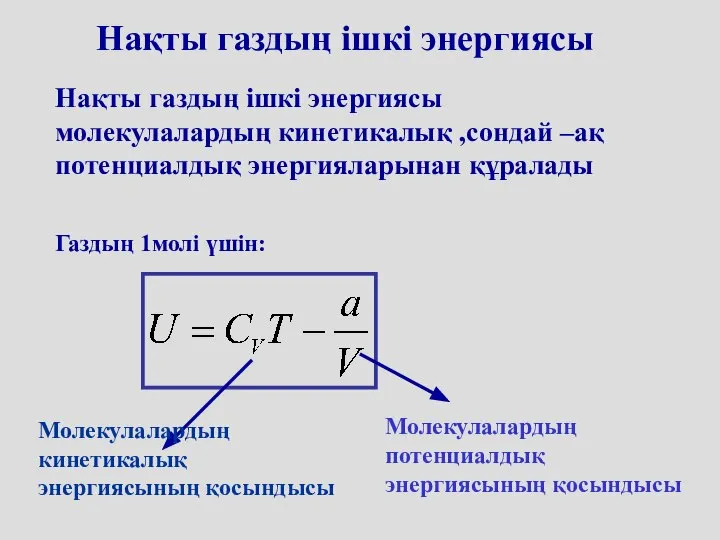
- 55. Нақты газдың ішкі энергиясы Нақты газдың ішкі энергиясы молекулалардың кинетикалық ,сондай –ақ потенциалдық энергияларынан құралады Газдың
- 56. Ван-дер-Ваальс теңдеуіне бағынатын газ үшін күйлердің сындық шамаларының мәндері
- 57. Фаза – химиялық құрамы бірдей және 1 термодинамикалық күйдегі жүйенің барлық бөліктерінің байланысы Фазалық ауысулар 1
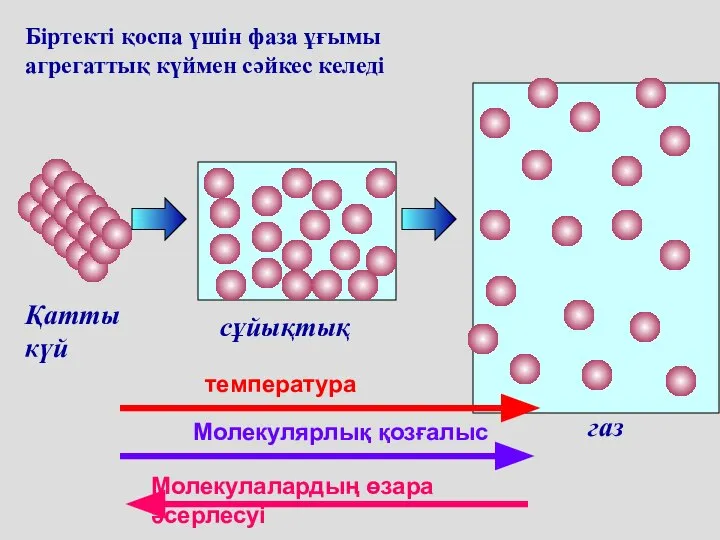
- 58. Біртекті қоспа үшін фаза ұғымы агрегаттық күймен сәйкес келеді сұйықтық газ Қатты күй температура Молекулярлық қозғалыс
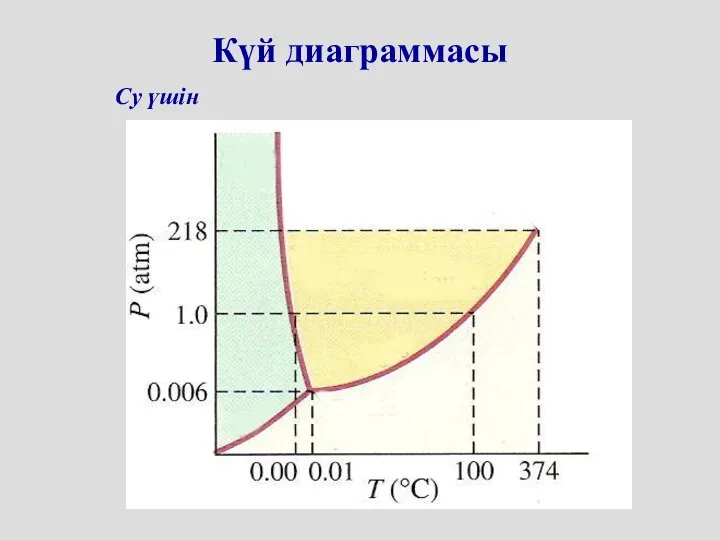
- 59. Күй диаграммасы Егер жүйе біртекті болса, онда фаза ұғымы агрегаттық күймен сәйкес келеді Күй диаграммасы –
- 60. Су үшін Күй диаграммасы
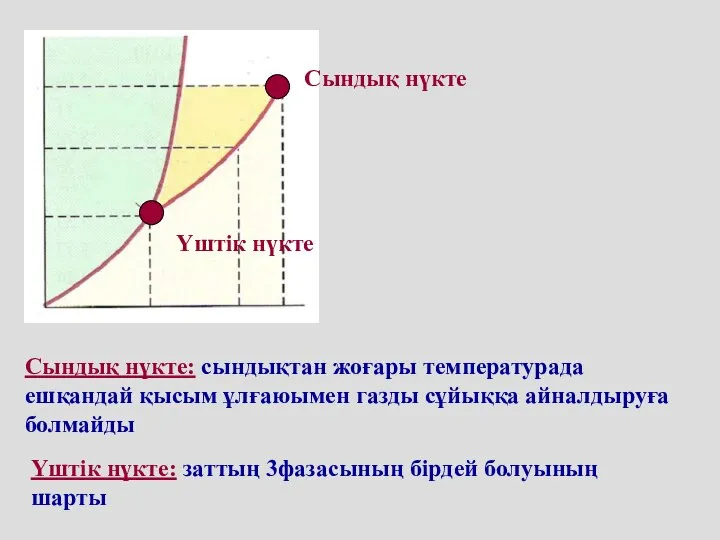
- 61. Сындық нүкте Үштік нүкте Үштік нүкте: заттың 3фазасының бірдей болуының шарты Сындық нүкте: сындықтан жоғары температурада
- 63. Скачать презентацию




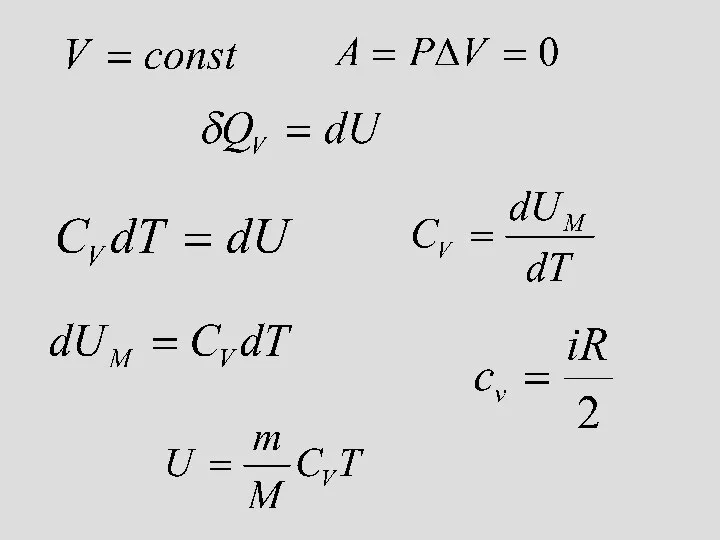
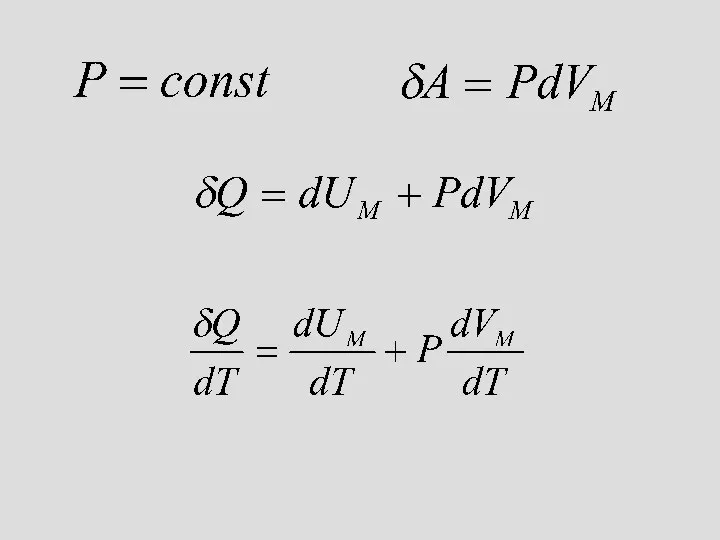
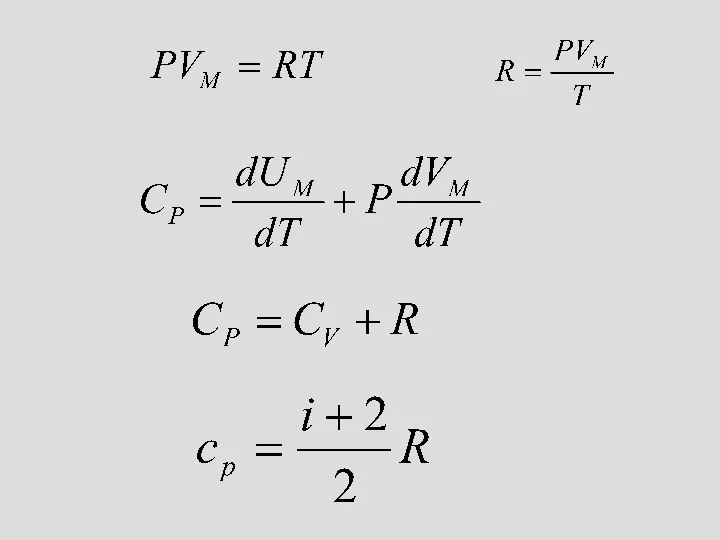




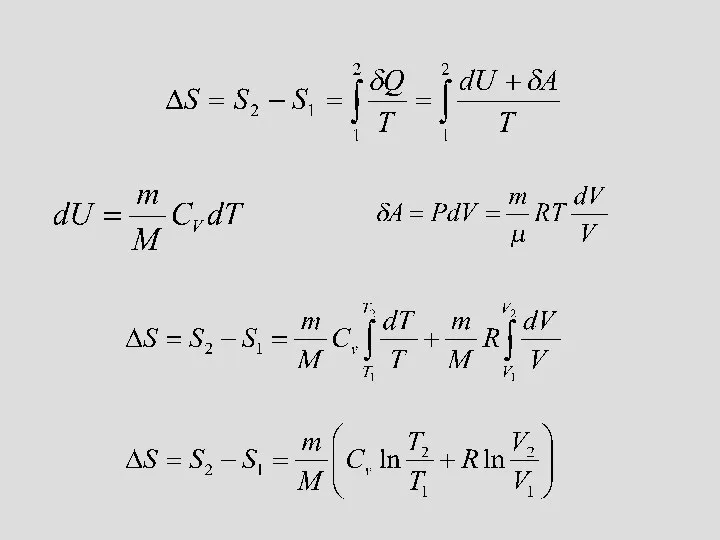


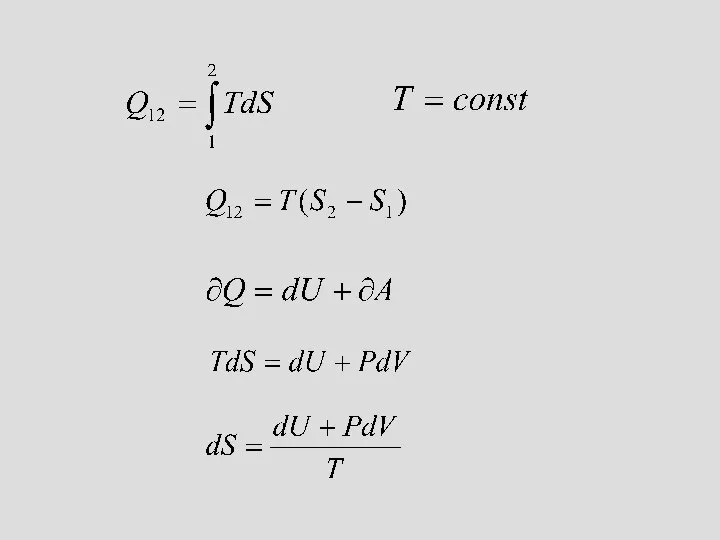





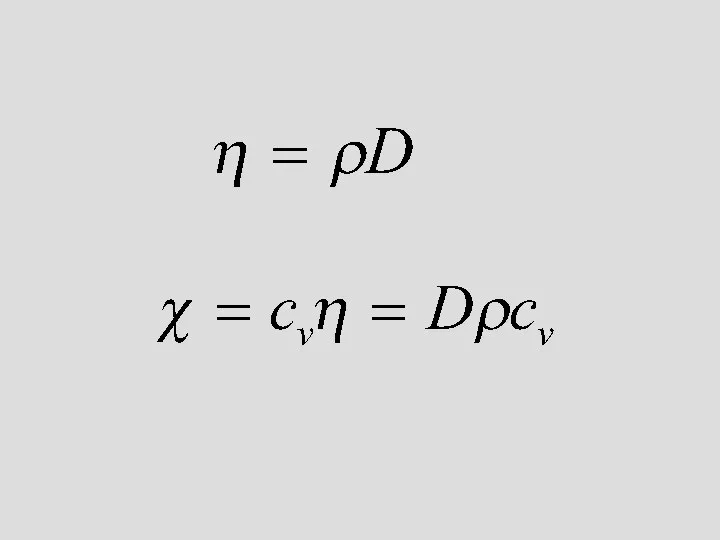









 Презентация на тему Основы термодинамики Решение задач
Презентация на тему Основы термодинамики Решение задач  Разложение вектора по трём некомпланарным векторам
Разложение вектора по трём некомпланарным векторам Электромагнитные колебания и волны
Электромагнитные колебания и волны Детали механизмов и машин. Лекция № 2
Детали механизмов и машин. Лекция № 2 Применение первого начала термодинамики к изопроцессам
Применение первого начала термодинамики к изопроцессам Механическая работа. Мощность. Энергия. Закон сохранения и превращения энергии
Механическая работа. Мощность. Энергия. Закон сохранения и превращения энергии Уравнение Клапейрона
Уравнение Клапейрона Электрическое поле системы неподвижных зарядов в вакууме. Теорема Гаусса. Лекция 1
Электрическое поле системы неподвижных зарядов в вакууме. Теорема Гаусса. Лекция 1 Ложные воспоминания
Ложные воспоминания Решение физических задач графическим способом
Решение физических задач графическим способом Код двигателя внутреннего сгорания
Код двигателя внутреннего сгорания Презентация 3
Презентация 3 Применение аккумуляторов. 8 класс
Применение аккумуляторов. 8 класс Презентация на тему Последовательное соединение проводников (8 класс)
Презентация на тему Последовательное соединение проводников (8 класс)  Химические источники тока. Хит в будущем
Химические источники тока. Хит в будущем Работа реостата
Работа реостата Электричество и магнетизм магнитное поле
Электричество и магнетизм магнитное поле Презентация на тему Строение Солнечной системы
Презентация на тему Строение Солнечной системы  Кинематика
Кинематика Влияние электромагнитных излучений на здоровье человека Проектная работа ученицы 7.2 класса Горбуновой Иоланты и ученика 8.5 класс
Влияние электромагнитных излучений на здоровье человека Проектная работа ученицы 7.2 класса Горбуновой Иоланты и ученика 8.5 класс Решение качественных и расчетных задач по физике
Решение качественных и расчетных задач по физике Закон сохранения энергии
Закон сохранения энергии Презентация на тему Электризация тел. Два рода зарядов (8 класс)
Презентация на тему Электризация тел. Два рода зарядов (8 класс)  Активация в ядерной физике. (Тема 2.8)
Активация в ядерной физике. (Тема 2.8) тела и вещества 6 класс 1
тела и вещества 6 класс 1 Компьютерный расчёт геометрии механизма шагающего колеса
Компьютерный расчёт геометрии механизма шагающего колеса Аттестационная работа. Применение теории вращательного движения к гироскопам
Аттестационная работа. Применение теории вращательного движения к гироскопам