Слайд 2 Электролиты – это водные растворы солей, кислот, щелочей. Носителями заряда в электролитах

являются положительные и отрицательные ионы.
Слайд 3 Диссоциация – это процесс расщепления молекул электролита на положительные
и отрицательные ионы
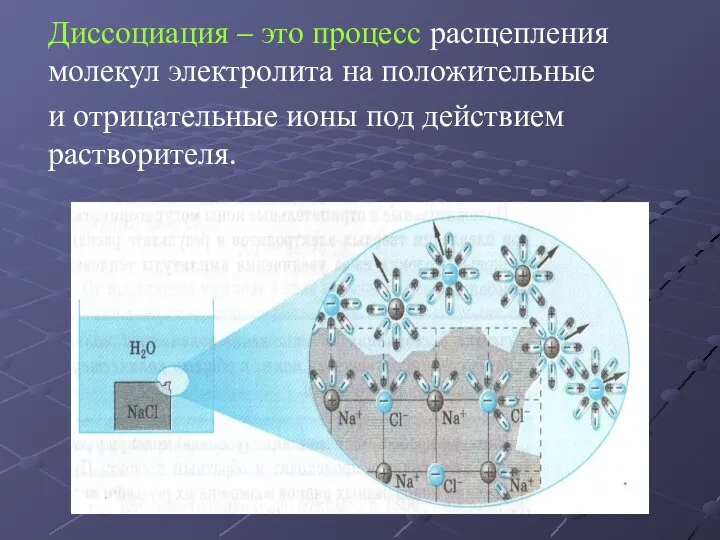
под действием растворителя.
Слайд 4Уравнение диссоциации хлорида меди.

Слайд 5Рекомбинация – это процесс соединение ионов в нейтральную молекулу. Если в электролите
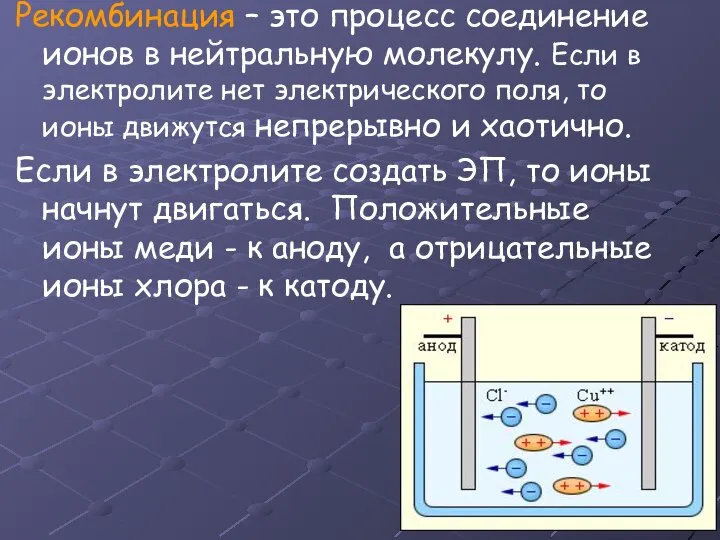
нет электрического поля, то ионы движутся непрерывно и хаотично.
Если в электролите создать ЭП, то ионы начнут двигаться. Положительные ионы меди - к аноду, а отрицательные ионы хлора - к катоду.
Слайд 6Ток в электролитах – это упорядоченное движение
положительных и отрицательных ионов.
+
-
Катод
_
Анод
+
Направление тока в

электролите
Слайд 7 При прохождении электрического тока через электролит наблюдается выделение веществ, входящих в
электролит,

на электродах. Электролиз – это явление выделения на электродах веществ, входящих в состав электролита, при протекании через него электрического тока.
Слайд 8Закон Фарадея для электролиза формулируется так:
Масса m вещества, выделившегося на
электроде, прямо

пропорциональна
заряду q, прошедшему через электролит:
m = kq = kIt.
Величину k называют электрохимическим
эквивалентом и находят для разных веществ в таблице.
Слайд 101.Гальваностегия – это…
декоративное или
антикоррозийное
покрытие металлических
изделий тонким слоем
другого металла

(никелирование,
хромирование,
омеднение, золочение,
серебрение).
Слайд 112.Гальванопластика – это…
электролитическое
изготовление
металлических
копий, рельефных
предметов.

Слайд 123.Электрометаллургия – это…
получение чистых металлов (Al, Na, Mg, Be)
при электролизе расплавленных руд.

Слайд 134.Рафинирование металлов – это…
очистка металлов от примесей с помощью
электролиза, когда
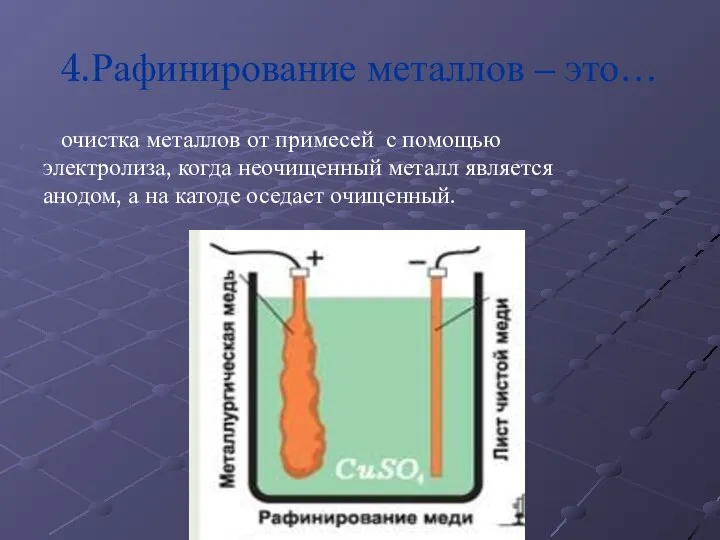
неочищенный металл является
анодом, а на катоде оседает очищенный.
Слайд 14Практическая работа
по теме «Законы Фарадея»














 Презентация на тему Электричество в доме (8 класс)
Презентация на тему Электричество в доме (8 класс)  Сила. 7 клас
Сила. 7 клас Презентация на тему Законы постоянного тока (10 класс)
Презентация на тему Законы постоянного тока (10 класс)  Кинематики, динамика и законы сохранения
Кинематики, динамика и законы сохранения Опыт с куриным яйцом и уксусной кислотой
Опыт с куриным яйцом и уксусной кислотой Разработка машины для корчевания пней
Разработка машины для корчевания пней Оптическая иллюзия
Оптическая иллюзия Трехфазный переменный ток
Трехфазный переменный ток Классификация и основные характеристики первичных преобразователей
Классификация и основные характеристики первичных преобразователей Виды электромагнитных излучений
Виды электромагнитных излучений Аналоговая обработка сигналов
Аналоговая обработка сигналов Двигатель внутреннего сгорания
Двигатель внутреннего сгорания ТП Р3 Т№5
ТП Р3 Т№5 Электрический ток. Условия, необходимые для существования электрического тока. Направление тока. Действие тока
Электрический ток. Условия, необходимые для существования электрического тока. Направление тока. Действие тока Фотометрия Пьера Бугера
Фотометрия Пьера Бугера Призматический фасонный резец
Призматический фасонный резец 21_Zakon_inertsii__pervy_zakon_Nyutona
21_Zakon_inertsii__pervy_zakon_Nyutona Оценка прочности корпуса компрессора ГТД при ударе оторвавшейся лопатки
Оценка прочности корпуса компрессора ГТД при ударе оторвавшейся лопатки Плоские и сферические зеркала
Плоские и сферические зеркала Взаимные превращения жидкостей и газов
Взаимные превращения жидкостей и газов Исследование изображений, даваемых линзой
Исследование изображений, даваемых линзой Потенциальная энергия заряженного тела
Потенциальная энергия заряженного тела Демонтаж рулевого управления авто
Демонтаж рулевого управления авто Источники звука. Звуковые колебания
Источники звука. Звуковые колебания Критический диаметр изоляции. Передача теплоты через шаровую стенку
Критический диаметр изоляции. Передача теплоты через шаровую стенку Криволинейное движение. Динамика
Криволинейное движение. Динамика Виды энергии
Виды энергии Ответ на билет № 24 по физике (7 класс)
Ответ на билет № 24 по физике (7 класс)