Содержание
- 2. Кислотно-основным называется титриметрический метод анализа, основанный на использовании протолитических реакций Н3O+ + OH-→ 2H2O условно Н++ОН-
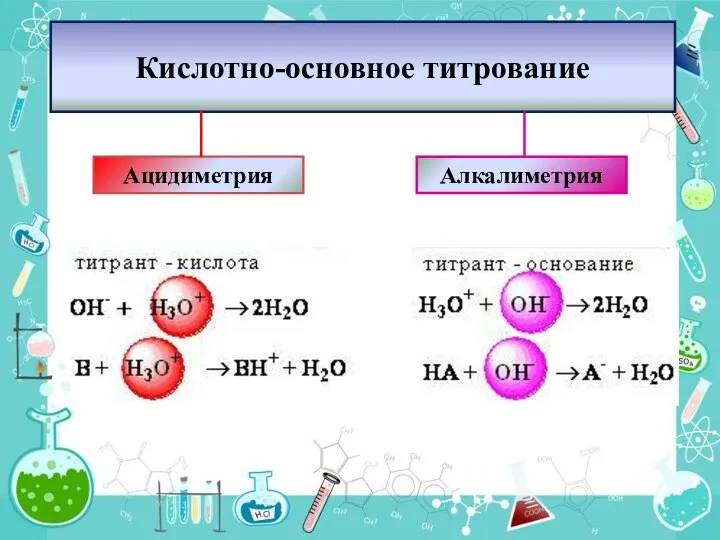
- 3. Кислотно-основное титрование Ацидиметрия Алкалиметрия
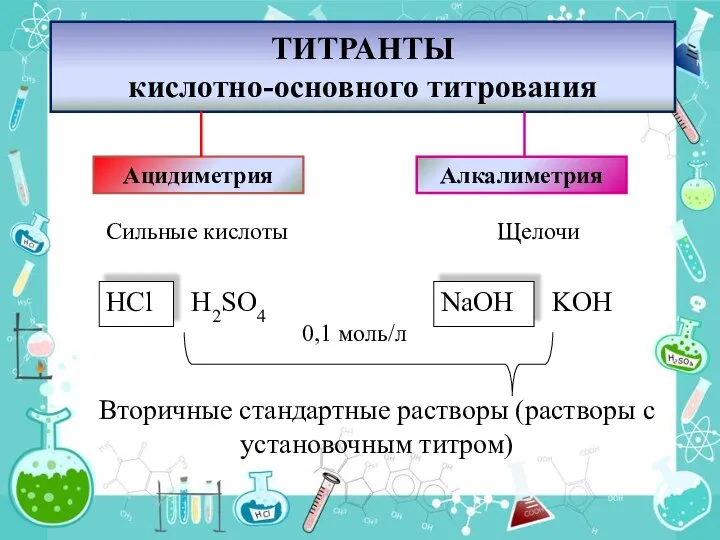
- 4. ТИТРАНТЫ кислотно-основного титрования Ацидиметрия Алкалиметрия Сильные кислоты Щелочи 0,1 моль/л Вторичные стандартные растворы (растворы с установочным
- 5. Приготовить титрованный раствор щелочи по навеске не возможно содержит примеси (механические, карбонаты); растворы поглощают CO2 воздуха
- 6. Приготовить тированный раствор кислоты исходя из концентрированной кислоты невозможно серная кислота гигроскопична, концентрированная соляная кислота выделяет
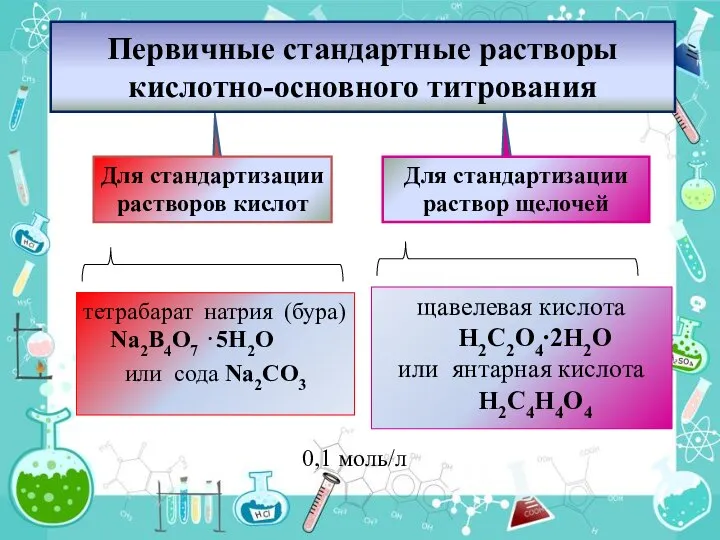
- 7. Первичные стандартные растворы кислотно-основного титрования Для стандартизации растворов кислот Для стандартизации раствор щелочей тетрабарат натрия (бура)
- 8. Точка эквивалентности при реакции нейтрализации не сопровождается каким-либо внешним изменением, поэтому для определения конца реакции применяются
- 9. ИНДИКАТОРЫ (лат. Indicator – указатель)- химические вещества, изменяющие окраску, люминесценцию или образующие осадок при изменении концентрации
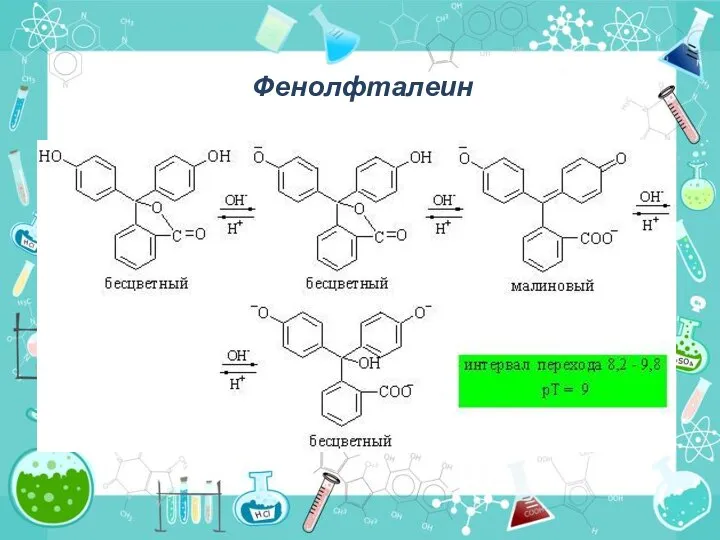
- 10. Индикаторы характеризуются интервалом перехода окраски - пределы концентраций ионов водорода, металла или вещества, при которых происходит
- 11. Требования, предъявляемые к кислотно-основным индикаторам 1. Вещества, используемые в качестве индикаторов, должны обладать интенсивной окраской (иметь
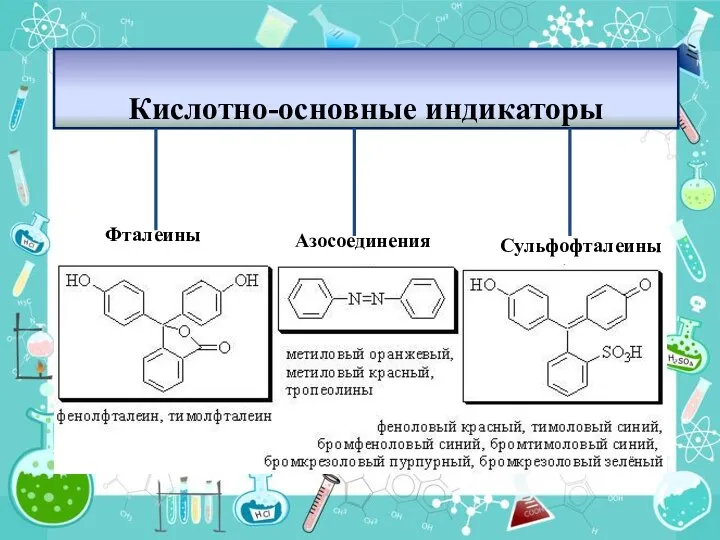
- 12. Кислотно-основные индикаторы Фталеины Азосоединения Сульфофталеины
- 13. Индикаторы методов кислотно-основного титрования
- 14. Фенолфталеин
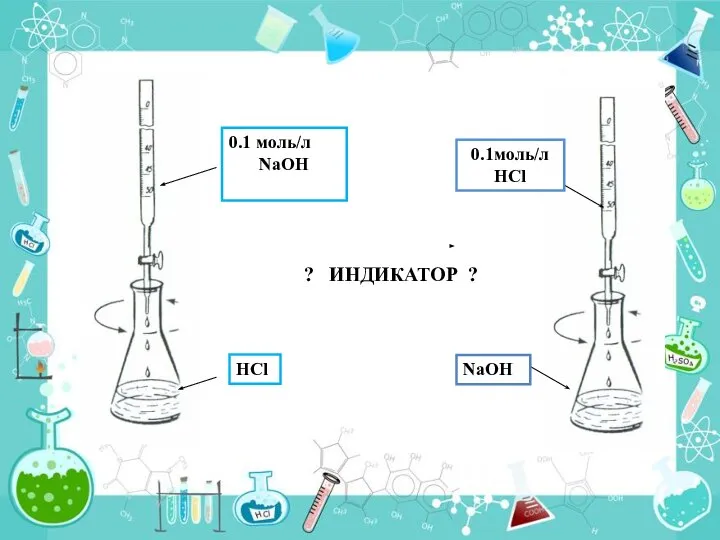
- 15. 0.1моль/л HCl NaOH ? ИНДИКАТОР ?
- 17. Чтобы определить концентрацию одного из растворов, надо знать точно объемы реагирующих растворов, точную концентрацию другого раствора
- 18. Прямое титрование HCl метилоранж На примере Соляной кислоты Титрант NaOH 0,1 моль/л
- 19. РАСЧЕТНАЯ ФОРМУЛА
- 20. VNaOH - среднее арифметическое значение объема раствора гидроксида натрия, пошедшего на титрование; T NaOH/HCl и Кп
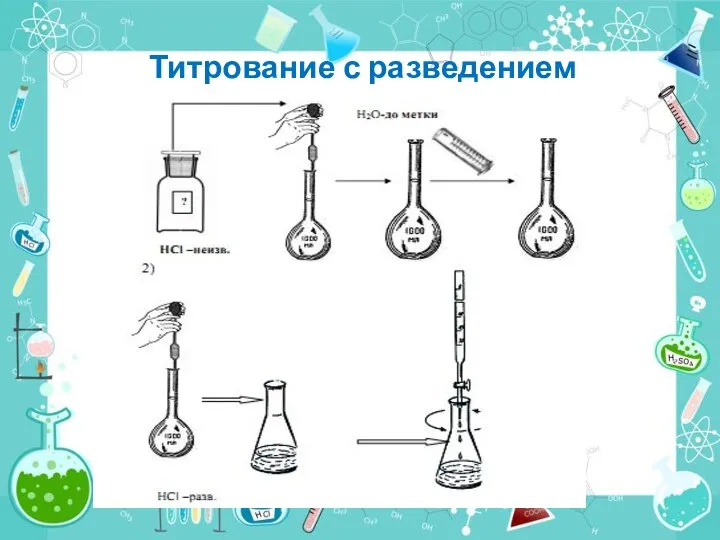
- 21. Титрование с разведением
- 22. РАСЧЕТНАЯ ФОРМУЛА С РАЗВЕДЕНИЕМ
- 23. VNaOH - среднее арифметическое значение объема раствора гидроксида натрия, пошедшего на титрование; T NaOH/HCl и Кп
- 25. Скачать презентацию














 Биологическое окисление
Биологическое окисление Основные диагностические признаки сапфира и его имитаций
Основные диагностические признаки сапфира и его имитаций Проект по химии. Минералы на нашей коже
Проект по химии. Минералы на нашей коже Химия и ее значение
Химия и ее значение Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Основания
Основания Презентация на тему Углерод
Презентация на тему Углерод  Цинк и его применение (11 класс)
Цинк и его применение (11 класс) Презентация на тему Химия моя профессия
Презентация на тему Химия моя профессия  Водород, его общая характеристика, нахождение в природе и его свойства
Водород, его общая характеристика, нахождение в природе и его свойства Закономерности протеканий химических реакций
Закономерности протеканий химических реакций Вода
Вода Дистилляция (перегонка). 7 класс
Дистилляция (перегонка). 7 класс Инфракрасное электромагнитное излучение
Инфракрасное электромагнитное излучение Классы неорганических соединений
Классы неорганических соединений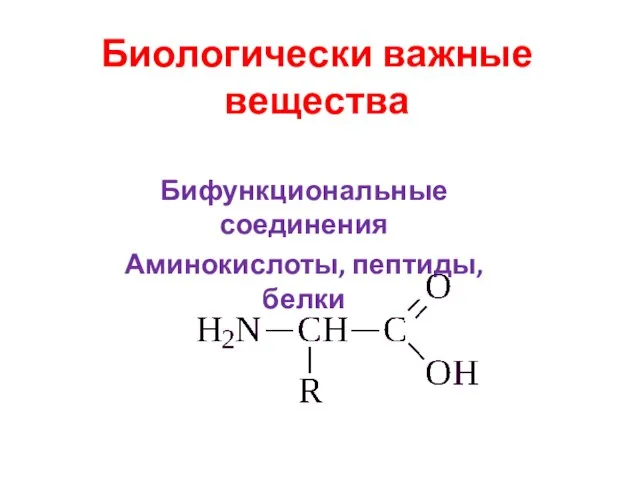 Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Алюминий
Алюминий Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Тест по теме Альдегиды и кетоны
Тест по теме Альдегиды и кетоны Презентация на тему Путешествие в мир химии
Презентация на тему Путешествие в мир химии  Проектная деятельность учащихся по химии
Проектная деятельность учащихся по химии Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Очистка рабочих электродов
Очистка рабочих электродов Изменение химмотологических свойств цетанповышающей присадки в процессе хранения
Изменение химмотологических свойств цетанповышающей присадки в процессе хранения Металлы тоже воевали… 8 класс
Металлы тоже воевали… 8 класс Получение и свойства полиэтилена
Получение и свойства полиэтилена Оценка качества пищевой соли, реализуемой в розничной торговле
Оценка качества пищевой соли, реализуемой в розничной торговле Термореактивные пластмассы (реактопласты)
Термореактивные пластмассы (реактопласты)