Содержание
- 2. Химической системой называют группу веществ, находящихся в ограниченном объёме, всё, что окружает эту систему, составляет внешнюю
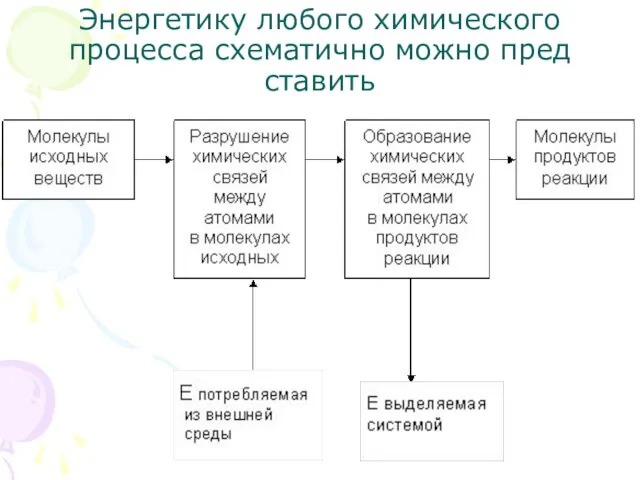
- 3. Энергетику любого химического процесса схематично можно представить
- 4. Превращение веществ друг в друга сопровождается разрывом химических связей в исходных веществах и образованием новых в
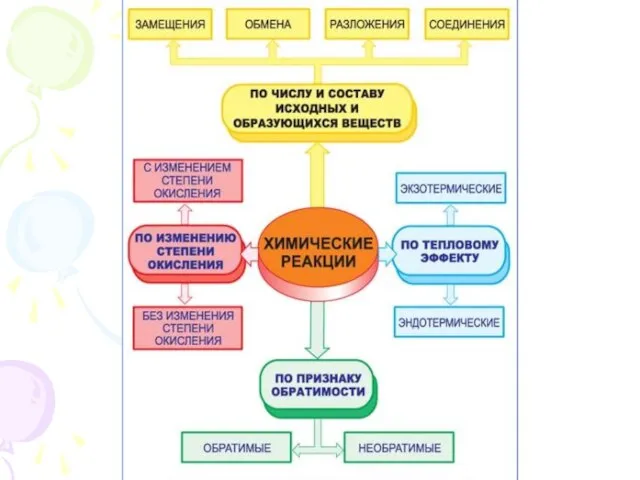
- 6. При постоянстве параметров внешней среды процессы бывают: В изохорном процессе V ( объём – const) В
- 7. ВНУТРЕННЯЯ ЭНЕРГИЯ. ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ (ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ)
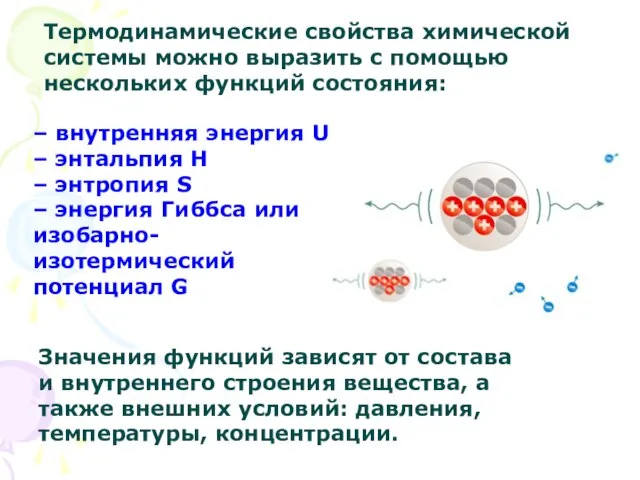
- 8. Термодинамические свойства химической системы можно выразить с помощью нескольких функций состояния: – внутренняя энергия U –
- 9. Тот факт, что при реакциях окисления и горения, при реакциях нейтрализации энергия всегда выделяется, говорит о
- 10. Внутренняя энергия системы U – это её суммарная энергия, включающая энергию взаимодействия и движения молекул, молекул,
- 12. ЗАКОН СОХРАНЕНИЯ Е – ЭНЕРГИЯ НЕ МОЖЕТ НИ СОЗДАВАТЬСЯ НИ ИСЧЕЗАТЬ. ОНА МОЖЕТ ТОЛЬКО ПЕРЕХОДИТЬ ИЗ
- 13. Теплота образования сложных веществ Изменение Н при образовании одного моля сложного вещества из 1 моля простых
- 14. Термохимические уравнения Отличаются от обычных по 3 признакам H2+Cl2=2HCl – химическое уравнение 1/2Н(2)+1/2Сl(2)=HCl(2) ∆H= -93 KДж/моль
- 15. Термохимические расчёты. Закон Гесса. Основной принцип, на котором основываются все термохимические расчеты, установлен в 1840 г.
- 16. Следствие из закона Гесса: энтальпия химических реакций равна сумме энтальпий образования продуктов реакций за вычетом суммы
- 17. Направленность химических процессов В ПРИРОДЕ ВСЕ ПРОЦЕССЫ ПРОТЕКАЮТ В СТОРОНУ УМЕНЬШЕНИЯ ЭНЕРГИИ. ПРИНЦИП БЕРТЛО (1867) Химические
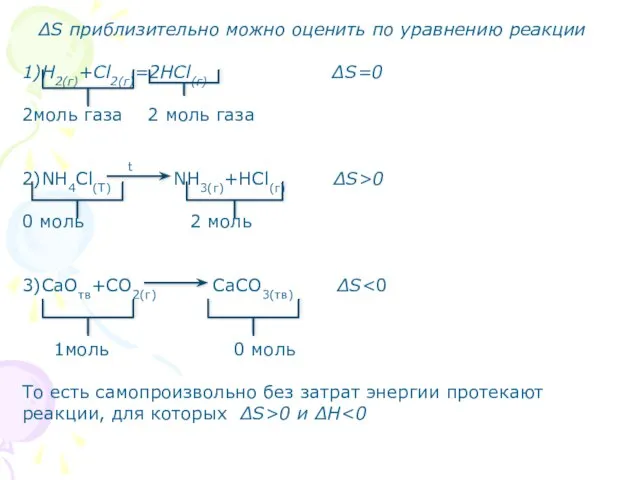
- 18. ∆S приблизительно можно оценить по уравнению реакции 1)Н2(г)+Сl2(г)=2НСl(г) ∆S=0 2моль газа 2 моль газа t 2)NH4Cl(T)
- 20. Скачать презентацию













 Биологическое окисление
Биологическое окисление Основные диагностические признаки сапфира и его имитаций
Основные диагностические признаки сапфира и его имитаций Проект по химии. Минералы на нашей коже
Проект по химии. Минералы на нашей коже Химия и ее значение
Химия и ее значение Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Основания
Основания Презентация на тему Углерод
Презентация на тему Углерод  Цинк и его применение (11 класс)
Цинк и его применение (11 класс) Презентация на тему Химия моя профессия
Презентация на тему Химия моя профессия  Водород, его общая характеристика, нахождение в природе и его свойства
Водород, его общая характеристика, нахождение в природе и его свойства Вода
Вода Дистилляция (перегонка). 7 класс
Дистилляция (перегонка). 7 класс Инфракрасное электромагнитное излучение
Инфракрасное электромагнитное излучение Классы неорганических соединений
Классы неорганических соединений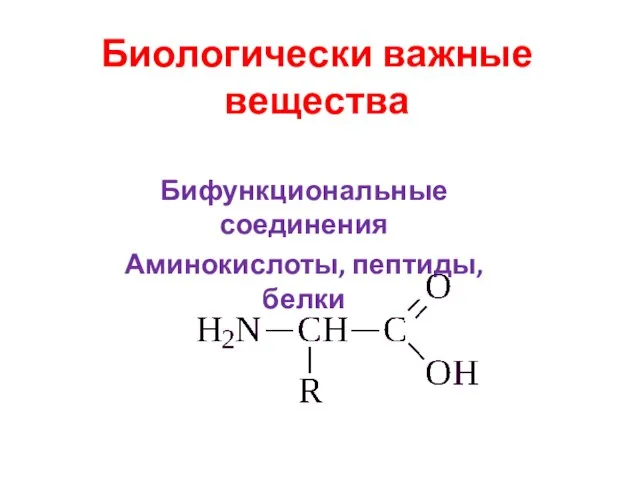 Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Алюминий
Алюминий Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Тест по теме Альдегиды и кетоны
Тест по теме Альдегиды и кетоны Презентация на тему Путешествие в мир химии
Презентация на тему Путешествие в мир химии  Проектная деятельность учащихся по химии
Проектная деятельность учащихся по химии Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Очистка рабочих электродов
Очистка рабочих электродов Изменение химмотологических свойств цетанповышающей присадки в процессе хранения
Изменение химмотологических свойств цетанповышающей присадки в процессе хранения Металлы тоже воевали… 8 класс
Металлы тоже воевали… 8 класс Получение и свойства полиэтилена
Получение и свойства полиэтилена Оценка качества пищевой соли, реализуемой в розничной торговле
Оценка качества пищевой соли, реализуемой в розничной торговле Термореактивные пластмассы (реактопласты)
Термореактивные пластмассы (реактопласты)