Слайд 2Цель и задачи
Определить количество этилендиамина, содержащееся в образцах соединения [Gd(en)x][Fe(CN)6]
Отработка методики индикаторного
![Цель и задачи Определить количество этилендиамина, содержащееся в образцах соединения [Gd(en)x][Fe(CN)6] Отработка](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1096573/slide-1.jpg)
кислотно-основного титрования
Подготовка рабочих растворов
Титрование образов [Gd(en)x][Fe(CN)6] и обсчет плученных данных
Слайд 3Комплексные соли
Комплексные соли – продукты сочетания солей металлов с почти недиссоциированным на

составные части органическими и неорганическими молекулами, содержащие гетеро-атомы с донорной функцией. Комплексные соли при диссоциации образуют сложные комплексные ионы, которые довольно устойчивы в водных растворах. Ион-комплексообразователь и лиганды составляют внутреннюю сферу, комплексный ион, который может являться как анионом, так и катионом.
Примеры: ??2 [??(OH)4]; ?4 [??(CN)6]; [Ag(NH3)2]Cl; [Ag(H2O)6]Cl3
Двойные комплексные соли – комплексные соли содержащие в себе и комплексный катион, и комплексный анион.
Слайд 4Аммиак и амины.
Неподеленная электронная пара аммиака позволяет во многих реакциях выступать в

качестве основания или комплексообразователя.
Амины - органические соединения, которые можно рассматривать как производные аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы, которые могут быть разнотипные и одинаковые.
Так как амины являются производными аммиака, то они проявляют подобные ему основные свойства, за счет неподеленной электронной пары азота.
Слайд 5Этилендиамин.
Жидкость без цвета с запахом аммиака, дымит на воздухе, хорошо растворяется в

воде с разогреванием раствора.
Этилендиамин является сильным основанием, так как является алифатическим амином.
Содержит две аминогруппы, является бидентантным лигандом.
Слайд 6Кислот-основное титрование.
Основной является реакция нейтрализации между кислотой и основанием с образованием воды.

Титрование раствором щелочи называется алкалиметрией. Титрование раствором кислоты — ацидиметрией.
Алкалиметрия используется для количественного определения кислот, ацидиметрия – щелочей.
Индикаторное титрование – метод, при котором точка эквивалентности определяется количеством титранта. Точка эквивалентности определяется по смене окраски индикатора.
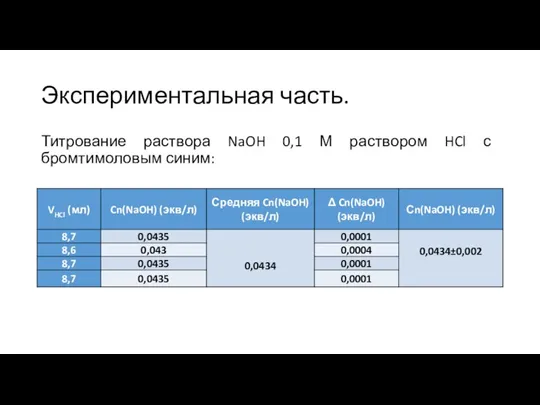
Слайд 7Экспериментальная часть.
Титрование раствора NaOH 0,1 М раствором HCl с бромтимоловым синим:
Слайд 8Экспериментальная часть.
Определение концентрации раствора H2SO4, стандартизированным раствором NaOH.
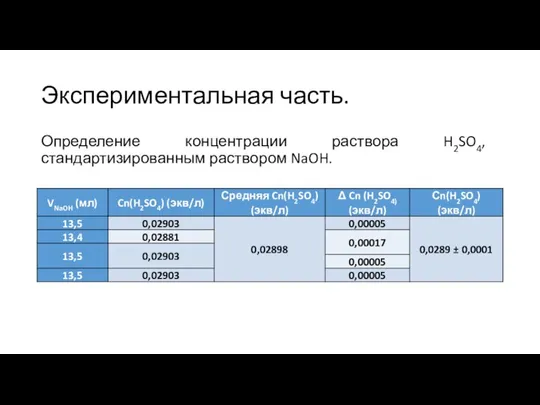
Слайд 9Экспериментальная часть.
Титрование образцов серной кислотой

![Цель и задачи Определить количество этилендиамина, содержащееся в образцах соединения [Gd(en)x][Fe(CN)6] Отработка](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1096573/slide-1.jpg)








 Строение вещества
Строение вещества e169ef73a24f42198b95276fd042e8b8
e169ef73a24f42198b95276fd042e8b8 Көмірдің оптикалық қасиеттері
Көмірдің оптикалық қасиеттері Свойство металлов и сплавов
Свойство металлов и сплавов Альдегиды (номенклатура и изомерия)
Альдегиды (номенклатура и изомерия) В1 витамині
В1 витамині Изготовление искусственного янтаря
Изготовление искусственного янтаря Prezentatsia_Microsoft_PowerPoint
Prezentatsia_Microsoft_PowerPoint Металлы
Металлы Презентация на тему Великие учёные, внёсшие значительный вклад в развитие химии
Презентация на тему Великие учёные, внёсшие значительный вклад в развитие химии  Великие ученые общей и неорганической химии
Великие ученые общей и неорганической химии Сплавы со специальными свойствами
Сплавы со специальными свойствами Реакционная способность органических соединений
Реакционная способность органических соединений Опыты по теме Свойства основных классов неорганических соединений
Опыты по теме Свойства основных классов неорганических соединений Электроотрицательность атомов
Электроотрицательность атомов Физические и химические явления
Физические и химические явления Оксиды неметаллов и металлов. Состав и названия
Оксиды неметаллов и металлов. Состав и названия Сахароза (С12Н22О11)
Сахароза (С12Н22О11) Химические средства защиты растений. Последствия применения пестицидов
Химические средства защиты растений. Последствия применения пестицидов Нанокристаллические и аморфные металлы и сплавы
Нанокристаллические и аморфные металлы и сплавы Презентация на тему Типы реакций
Презентация на тему Типы реакций  коррозия металлов
коррозия металлов Многоатомные спирты
Многоатомные спирты Классификация органических соединений
Классификация органических соединений Газообразные (газ)
Газообразные (газ) Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга
Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга Сульфиты. Сульфаты. Кислотные дожди
Сульфиты. Сульфаты. Кислотные дожди Классификация неорганических соединений
Классификация неорганических соединений