Слайд 2План
1) Электронная конфигурация химических элементов
2) Способы получения
3) Химические свойства и качественные реакции

4) Распространенность элементов
5) Применение
6) Практические задания
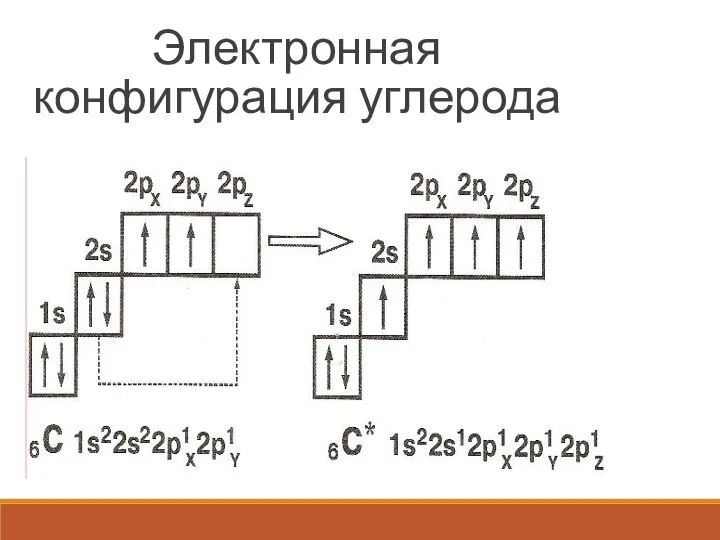
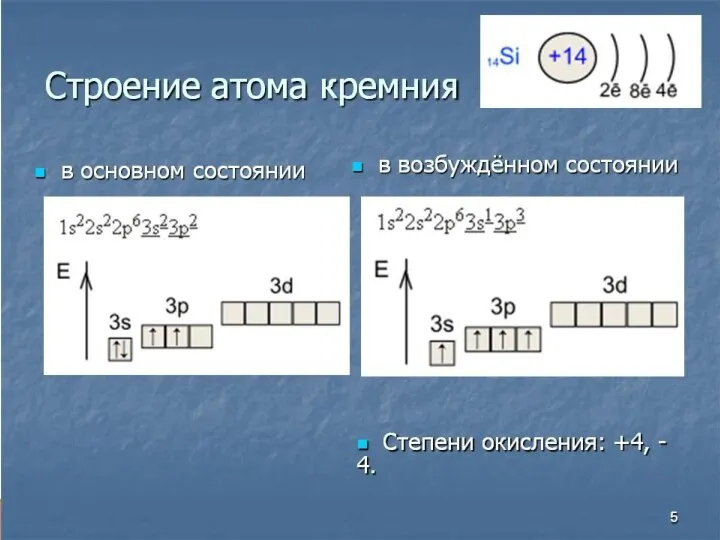
Слайд 3Электронная конфигурация углерода
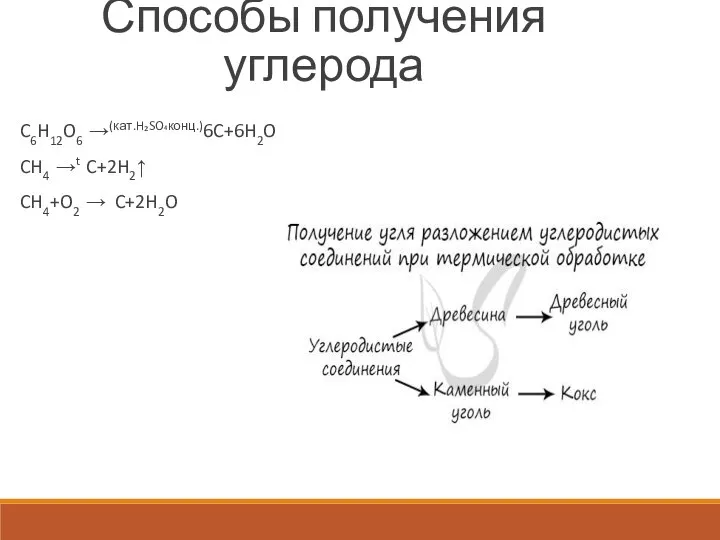
Слайд 4Способы получения углерода
C6H12O6 →(кат.H₂SO₄конц.)6C+6H2O
CH4 →t C+2H2↑
CH4+O2 → C+2H2O
Слайд 6Химические свойства углерода
C+O₂=CO₂↑
2C+O₂=2CO↑(недостаток О₂)
C+2F₂=CF₄
C+H₂O=CO+H₂↑(водяной газ) - t 1000°
C+H₂O=CO₂↑+2H₂↑- t 1200°
C+2CuO=2Cu+CO₂↑ - при

t°
Качественная реакция:
СaCO₃+2HCl=CaCl₂+CO₂↑+H₂O
Ca(OH)₂+CO₂=CaCO₃↓+H₂O
C+2H₂SO₄(конц.)=CO₂↑+2SO₂+2H₂O
C+4HNO₃(конц.)=CO₂↑+4NO₂+2H₂O
C+2S₂=CS₄(сероуглерод)
4Al+3C=Al₄C₃
Ca+2C=CaC₂
CaO+3C=CaC₂+CO↑
C+2H₂=CH₄
Si+C=SiC
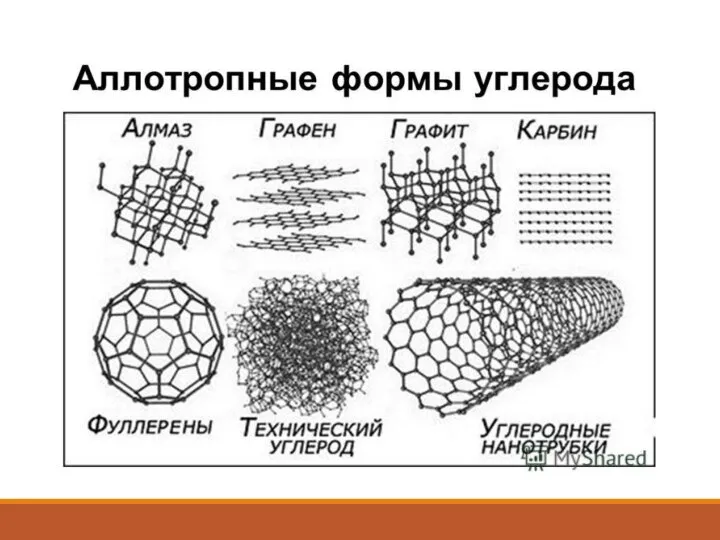
Слайд 7Нахождение углерода в природе
4360 миллионов гигатонн

Слайд 11
Антрацит
94-97% С
Бурый уголь
64-80% С

Слайд 12
Каменный уголь
76-95% С
Горючий
сланец
56-78% С

Слайд 13
Нефть
82-87% С
Горючие природные газы
до 94% метана

Слайд 15
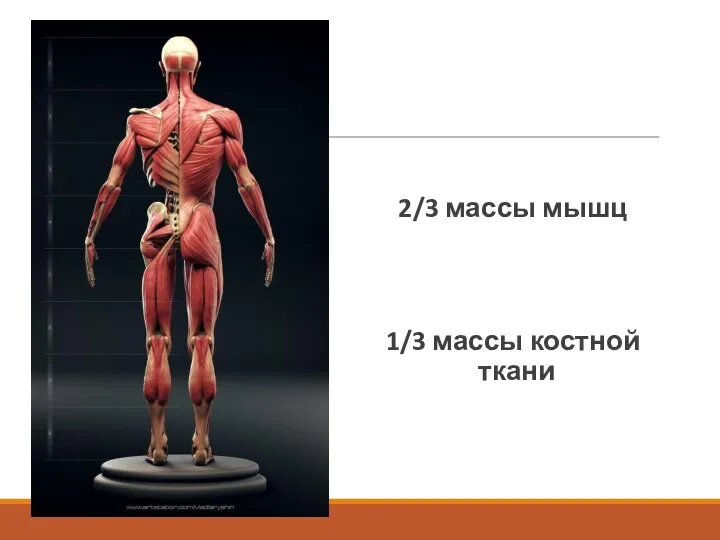
2/3 массы мышц
1/3 массы костной ткани
Слайд 21Способы получения кремния
SiO₂+2Mg=2MgO+Si
SiO₂+C=Si+2CO (t=1800°)
SiH₄→Si+2H₂ (t=1000°)
3SiO₂+4Al→3Si+2Al₂O₃

Слайд 22Химические свойства кремния
Si+2F₂=SiF₄↑(при комн.t°)
Si+O₂=SiO₂
Si+2Cl₂=SiCl₄(t=400-600°)
Si+2NaOH+H₂O=Na₂SiO₃+2H₂↑ при нагревании
C+Si=SiC(карборунд)
2N₂+3Si=Si₃N₄(>1000°C)
Si + 2S → SiS2
2Ca+Si=Ca₂Si(силицид)
3Si+4HNO₃+18HF→
3H₂[SiF₆]+4NO↑+8H₂O
Si + 6HF

→ H2[SiF6] +2H2↑
Si +4HF(газ) → SiF4 +2H2↑
Si + 4HBr → SiF4 +2H2↑
Si + 4HCL → SiCL4+ 2H2↑
Mg₂Si+2H₂SO₄→
SiH₄+2MgSO₄ (моносилан)
Качественная реакция:
Na₂SiO₃+2HCl=H₂SiO₃+2NaCl
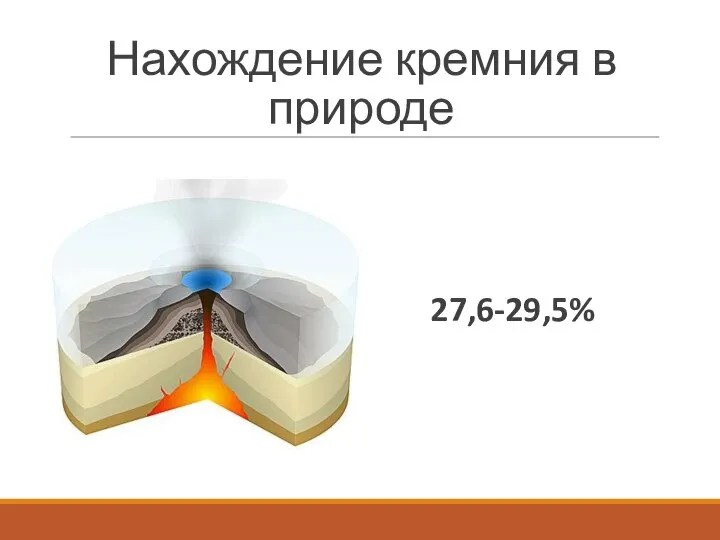
Слайд 23Нахождение кремния в природе
27,6-29,5%
Слайд 27
Полевой шпат
Силикаты и алюмосиликаты

Слайд 40Практические задания
Из предложенного перечня веществ выберите вещества, между которыми протекает гетерогенная окислительно-восстановительная

реакция: кремний, серная кислота, перманганат калия, гидроксид натрия, иод, вода
Слайд 41Практические задания
Из предложенного перечня веществ выберите вещества, между которыми протекает гетерогенная

окислительно-восстановительная реакция: кремний, азотная кислота, азот, водород, углерод, углекислый газ, оксид кремния (IV).
Слайд 42Практические задания
Фосфат кальция нагрели с кремнезем и углеродом. Образовавшееся простое вещество прореагировало

с избытком хлора. Полученный продукт внесли в избыток раствора гидроксида калия. На образовавшийся раствор подействовали известковой водой. Напишите уравнения описанных реакций.
Слайд 43Практические задания
Даны вещества: углерод, водород, концентрированная серная кислота, дихромат калия. Напишите уравнения

четырех возможных реакций между всеми предложенными веществами, не повторяя пары реагентов.
Слайд 44Практические задания
Порошок магния нагрели с избытком кремния. Полученное твердое вещество частично растворилось

в соляной кислоте с выделением газа, который пропустили через раствор щелочи. При подкислении образовавшегося раствора соляной кислотой раствор помутнел вследствие образования нерастворимого в воде вещества. Напишите уравнения четырех описанных реакций.
Слайд 45Практические задания
Основный карбонат цинка нагрели до постоянной массы. Полученное твердое вещество прокалили

с углем. Твердый остаток от прокаливания растворили в концентрированном растворе щелочи, а выделившийся при прокаливании газ пропустили над нагретым оксидом свинца (II). Напишите уравнения четырех описанных реакций.








































 Оксидтер мен негіздердің реакциялары
Оксидтер мен негіздердің реакциялары Введение в органическую химию. Классификация органических соединений
Введение в органическую химию. Классификация органических соединений Алкадиены. Строение. свойства и применение
Алкадиены. Строение. свойства и применение Химия и география. Блиц-опрос. 7 класс
Химия и география. Блиц-опрос. 7 класс Каучук. Строение и применение
Каучук. Строение и применение ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски
ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски Альдегиды. Свойства альдегидов
Альдегиды. Свойства альдегидов Сера и её соединения
Сера и её соединения Реакции обмена
Реакции обмена Галогены. Свойства фтора, брома, йода
Галогены. Свойства фтора, брома, йода Природный газ
Природный газ Карбон
Карбон Нитраты в продуктах
Нитраты в продуктах Галогены
Галогены Особенности формирования естественно-научной картины мира на уроках географии и химии
Особенности формирования естественно-научной картины мира на уроках географии и химии Магний и его сплавы
Магний и его сплавы Амины. Номенклатура аминов
Амины. Номенклатура аминов Серная кислота
Серная кислота Металловедение
Металловедение Природные смолы: канифоль, янтарь, сандарак (2)
Природные смолы: канифоль, янтарь, сандарак (2) Бор и его соединения
Бор и его соединения Презентация на тему Фосфор. Соединения фосфора
Презентация на тему Фосфор. Соединения фосфора  Презентация на тему Амфотерные оксиды и гидроксиды
Презентация на тему Амфотерные оксиды и гидроксиды  Алюминий
Алюминий Презентация на тему Подготовка к ГИА по химии
Презентация на тему Подготовка к ГИА по химии  Супер-химия. Викторина
Супер-химия. Викторина Алканы, алкены, алкины
Алканы, алкены, алкины Химическая география чудес природы
Химическая география чудес природы