Содержание
- 2. Алкадиены – ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные связи между атомами углерода.
- 3. Общая формула CnH2n-2 Алкадиены – ациклические углеводороды, содержащие в молекуле, помимо одинарных связей, две двойные связи
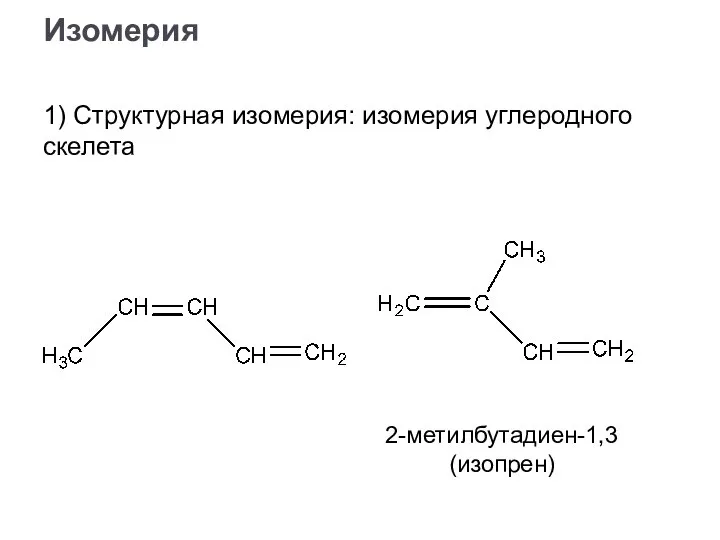
- 4. 1) Структурная изомерия: изомерия углеродного скелета Изомерия 2-метилбутадиен-1,3 (изопрен)
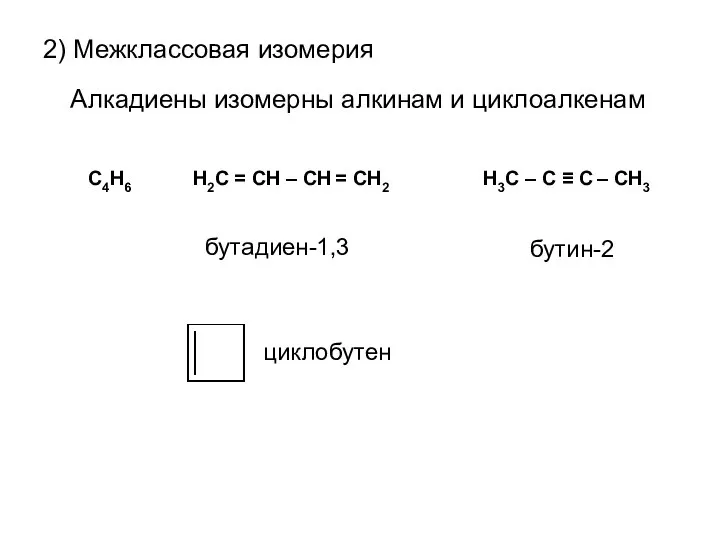
- 5. Алкадиены изомерны алкинам и циклоалкенам 2) Межклассовая изомерия C4H6 H3C – C ≡ C – CH3
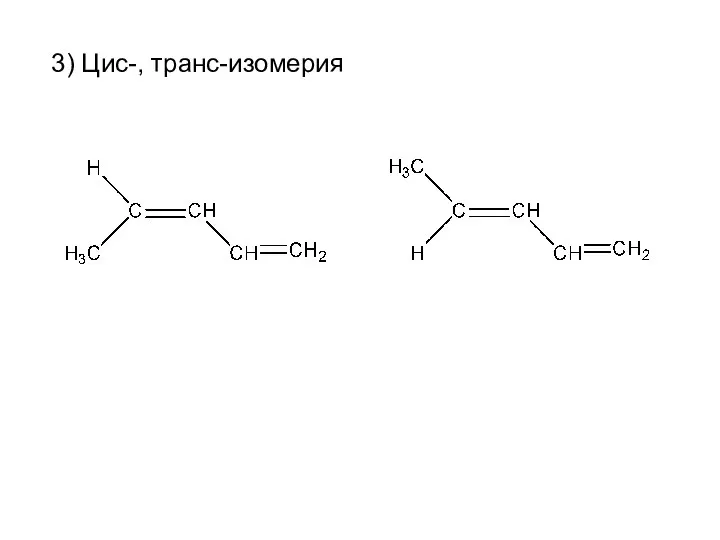
- 6. 3) Цис-, транс-изомерия
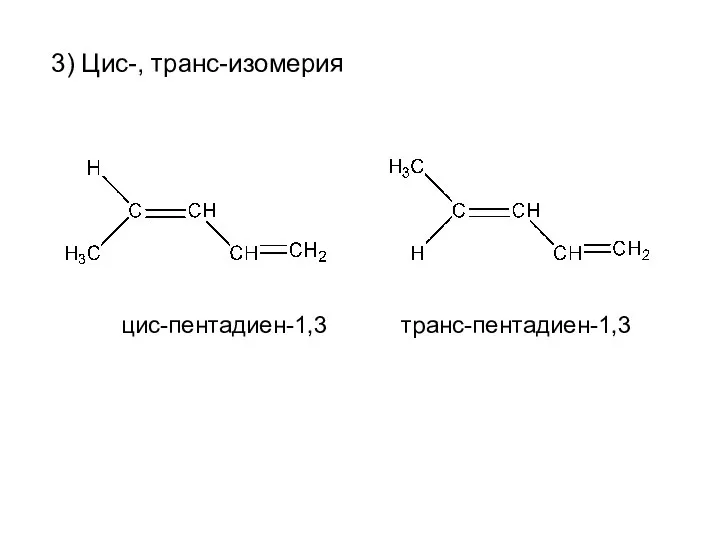
- 7. 3) Цис-, транс-изомерия цис-пентадиен-1,3 транс-пентадиен-1,3
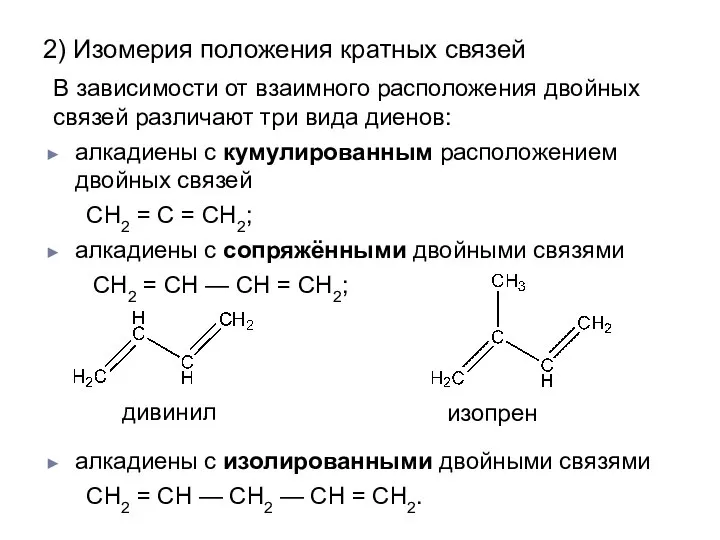
- 8. 2) Изомерия положения кратных связей В зависимости от взаимного расположения двойных связей различают три вида диенов:
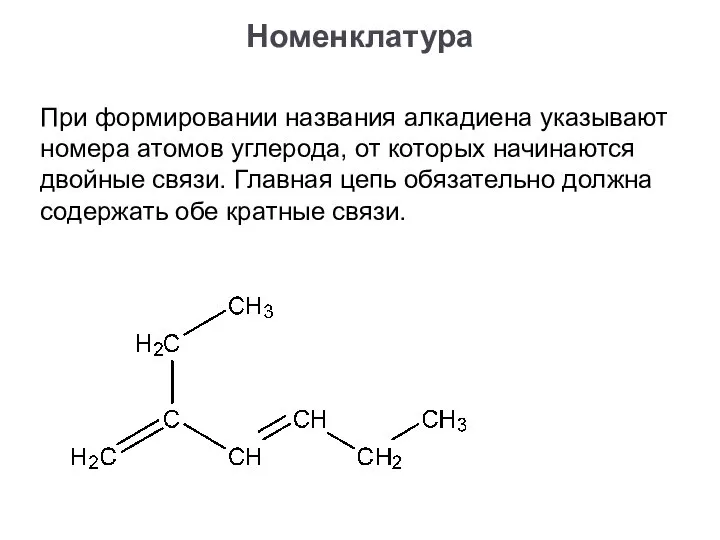
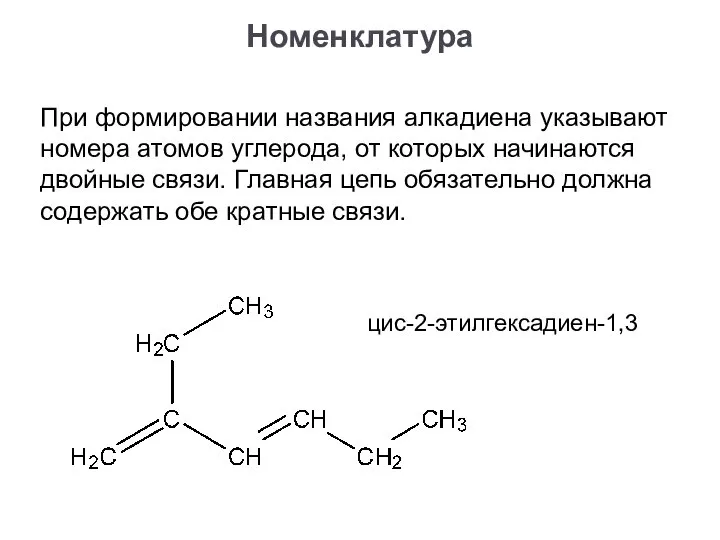
- 9. При формировании названия алкадиена указывают номера атомов углерода, от которых начинаются двойные связи. Главная цепь обязательно
- 10. При формировании названия алкадиена указывают номера атомов углерода, от которых начинаются двойные связи. Главная цепь обязательно
- 11. При нормальных условиях пропадиен-1,2, бутадиен-1,3 (дивинил) — газы 2-метилбутадиен-1,3 (изопрен) — летучая жидкость. Алкадиены с изолированными
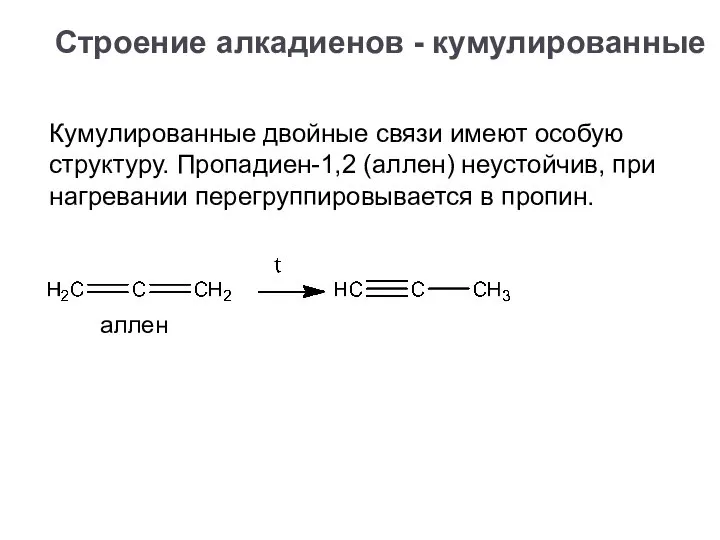
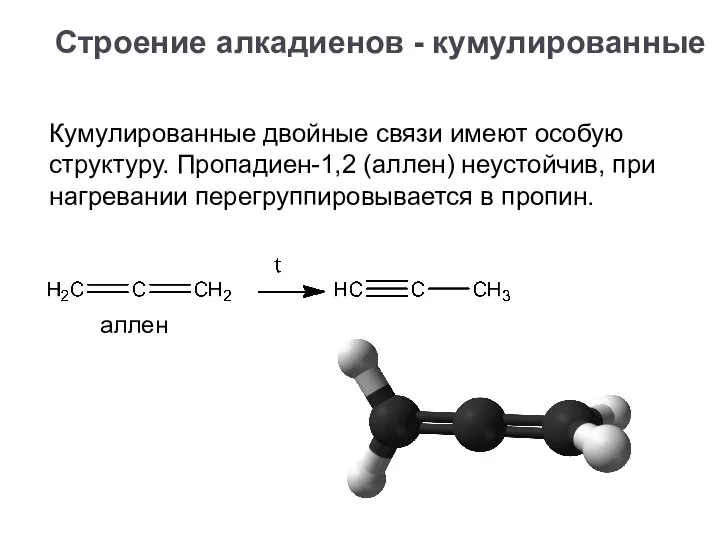
- 12. аллен Кумулированные двойные связи имеют особую структуру. Пропадиен-1,2 (аллен) неустойчив, при нагревании перегруппировывается в пропин. Строение
- 13. Кумулированные двойные связи имеют особую структуру. Пропадиен-1,2 (аллен) неустойчив, при нагревании перегруппировывается в пропин. аллен Строение
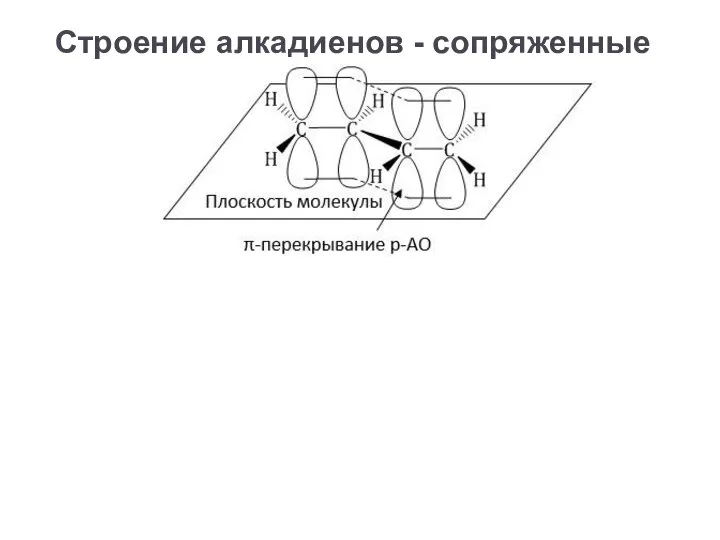
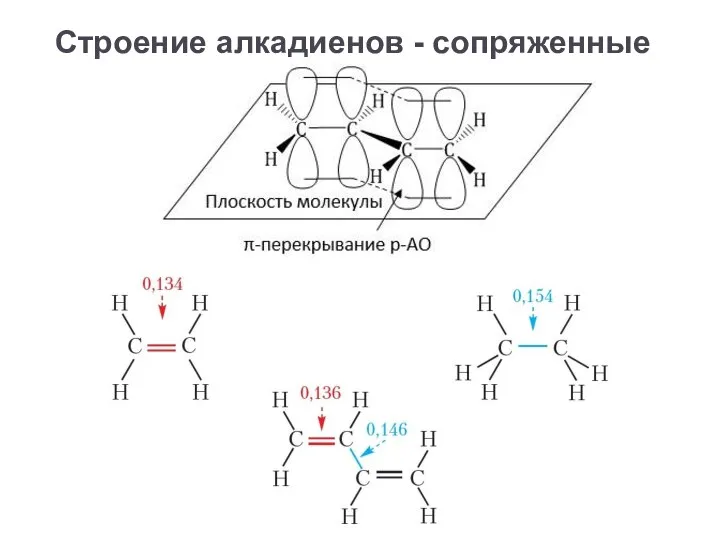
- 14. Строение алкадиенов - сопряженные
- 15. Строение алкадиенов - сопряженные
- 16. кумулированные алкадиены = интересно, но сложно - не проходим СН2 = С = СН2; сопряжённые алкадиены
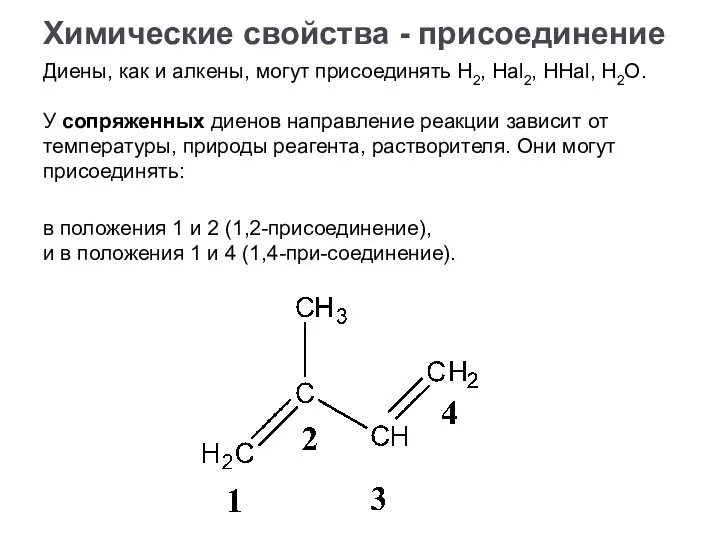
- 17. Для алкадиенов характерны реакции электрофильного и радикального присоединения, окисления и полимеризации. AdE, AdR Химические свойства
- 18. Диены, как и алкены, могут присоединять H2, Hal2, HHal, H2O. У сопряженных диенов направление реакции зависит
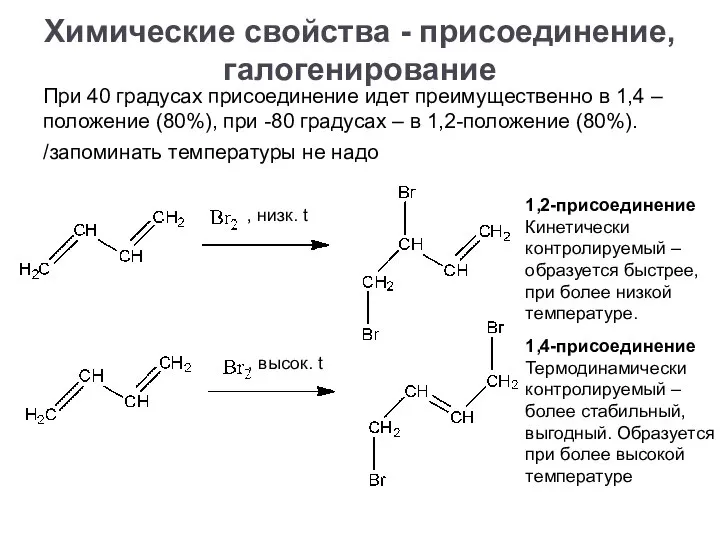
- 19. При 40 градусах присоединение идет преимущественно в 1,4 – положение (80%), при -80 градусах – в
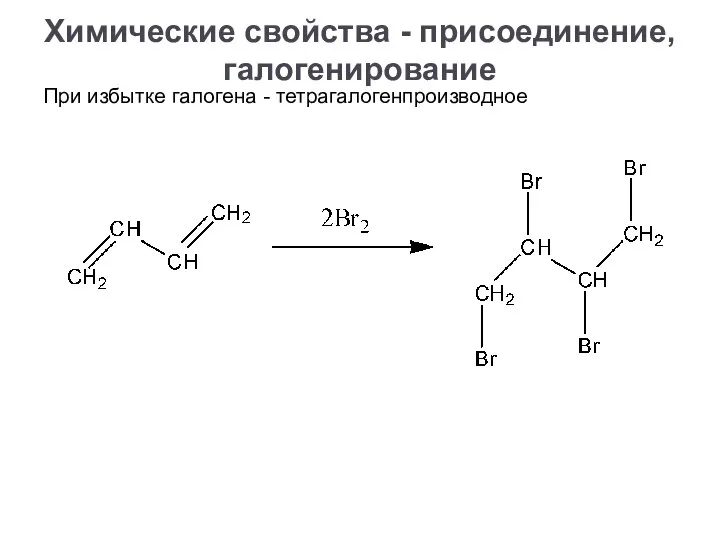
- 20. При избытке галогена - тетрагалогенпроизводное Химические свойства - присоединение, галогенирование
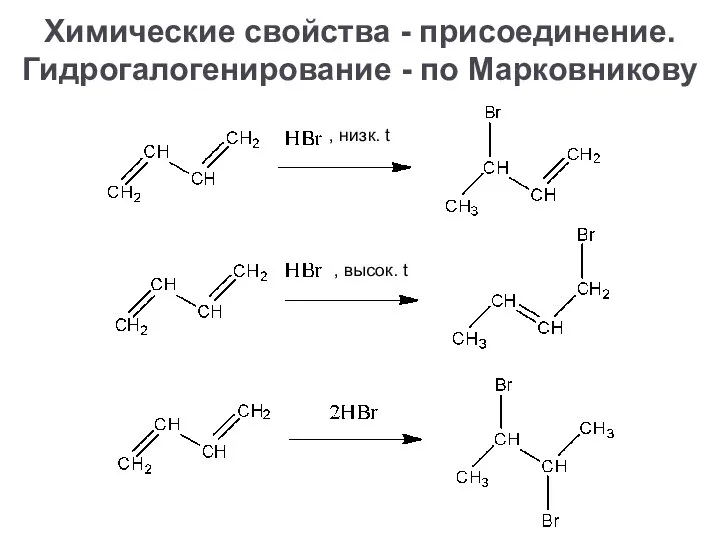
- 21. Химические свойства - присоединение. Гидрогалогенирование - по Марковникову , высок. t , низк. t
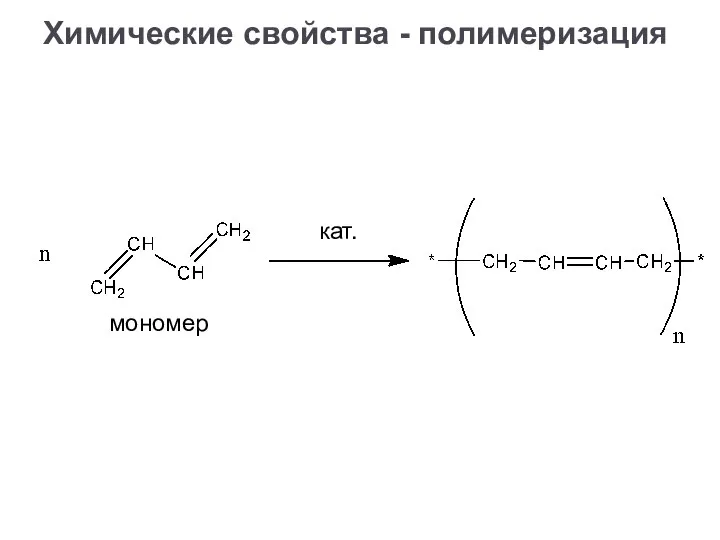
- 22. Химические свойства - полимеризация мономер кат.
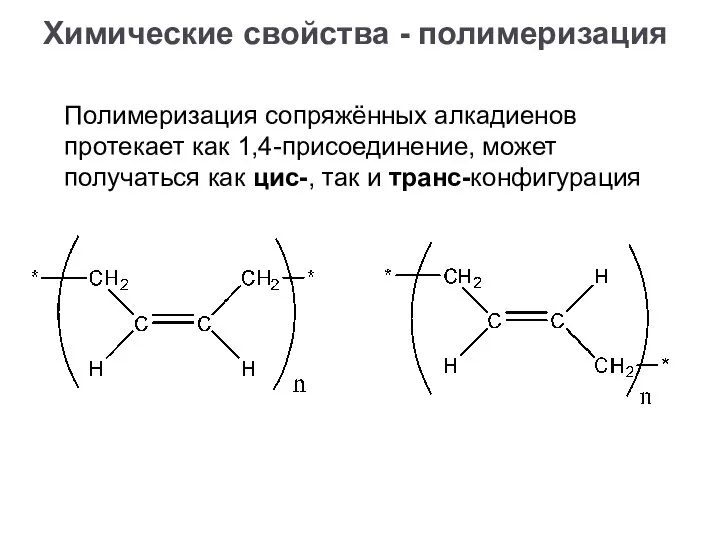
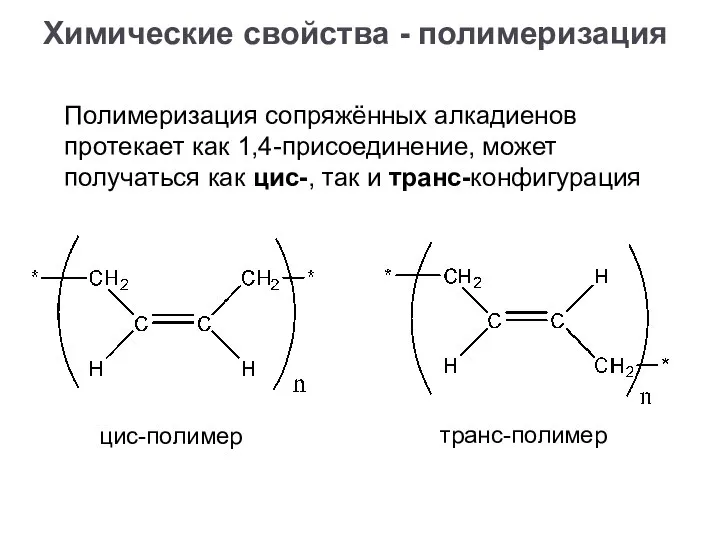
- 23. Полимеризация сопряжённых алкадиенов протекает как 1,4-присоединение, может получаться как цис-, так и транс-конфигурация Химические свойства -
- 24. Полимеризация сопряжённых алкадиенов протекает как 1,4-присоединение, может получаться как цис-, так и транс-конфигурация Химические свойства -
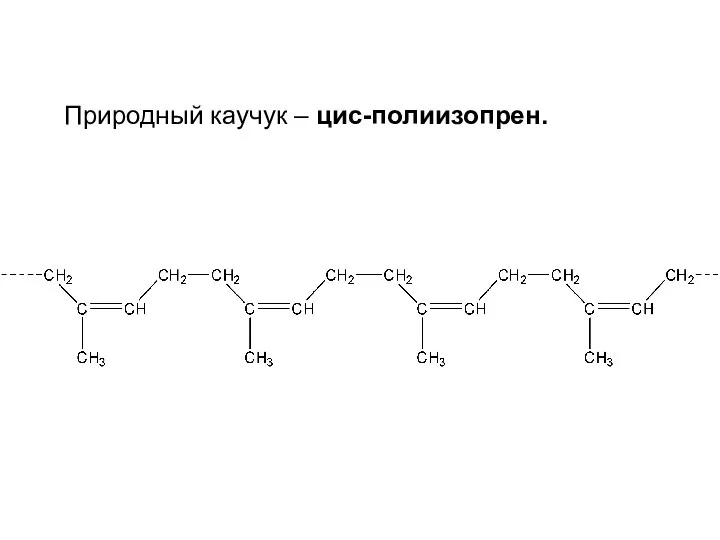
- 25. Природный каучук – цис-полиизопрен.
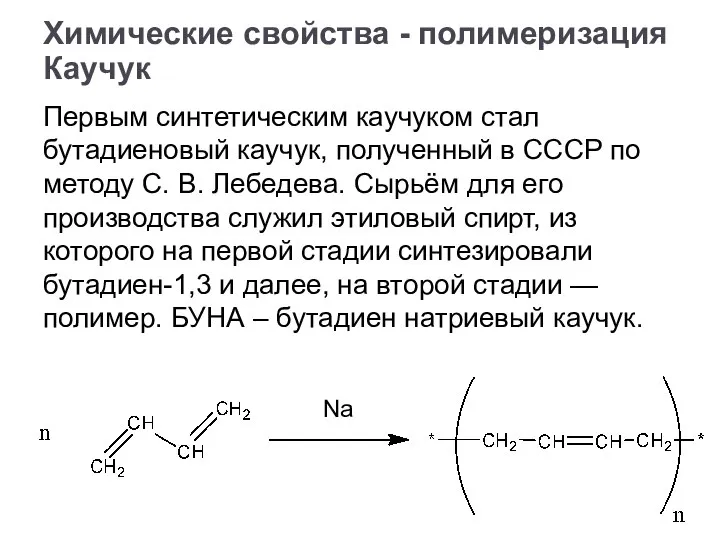
- 26. Каучук Первым синтетическим каучуком стал бутадиеновый каучук, полученный в СССР по методу С. В. Лебедева. Сырьём
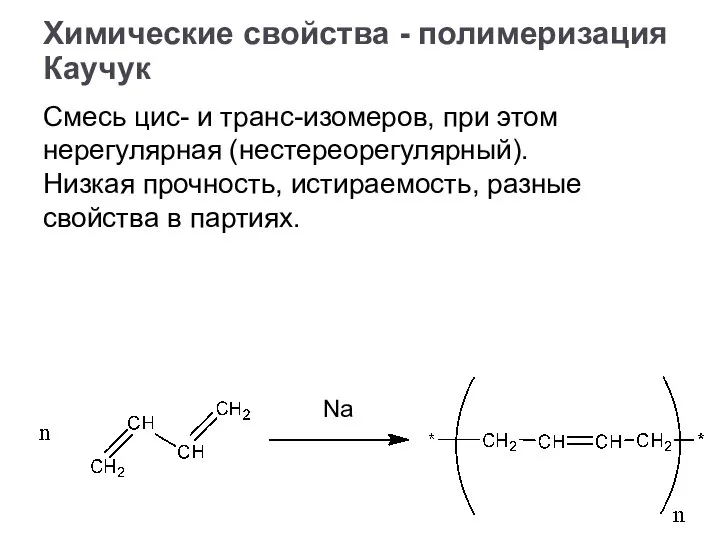
- 27. Каучук Смесь цис- и транс-изомеров, при этом нерегулярная (нестереорегулярный). Низкая прочность, истираемость, разные свойства в партиях.
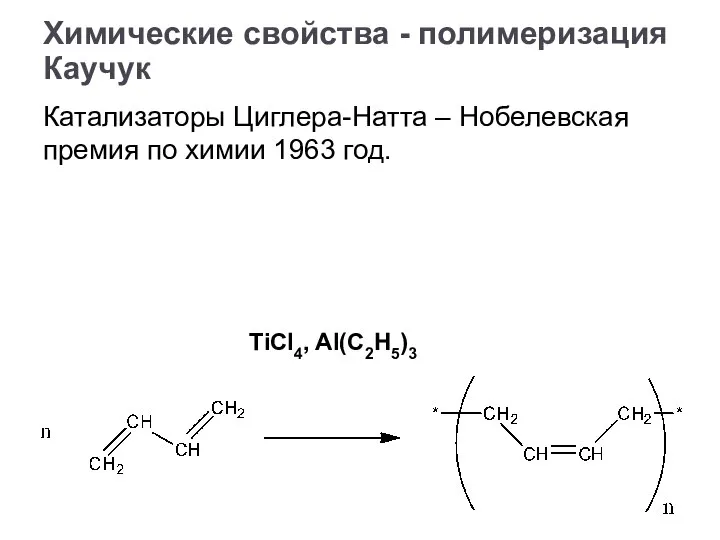
- 28. Каучук Катализаторы Циглера-Натта – Нобелевская премия по химии 1963 год. Химические свойства - полимеризация TiCl4, Al(C2H5)3
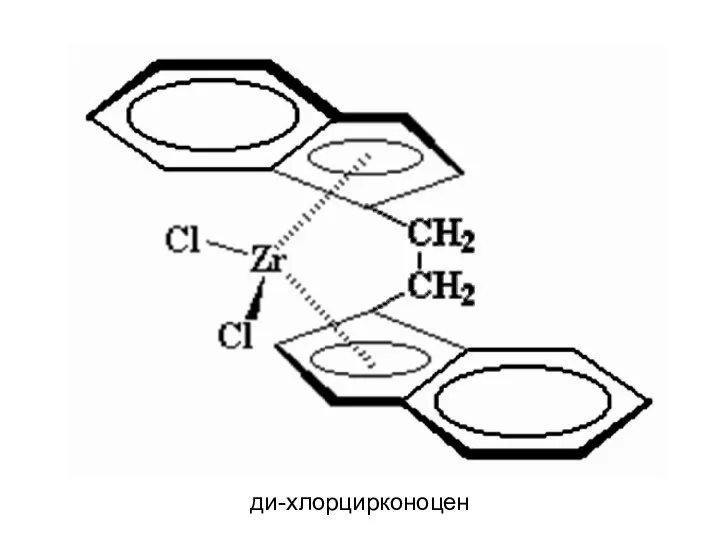
- 29. ди-хлорцирконоцен
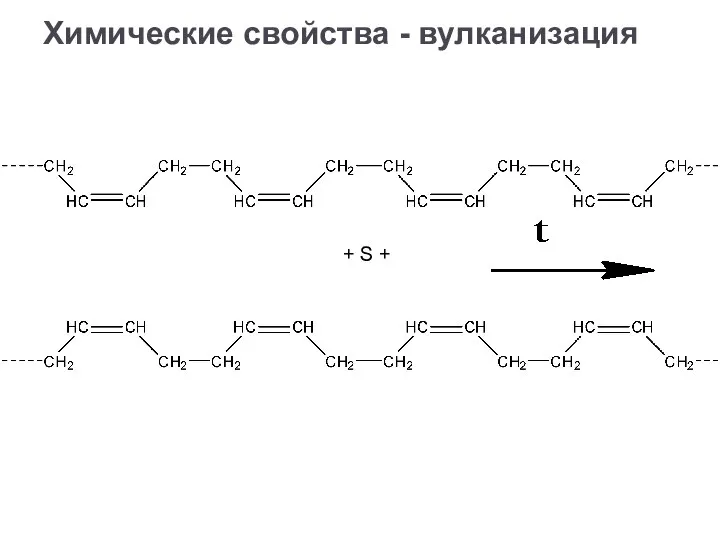
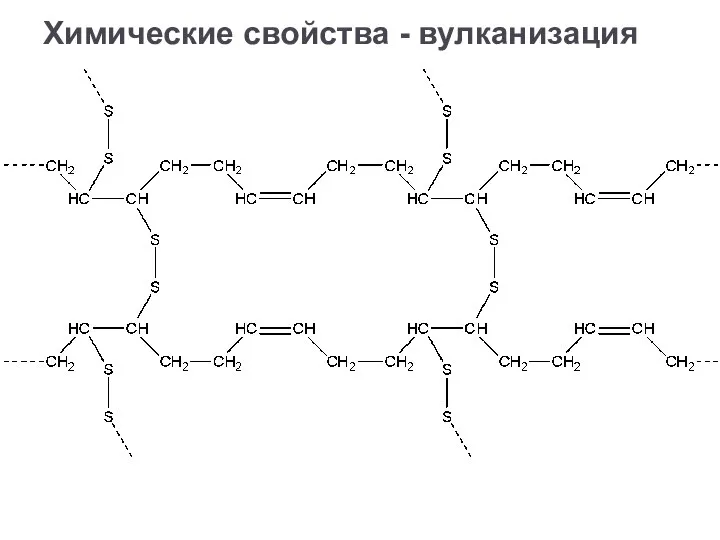
- 30. Химические свойства - вулканизация + S +
- 31. Химические свойства - вулканизация
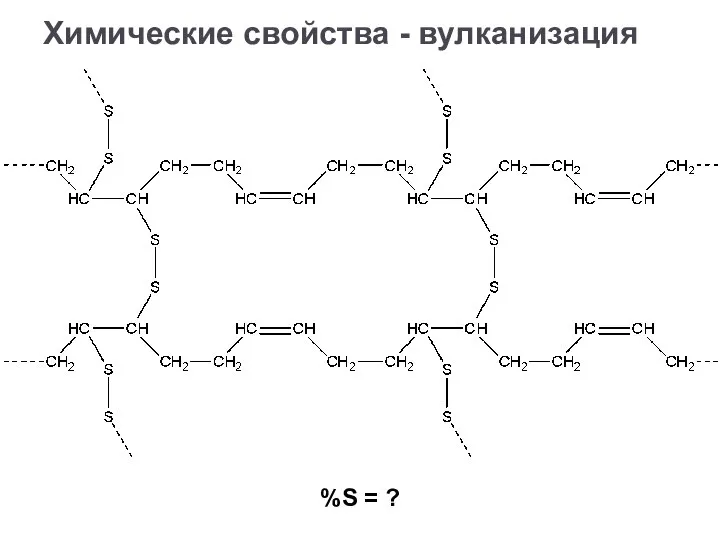
- 32. Химические свойства - вулканизация %S = ?
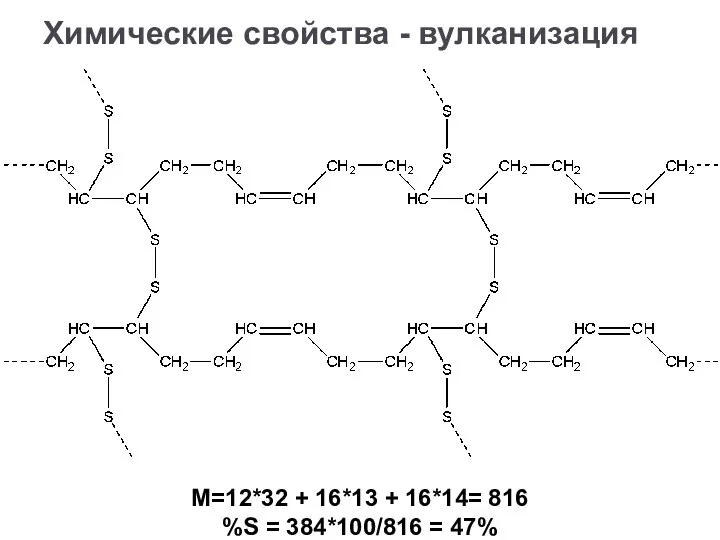
- 33. Химические свойства - вулканизация M=12*32 + 16*13 + 16*14= 816 %S = 384*100/816 = 47%
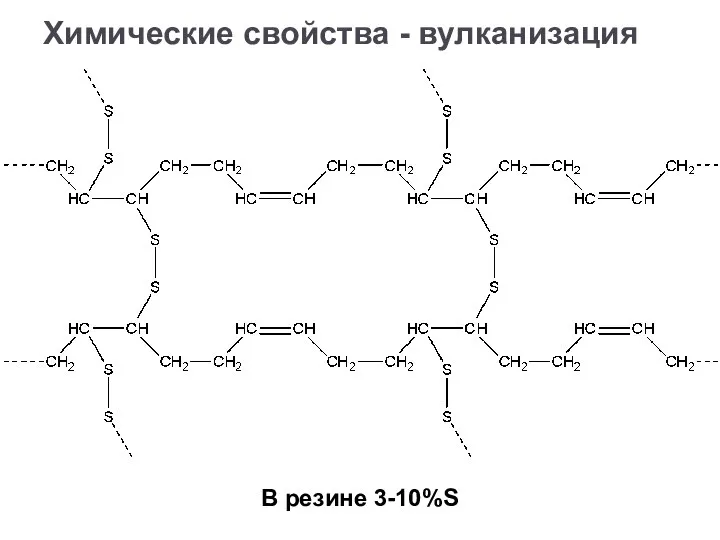
- 34. Химические свойства - вулканизация В резине 3-10%S
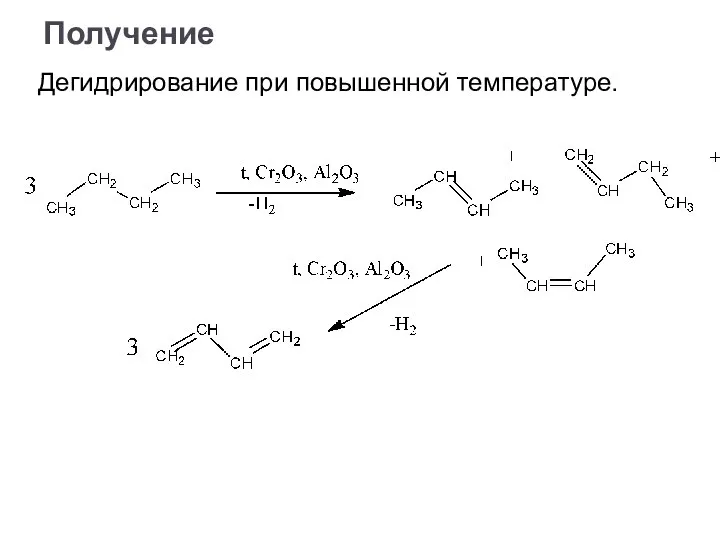
- 35. Дегидрирование при повышенной температуре. Получение
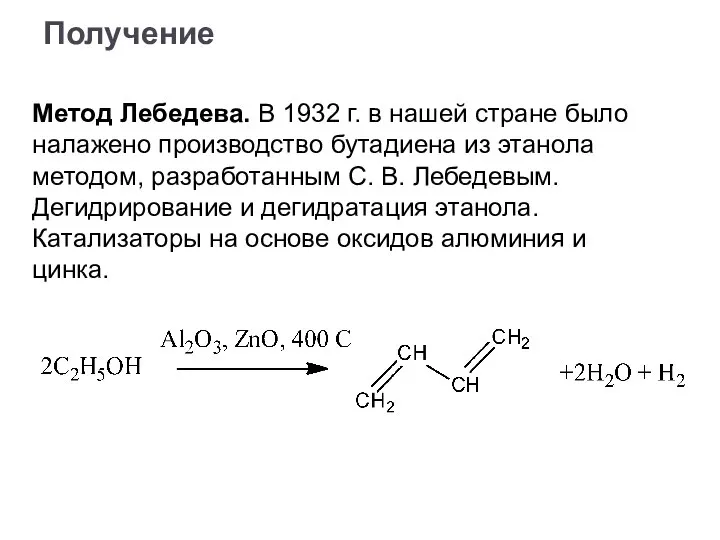
- 36. Метод Лебедева. В 1932 г. в нашей стране было налажено производство бутадиена из этанола методом, разработанным
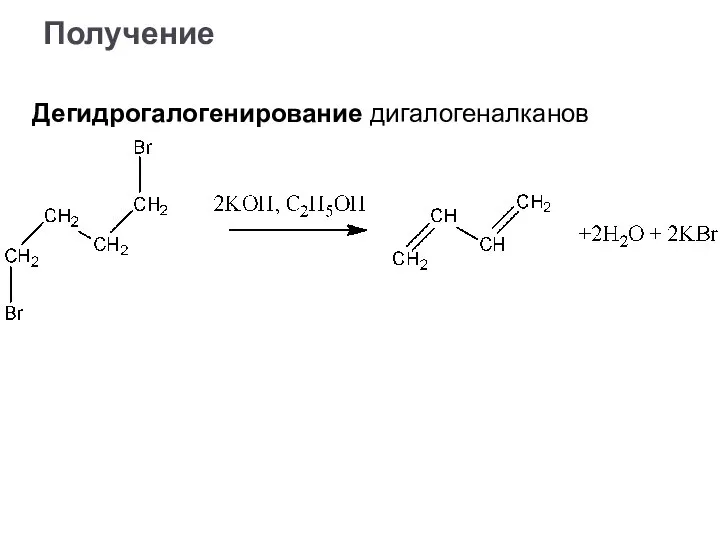
- 37. Получение Дегидрогалогенирование дигалогеналканов
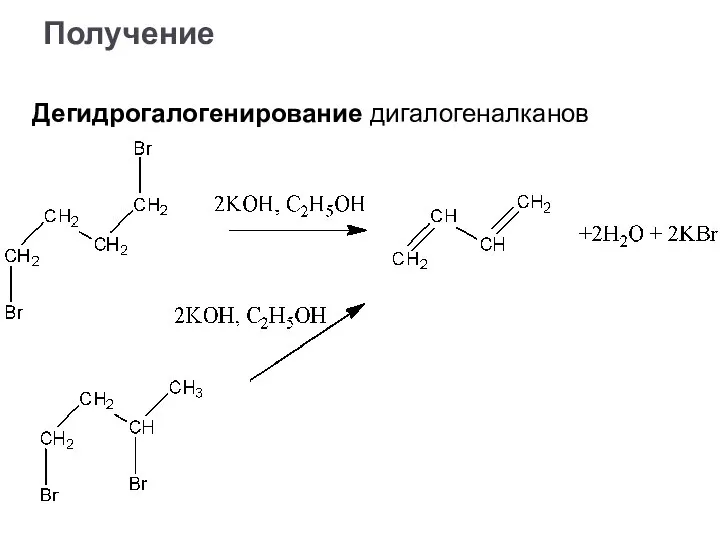
- 38. Получение Дегидрогалогенирование дигалогеналканов
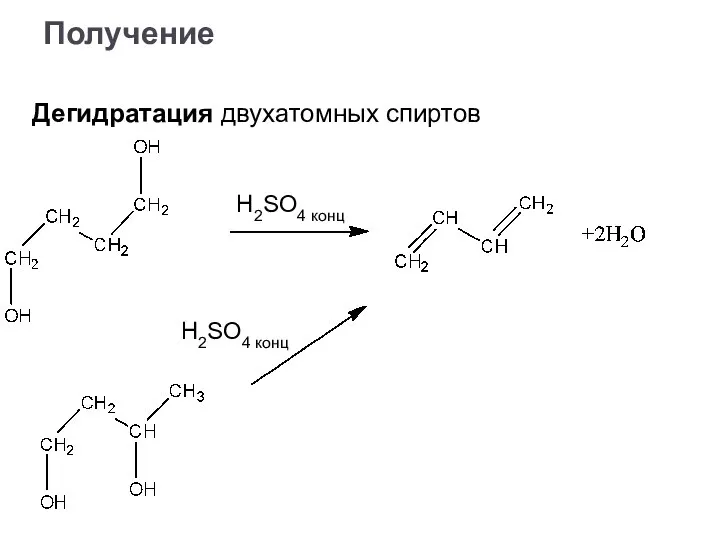
- 39. Получение Дегидратация двухатомных спиртов H2SO4 конц H2SO4 конц
- 41. Натуральный и синтетический каучуки. Резина. Эбонит Каучуки - продукты полимеризации диеновых углеводородов и их производных. Природный
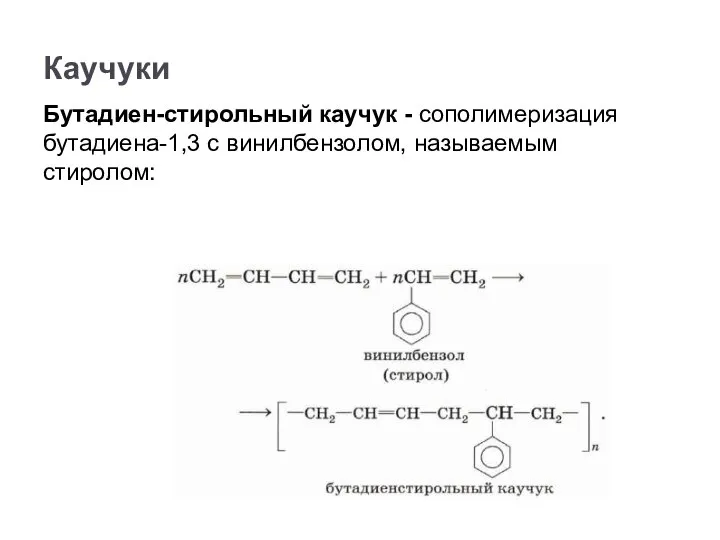
- 42. Бутадиен-стирольный каучук - сополимеризация бутадиена-1,3 с винилбензолом, называемым стиролом: Каучуки
- 44. Скачать презентацию







 Соли Na2SO4
Соли Na2SO4 Понятия и законы в химии. (Лекция 1)
Понятия и законы в химии. (Лекция 1) Презентация на тему Жидкое состояние вещества
Презентация на тему Жидкое состояние вещества  Презентация на тему Галогены
Презентация на тему Галогены  Презентация на тему Классы неорганических веществ. Электролитическая диссоциация
Презентация на тему Классы неорганических веществ. Электролитическая диссоциация  Магнитный момент атома. Периодическая система элементов Д.И. Менделеева
Магнитный момент атома. Периодическая система элементов Д.И. Менделеева Презентация на тему pH жидкостей, необходимых для человека
Презентация на тему pH жидкостей, необходимых для человека  Плавленые сыры без фосфатов
Плавленые сыры без фосфатов Prezentatsia1_1 (1)
Prezentatsia1_1 (1) Строение атома
Строение атома Планетарная модель атома и его строение
Планетарная модель атома и его строение Составитель: Денисова В.Г.
Составитель: Денисова В.Г. Кислоты и соли
Кислоты и соли Общие способы получения металлов
Общие способы получения металлов Алкадиены
Алкадиены Триметилалюминий
Триметилалюминий Биотит и тальк
Биотит и тальк Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Электроны в кристаллах. Квантовая теория свободных электронов в металлах
Электроны в кристаллах. Квантовая теория свободных электронов в металлах Основы материаловедения. Раздел 1
Основы материаловедения. Раздел 1 Строение органических соединений
Строение органических соединений Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Презентация на тему Экологические риски при добыче и переработке нефти
Презентация на тему Экологические риски при добыче и переработке нефти  Альдегиды и кетоны
Альдегиды и кетоны Алгоритм решения задач по химии.
Алгоритм решения задач по химии. Сера и ее соединения
Сера и ее соединения Белки
Белки Презентация на тему Подгруппа углерода и азота
Презентация на тему Подгруппа углерода и азота